漆酶最早是从日本的漆树汁中发现的[1],它是人类研究最早的酶之一,属于多铜氧化酶家族中的一大类,可利用分子氧通过自由基催化反应来氧化各种芳香族和非芳香族化合物,在植物、真菌、细菌中广泛存在,但至今人们对于这种酶的认识比较有限[2]。近年来随着漆酶功能的逐步发现,漆酶的研究受到普遍重视,它在降解木质素方面的功能,使其在制浆造纸工业,特别是纸浆生物漂白方面得到深入的研究和开发[3, 4];在生物能源的开发利用方面应用也很广泛,如利用漆酶降解木质纤维原料中的木质素,提高纤维素水解成单糖的效率及生产乙醇等新能源[5];在环保方面亦具有较大的应用潜力,如可去除有毒的非酚类[6]、除草剂、杀虫剂[7]及合成有机物[8, 9]石油工业废物等物质的毒性。
我们利用密码子最优化方法合成的漆酶基因lac1338,通过原核表达获得了表达量高、热稳定性较好的漆酶HIS-Lac1338,并且该漆酶能够降解多种染料,但是其比酶活相对较低,对染料的降解率也较低,这一定程度上限制了该漆酶的应用。因此,提高漆酶的酶活力及其降解环境污染物的能力具有重要的意义,不仅可扩宽漆酶的工业应用范围,而且可进一步深入研究其结构与功能之间的关系。
本研究首先对漆酶HIS-Lac1338的酶学性质进行研究,并且拟通过易错PCR(error-prone PCR)的定向进化策略对该漆酶基因lac1338进行改造,以酶活力为筛选指标,以获得漆酶活性提高的突变株。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒重组质粒 pUC118-lac1338(GenBank,登录号HM623889)为本实验室构建并保存,pET-32a(+)及Escherichia coli BL2l(DE3)为本实验室保存。
1.1.2 主要试剂胶回收试剂盒、质粒提取试剂盒、PCR产物回收试剂盒购于Omega;蛋白纯化试剂盒购于德国Novagen公司;170 kD Prestained Protein Ladder购自广州赛哲生物科技有限公司;2,2’-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)购于Amresco公司;IPTG、氨苄青霉素购自 TaKaRa 公司。突变试剂盒Diversify® PCR Random Mutagenesis Kit购自Clontech公司。其他常规试剂均为国产分析纯。
1.2 方法 1.2.1 漆酶基因lac1338的克隆及重组质粒构建 1.2.1.1 lac1338的PCR扩增根据lac1338的基因序列,使用 Premier 5 软件设计引物对。lac1338-F:5’-CCG GAA TTC ATG CGC AAA AGT CCC GGA GTC ACT TTT TCA -3’(下划线部分为BamH I酶切位点);lac1338-R:5’-AGC AAG CTT TCA GTC GGG CAT GTT GGG GAT TTC AGG -3’(下划线部分为Hind Ⅲ酶切位点)。以提取的质粒pUC118-lac1338为模板,进行PCR扩增,反应条件:94℃ 30 s;94℃ 10 s,55℃ 5 s,72℃ 9 s,共30个循环;72℃ 5 min。PCR产物经普通PCR试剂盒回收。
1.2.1.2 lac1338基因重组表达菌株的构建 使用限制性内切酶Hind Ⅲ和BamHⅠ双酶切PCR 产物,并连接到表达载体pET-32a(+)的Hind Ⅲ和BamHⅠ位点上,转化到E. coli BL21(DE3)。筛选阳性克隆进行酶切验证,并送样测序。
1.2.2 漆酶Lac1338的表达纯化 1.2.2.1 漆酶基因lac1338在E.coli BL21 中的诱导表达将重组质粒 pET-32a-lac1338转化入E. coli BL2l(DE3)感受态细胞,挑选阳性克隆,37℃ 培养过夜。按1%的接种量接种于100 mL(含100 mg/L 氨苄青霉素)的LB 培养基中,置于37℃、200 r/min下振荡培养至OD600达到0.8左右。加入终浓度0.2 mmol/L 的IPTG及0.5 mmol/L的Cu2+,置于30℃、200 r/min 振荡培养16 h。4℃、4 500 r/min离心15 min 收集菌体。冰浴进行超声波破碎细胞(振幅设为 300 W;超声循环为:超声 5 s,间隔 5 s,时间设为 4 min);4℃、12 000 r/min 离心 10 min,分别取上清和沉淀煮沸 5-10 min;4℃、12 000 r/min 离心 10 min,进行 SDS-PAGE 电泳检测(浓缩胶为 5%,分离胶为 10%)。
1.2.2.2 漆酶Lac1338的纯化参见His·Bind® Purification Kit(Novagen)试剂盒说明书。
1.2.3 HIS-Lac1338的酶学性质研究 1.2.3.1 温度对酶活力的影响(1)最适温度:取10 μL 一定浓度的纯化后酶液,在35-80℃范围内,每隔5℃测定酶活,以最高酶活为100%,计算相对酶活。(2)温度稳定性:取一定量的纯化后的酶液,分别于上述温度孵育120 min,当温度恢复到室温时于55℃下测定酶活力,并计算其相对酶活,以4℃保存的酶液酶活为100%。
1.2.3.2 pH对酶活力的影响(1)最适pH:取10 μL一定浓度的纯化后酶液,分别于不同pH 的Britt-on-Robinson缓冲液中,55℃测定其酶活力,并计算其相对酶活,以酶活力最高者为100%。(2)pH 稳定性:将酶液置于不同pH 的Britton-Robinson缓冲液下于室温中放置4 h,随后在最适pH,最适温度条件下测定其酶活,以未处理的酶样酶活为100%,计算其相对酶活。
1.2.3.3 金属离子及有机物对酶活力的影响(1)Cu2+对漆酶酶活的影响:在不同浓度的Cu2+离子存在条件下,测定漆酶的活性,并以酶活力最高者为100%,计算相对酶活。(2)其他金属离子对酶活性的影响:在柠檬酸-柠檬酸钠缓冲液(pH6.0)及1 mmol/L和100 mmol/L的金属离子存在条件下,测定漆酶的活性,计算相对酶活。对照样品为不含金属离子的酶反应液。(3)几种化合物对酶活性的影响:在1 mmol/L或100 mmol/L的所研究化合物存在条件下,测定漆酶的活性,并计算相对酶活。对照样品为不含所研究化合物的酶反应液。
1.2.3.4 HIS-Lac1338酶促反应动力学参数测定米氏常数Km和最大速度Vmax的测定:以ABTS为底物,在不同底物终浓度(0.2、0.4、0.5、0.8、1.0和2.0 mmol/L)的反应体系中反应,测定其OD405值以计算酶反应的初速度,作Lineweaver-Burk双倒数图。
1.2.4 酶活力测定及蛋白质浓度测定 1.2.4.1 酶活力测定以ABTS为底物,使3 mL 柠檬酸-柠檬酸钠缓冲液(pH6.0)的反应体系中含 5 mmol/L ABTS、6 mmol/L Cu2+和一定浓度的酶液样品,将其混合均匀后于55℃水浴反应3 min,测OD405值,同时做不加酶液的空白对照。该条件下,每分钟催化1 μmol ABTS氧化所需的酶量定义为1个酶活单位(U)。U=(0.1844×OD405)×V1×N/V2×t。y=0.1844x为ABTS自由基浓度与吸光度值的关系曲线[10];V1:反应总体积;V2:测定酶活时所取的酶液体积;N:酶液稀释倍数;t:反应时间。
1.2.4.2 蛋白浓度测定以牛血清白蛋白(BSA)为标准,采用BCA法测定[11]。
1.2.5 lac1338的定向突变以lac1338为模板,按照Diversify® PCR Random Mutagenesis Kit说明书进行易错PCR,选择2.3 bp/kb的突变率,反应体系:PCR Grade Water 39 μL,10× TITANIUM Taq Buffer 5μL,MnSO4(8 mmol/L)1 μL l,dGTP(2 mmol/L)1 μL,50× Diversify dNTP Mix 1 μL,Primer mix各1 μL,Template DNA(~1 ng/μL)1 μL,TITANIUM Taq Polym 1 μL。反应条件:94℃ 30 s;94℃ 30 s,68℃ 90 s,25个循环;72℃ 5 min。将易错PCR产物克隆并构建到表达菌株E. coli BL21(DE3)中表达,筛选产酶量更高,所产酶更耐高温、更耐碱、染料降解率更高的突变酶[12]。
1.2.6 HIS-Lac1338与Lac16对染料的降解比较本研究考察HIS-Lac1338及突变酶Lac16对多种工业染料(苋菜红、靛红、溴酚蓝、酸性紫7、结晶紫、橙红G、刚果红、罗丹明B、亚甲基蓝及考马斯亮蓝G250)的降解作用。以不加酶液为空白对照,37℃摇床过夜(16 h),并同时考察Ca2+与小分子介体ABTS对降解率的影响。
降解率I=(A0-A1)A0×100%,其中,I:降解率;A0:空白对照染料的光吸收值;A1:反应体系样品染料的光吸收值。
1.2.7 突变株三维结构模拟在PHYRE2(http://www.sbg.bio.ic.ac.uk/)中输入目的蛋白的氨基酸序列,预测的结构及PDB文件便输入邮箱。用Pymol软件打开PDB文件,并标注突变位点。根据预测的结构信息,结合突变酶酶学性质与野生型酶对比,分析其位点突变效应。
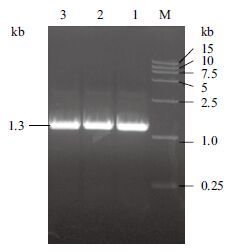
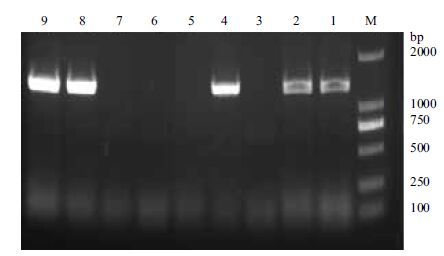
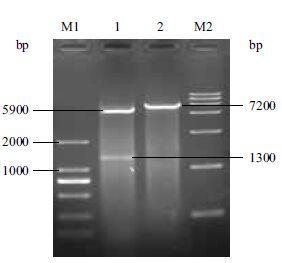
2 结果 2.1 漆酶基因lac1338的克隆及表达菌株的构建通过PCR 方法扩增出1 338 bp的lac1338 基因(图 1),将其成功连接到pET-32a上,重组质粒被命名为pET-32a(+)-lac1338上。将重组质粒转化入E. coli BL21(DE3)感受态细胞中。随机挑取9个转化子进行菌液PCR初步验证转化是否成功。从图 2可以看出转化子1、2、4、8和9菌液PCR成功,扩增出了目的条带,可以初步认为菌落1、2、4、8和9转化成功,提质粒酶切进一步验证,如图 3。双酶切得到1 338 bp左右和5 900 bp左右的两条带,分别是目的基因与空线性质粒pET-32a(+),证明目的基因已成功连接到表达载体上。选取连接正确的转化子做下一步研究。
|
| 图 1 lac1338的PCR扩增产物的电泳分析 M:DL15 000 Make;1-3:lac1338 的PCR产物 |
|
| 图 2 转化子菌液PCR电泳分析 M:Marker;1-9:随机挑选的9个转化子 |
|
| 图 3 重组质粒pET-32a-lac1338的酶切验证 M1:DL 2000;M2:DL 15000;1:被Hind Ⅲ和BamH I双酶切的重组质粒;2:被Hind Ⅲ酶切的重组质粒 |
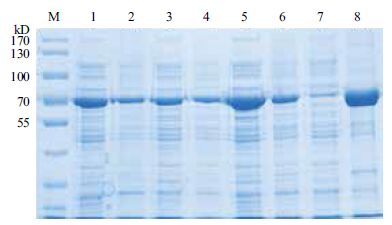
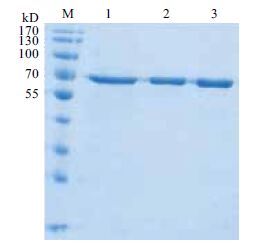
SDS-PAGE分析(图 4)表明,经过IPTG诱导后的重组菌在低于30℃条件下有明显的可溶性重组蛋白表达。粗酶液经His·Bind® Purification Kit(Novagen)纯化,产物进行SDS-PAGE检测,见图 5。纯化后的重组漆酶HIS-Lac1338为单一的条带,分子量约为68 kD (其中18 kD为表达载体上的融合蛋白标签),与理论预测蛋白分子量相同。用BCA法测得纯化后的蛋白浓度为0.25 mg/mL。
|
| 图 4 重组漆酶HIS-Lac1338的最佳诱导培养温度 1、3、5和7:分别为悬浮蛋白在 20、25、30和35℃下的表达量;2、4、6和8:沉淀蛋白在 20、25、30和35℃下的表达量 |
|
| 图 5 纯化后重组漆酶HIS-Lac1338的SDS-PAGE电泳 |
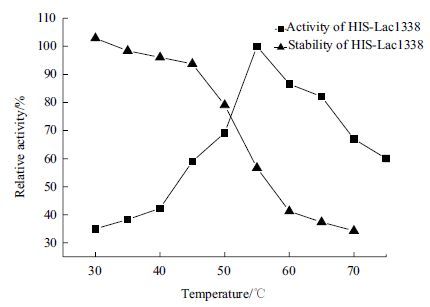
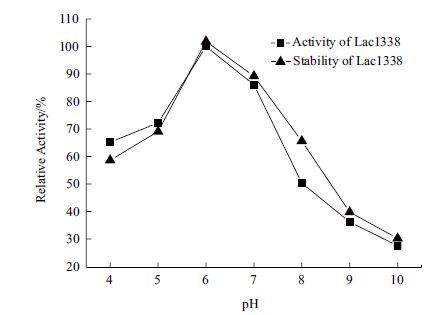
通过在35-80℃范围内的酶活测定,HIS-Lac1338的最适反应温度为55℃(图 6),在35-55℃经 2 h处理,酶活仍保持50%以上;HIS-Lac1338的最适pH为6.0,且在pH4-8之间经4 h的处理仍然保存50%以上的酶活(图 7)。总体来看,HIS-Lac1338有较好的pH稳定性和热稳定性,能够在高温下发挥相对高的酶催化活力。如图 8所示,随着Cu2+浓度增加,酶活性不断提高,当Cu2+浓度达到6.0 mmol/L时,酶活力最高;而当Cu2+浓度大于6.0 mmol/L时,酶活性不断降低,呈一种不对称的钟形结构。由表 1 可以看出,100 mmol/L的Ca2+、Na+和K+对其活性有着一定程度的激活作用;100 mmol/L 的Mn2+对其活性有80%以上的抑制作用,Co+、Fe2+、Hg+和Ag+对其活性完全抑制;而Mg2+在低浓度与高浓度对其活性影响都不大。由表 2可知,100 mmol/L的EDTA及SDS对其活性完全抑制,高浓度与低浓度的尿素和DMSO的对其活性抑制作用差别不大。根据Michaelis-Menten 方程v= Vmax·[s]/Km +[s]的变形方程1/v= Km/Vmax·1/[s]+1/Vmax,通过双倒数作图法,测得反应的Km 和Vmax 分别为567 μmol/L 和2.8 mmol/(L·min·g)。
|
| 图 6 温度对HIS-Lac1338的酶活力和热稳定性的影响(以ABTS为底物) |
|
| 图 7 pH对HIS-Lac1338的酶活力和稳定性的影响(以ABTS为底物) |

|
| 图 8 Cu2+对HIS-Lac1338酶活性的影响(以ABTS为底物) |
根据ABTS自由基吸光度与浓度关系曲线,测出吸光度并计算得酶活力为5.7 U/mL。由BCA 法测得纯化后蛋白浓度为0.25 mg/mL,所以比酶活为22.8 U/mg。
2.5 lac1338的定向突变用电转化方法获得突变文库后,用功能筛选法[13, 14]获得一株比野生型酶活提高1.6倍的菌株,命名为lac16,表达蛋白命名为Lac16。测序表明菌株lac16的碱基与野生型相比有3个碱基发生了突变,相应的氨基酸变化为:72位的苯丙氨酸突变为亮氨酸(UUA-CUA),75位的苯丙氨酸突变为亮氨酸(UUA-CUA),290位的谷氨酰胺突变为精氨酸(CAA-CGA)。
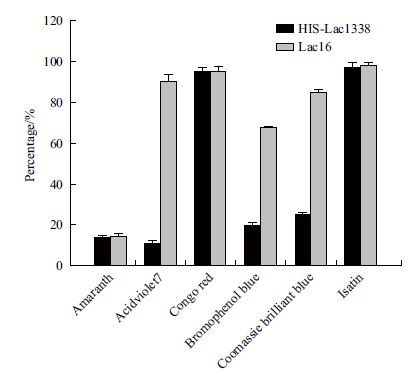
2.6 Lac16与HIS-Lac1338对染料的降解比较HIS-Lac1338对6种染料的降解效果(图 9)显示,ac16与野生型相比,突变后对酸性紫7的降解率大大提高,由10.9%升高到90.5%;对溴酚蓝的降解率也由20%升高到67.8%;对考马斯亮蓝的降解率由25%提高到85%;对苋菜红的降解率由13.7%提高到14.5%;对刚果红和靛红的降解率无明显改善。可见通过易错PCR技术获得功能增强的突变酶是可行的。
|
| 图 9 野生型酶HIS-Lac1338和突变型漆酶Lac16对不同染料的降解情况比较 |
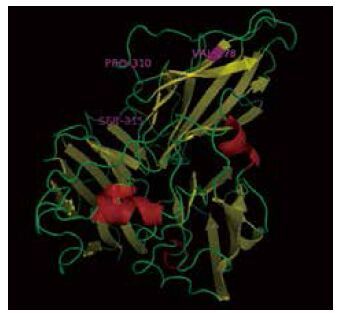
将突变酶和野生型漆酶的氨基酸序列提交到phyre2(http://www.sbg.bio.ic.ac.uk/)蛋白质在线分析服务器,模拟其三维结构并用软件pymol标出结构中的铜原子及突变氨基酸。结果(图 10)显示,该酶以单亚基蛋白的形式存在,整个单体分子由3个杯状(Cupredoxin-like)结构域(Domain 1、2、3)组成,相应的分成3区,每区均具有β -圆桶状(由β -绳带排成β-折页形成所谓的希腊图状)拓扑构型。对比突变酶和野生型漆酶Lac1338的氨基酸序列,突变位点(图中紫色所示)V278A、P310L和S315G距离漆酶的活性中心较远,位于漆酶蛋白的表面或环状区域,相应的碱基变化为GAU→GCU、CCG→CUG、AGC→GGC。
|
| 图 10 突变酶Lac16的三维结构模拟图 |
本研究中的lac1338是通过密码子最佳化方法合成的,这一方法的最大优点是可以使蛋白得到高水平表达,同时我们优化了表达条件,使得该蛋白表达量为目前报道的最高表达量。通过定向进化得突变的Lac16漆酶蛋白。研究表明,突变酶较野生型酶HIS-Lac1338在对染料的降解种类及降解率上都有所改进,表明通过定向进化的方法获取更具工业应用价值的突变酶是可行。利用某种生物的偏爱密码子,避免利用率低的或稀有密码子合成基因,进行基因的重新设计叫密码子最佳化。散在分布的稀有密码子对翻译效率有负面效应,消除稀有密码子、去除去稳定序列、重新设计合成基因,都可能增加蛋白产量,使得蛋白生产更有效和经济。本研究中的lac1338即利用密码子最佳化方法合成而来,研究表明其表达量为目前已知的最高表达量,对其酶学性质及染料降解作用还需作进一步探索,并通过定向进化方法获得染料降解率更高的突变酶。
酶的定向进化是指不需事先了解酶的空间结构和催化机制,而是人为地创造特殊的进化条件,模拟自然进化机制,在体外对酶基因进行改造,并定向筛选、获得具有某些预期特征的进化酶[15]。利用易错PCR(Error prone PCR)或 DNA 改组(DNA shuffling)对酶分子编码基因进行定向进化,可获得催化效率提高的酶蛋白,并改善酶的一系列性质,如稳定性[16, 17]、底物特异性[18]等,是蛋白质工程的重要研究工具。易错PCR是指通过改变PCR的反应条件,如调整反应体系中4种dNTP的浓度、增加Mg2+的浓度、加入Mn2+ 或使用低保真度的Taq酶等,使碱基在一定程度上随机错配而引入多点突变,构建突变库,筛选出所需的突变体。
ABTS 等小分子介体不仅能增强漆酶对染料的降解效率,而且能介导漆酶和非酶底物染料之间的氧化作用,使得漆酶能降解非漆酶底物的染料[19],例如偶氮类染料不是漆酶的底物,大部分的漆酶则不能直接降解此类染料[20],但HIS-Lac1338在ABTS及Ca2+协同作用下能完全降解偶氮类染料罗丹明;对酸性紫7及苋菜红降解率很小,对橙黄G无降解作用;在靛系染料中,只能降解靛红,而不能降解靛蓝,其原因可能是基团结构的差异性影响了漆酶HIS-Lac1338对其降解效果[21]。突变酶Lac16的突变位点都是同类性质氨基酸的替换,如第72氨基酸位点,由非极性氨基酸苯丙氨酸突变成非极性氨基酸亮氨酸;第290氨基酸位点,由极性氨基酸谷氨酰胺突变成精氨酸,这些位点有可能参与维持漆酶催化氧化所需的蛋白空间构像,而同类氨基酸的替换可维持该空间构像[22],在接下来的工作中我们将结合该漆酶蛋白的三维结构及其生物信息学进一步探索突变碱基对其性质改变的原因。Miele等[23]通过定向进化提高糙皮侧耳(P. ostreatus)漆酶POXA1b的酶活性,进而提高了该漆酶对酸性黄49、酸性红266及直接黄106染料的降解率;Koschorreck等[24]研究发现,通过提高地衣芽胞杆菌(B. licheniformis)的漆酶CotA的酶活性,可增强该漆酶对茜素红S、亮蓝R和靛红等染料的降解效果。
4 结论本研究中,与野生型漆酶HIS-Lac1338相比,酶活力提高的突变酶Lac16对酸性紫7、考马斯亮蓝、溴酚蓝和苋菜红等染料的降解率也得到一定的提高,结果表明通过易错PCR的定向进化技术获得的酶活力提高的突变酶,其对环境污染物的降解能力也会得到提高,所以下一步我们希望通过筛选酶活力更高的突变菌株,得到降解染料能力更强的菌株。
| [1] | 王国栋, 陈晓亚. 漆酶的性质、功能、催化机理和应用[J]. 植物学通报, 2003(4) : 469–475. |
| [2] | Hoegger PJ, Kilaru S, James TY, et al. Phylogenetic comparison and classification of laccase and related multicopper oxidase protein sequences[J]. FEBS J, 2006, 273(10) : 2308–2326. |
| [3] | Jeon JR, Baldrian P, Murugesan K, et al. Laccase-catalysed oxidations of naturally occurring phenols:from in vivo biosynthetic pathways to green synthetic applications[J]. Microb Biotechnol, 2012, 5(3) : 318–332. |
| [4] | Rodriguez Couto S, Toca Herrera JL. Industrial and biotechnological applications of laccases:a review[J]. Biotechnol Adv, 2006, 2 : 4. |
| [5] | 王祎宁, 赵国柱, 谢响明, 等. 漆酶及其应用的研究进展[J]. 生物技术通报, 2009(5) : 35–38. |
| [6] | Bourbonnais R, Paice MG. Oxidation of non-phenolic substrates. An expanded role for laccase in lignin biodegradation[J]. FEBS Lett, 1990, 267(1) : 99–102. |
| [7] | Murugesan K. Bioremediation of paper and pulp mill effluents[J]. Indian J Exp Biol, 2003, 41(11) : 1239–1248. |
| [8] | Mikolasch A, Schauer F. Fungal laccases as tools for the synthesis of new hybrid molecules and biomaterials[J]. Appl Microbiol Biotechnol, 2009, 82(4) : 605–624. |
| [9] | Plonka PM, Grabacka M. Melanin synthesis in microorganisms--biotechnological and medical aspects[J]. Acta Biochim Pol, 2006, 53(3) : 429–443. |
| [10] | 张鹏. 以ABTS为底物测定漆酶活力的方法[J]. 印染助剂, 2007(1) : 43–45. |
| [11] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of prot ein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72 : 248–254. |
| [12] | 冯娟, 李荷. 源于红树林土壤宏基因文库的新型磷脂酶A1基因的筛选?克隆表达及酶学性质[J]. 微生物学通报, 2015, 42(3) : 489–496. |
| [13] | 吕季涛, 魏莉, 曹晓璐, 等. 胶孢炭疽 菌拮抗菌株的筛选?鉴定及抑菌物物质分析[J]. 河南农业科学, 2015, 44(7) : 89–93. |
| [14] | 夏玉林, 程力慧, 李荷. 南海海洋沉积物中抗肿瘤活性菌株的初步筛选与鉴定[J]. 广东药学院学报, 2014, 30(1) : 77–30. |
| [15] | 刘卫晓, 钱世钧. 酶分子体外定向进化的研究方法[J]. 微生物学通报, 2004, 31(2) : 100–104. |
| [16] | Eijsink VG, Gseidnes S, Borchert TV, et al. Directed evolution of enzyme stability[J]. Biomol Eng, 2005, 22(1/3) : 21–30. |
| [17] | Arnold FH, Wintrode PL, Miyazaki K, et al. How enzymes adapt:lessons from directed evolution[J]. Trends Biochem Sci, 2001, 26(2) : 100–106. |
| [18] | Turner NJ. Directed evolut ion of enzymes for applied biocatalysis[J]. Trends Biotechnol, 2003, 21(11) : 474–478. |
| [19] | Singh Arora D, Kumar Sharma R. Ligninolytic fungal laccases and thei r biotechnological applications[J]. Appl Biochem Biotechnol, 2010, 160(6) : 1760–1788. |
| [20] | Camarero S, Ibarra D, Martinez MJ, et al. Lignin-derived compounds as efficient laccase mediators for decolorization of different types of recalcitrant dyes[J]. Appl Environ Microbiol, 2005, 71(4) : 1775–1784. |
| [21] | Kandelbauer A, Maute O, Kessler RW, et al. Study of dye decolorization in an immobilized laccase enzyme-reactor using online spectroscopy[J]. Biotechnol Bioeng, 2004, 87(4) : 552–563. |
| [22] | Hu MR, Chao YP, Zhang GQ, et al. Molecular evolution of Fome lignosus laccase by ethyl methane sulfonate-based random mutagenesis in vitro[J]. Biomolecular Engineering, 2007, 24 : 619–624. |
| [23] | Miele A, Giardina P, Sannia G, et al. Random mutants of a Pleurotus ostreatus laccase as new biocatalysts for industrial effluents bioremediation[J]. Journal of Applied Microbiology, 2010, 3 : 998–1006. |
| [24] | Koschorreck K, Schmid RD, Urlacher VB. Improving the functional expression of a Bacillus licheniformis laccase by random and site-directed mutagensis[J]. BMC Biotechnology, 2009, 9 : 12–21. |