2. 中国科学院天津工业生物技术研究所 系统微生物工程重点实验室,天津 300308
2. Key Laboratory of Systems Microbial Biotechnology,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308
蛋白质生产是生物技术的重要组成部分,主要包括工业酶和蛋白质类药物抗体疫苗等,发展蛋白质表达系统研究拥有重要的战略意义和巨大的市场需求[1, 2]。在各种表达系统中,丝状真菌蛋白质表达系统潜力巨大、专利前景广阔。随着真菌分子遗传技术和菌种改良策略的进步,尤其是真菌基因组学的发展,利用丝状真菌生产蛋白越来越受到关注[3, 4]。丝状真菌系统是优秀的蛋白质表达系统,目前国际上40%-50%工业酶的生产来自丝状真菌[5]。真菌蛋白质表达和分泌能力是其他系统所无法比拟的,它作为细胞工厂可高效表达分泌胞外蛋白,具有表达量大、胞外分泌率高、蛋白质分子折叠和修饰系统接近高等真核细胞等特点[6]。尽管丝状真菌拥有强大的蛋白质表达分泌机制,但异源的非真菌蛋白质生产仍然面临着巨大问题,主要是异源蛋白表达水平很低,经常徘徊在每升毫克级,而且部分蛋白质不能够表达[5],新的表达系统研究是近年来生物技术领域的竞争焦点之一[7]。
近些年来,由于任何单一菌种都不能满足不同工业蛋白质生产的需求,曲霉和木霉各有优点和局限,因此更多的丝状真菌加入到蛋白质表达宿主菌的候选名单,包括粗糙脉孢菌Neurospora[8-10]和镰刀霉Fusarium[11]等。粗糙脉孢菌(Neurospora crassa)是研究微生物遗传学和分子生物学的模式真菌,是唯一的一个拥有基因组序列、功能基因组工具和全基因组基因敲除突变体库的丝状真菌[12],同时又是天然的纤维素快速降解菌,能够利用木糖、纤维二糖、寡糖等组分其蛋白质分泌能力与里氏木霉的野生型菌株相仿[13, 14],并且拥有较好的遗传学研究基础,是利用分子生物学改造构建纤维素酶生产菌株和生产其他目的蛋白的理想菌种,在分子改造方面由于具有完善的有性循环,便于转化,杂交等遗传操作,所以利用粗糙脉孢菌构建蛋白生产系统,在基因工程操作上具有明显优势。目前已经有开发粗糙脉孢菌作为蛋白质表达体系的研究,其中包括表达生产植物蛋白、疫苗抗体和内切葡聚糖酶等[8-10]。本研究将利用粗糙脉孢菌良好的基因组研究资源和全基因组基因敲除突变体库,从载体和宿主改造两方面开展研究,以初步建立纤维二糖诱导的粗糙脉孢菌蛋白质表达系统。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒本研究所用的粗糙脉孢菌Neur-ospora crassa单基因突变株,野生型菌株FGSC2489和质粒pMF272均购自美国真菌遗传保藏中心(Fu-ngal Genetics Stock Center,FGSC)。3个β-葡萄糖苷酶基因(NCU00130、NCU04952和NCU08755)缺失的三突变体菌株(3ΔβG)由本实验室构建得到,组氨酸缺陷型纤维二糖水解酶双突变缺失菌株即三突变菌株Δ2cbhΔhis3由本实验室构建得到。大肠杆菌(Escherichia coli)Top10购自北京康为世纪生物科技有限公司。
1.1.2 试剂限制性内切酶和T4 DNA连接酶购自New England Biolabs(NEB)公司,质粒抽提试剂盒和DNA纯化回收试剂盒购自天根生物公司,寡核苷酸序列由北京金唯智公司合成。纤维二糖(cellobi-ose)购自Sigma公司,Brad-ford试剂购自Bio-Rad公司,对硝基苯葡萄糖苷pNPG和对硝基苯纤维二糖苷pNPC均购自Megazyme公司。
1.1.3 培养基产孢培养基(1 L):1% Vogel’s盐、20 g蔗糖和15 g琼脂粉。
杂交培养基(1 L):1% Westergaards盐,蔗糖15 g和琼脂15 g,调pH值至6.5。
BDES筛选培养基(1 L):1% Vogel’s,1% BDES盐溶液和琼脂15 g,定容到950 mL,高压灭菌,(潮霉素hph终浓度200 μg/mL,需要时添加)。
纤维二糖产酶培养基(1 L):1×Vogel’s盐、20 g纤维二糖和7.5 g酵母粉。
乙酸钠产酶培养基(1 L):1×Vogel’s盐、20 g乙酸钠和7.5 g酵母粉。
Vogel’s盐(1 L):125 g C6H5Na3O7,250 g KH2PO4,100 g NH4NO3,10 g MgSO4·7H2O,5 g CaCl2·2H2O,5 mL微量元素溶液和2.5 mL 0.1 mg/mL生物素溶液。
微量元素盐溶液(100 mL):一水合柠檬酸5 g,ZnSO4·7H2O 5 g,Fe(NH4)(SO)2·6H2O 1 g,CuSO4·5H2O 0.25 g,MnSO4·H2O 0.05 g,H3BO3 0.05 g和Na2Mo4·2H2O 0.05 g,定容体积到100 mL。
Westergaards盐溶液(1 L):KNO3 4 g,KH2PO4 4 g,MgSO4·7H2O 2 g,微量元素盐溶液4 mL和生物素(0.1 mg/mL)200 μL。
BDES盐溶液(1 L):山梨糖200 g,蔗糖10 g和果糖10 g,高压灭菌。
1.2 方法 1.2.1 分生孢子的制备将粗糙脉孢菌(N. crassa)FGSC2489(野生型WT,Mat-a),β-葡萄糖苷酶基因缺失的三突变体菌株(3ΔβG),组氨酸缺陷型纤维二糖水解酶双突变缺失菌株(Δ2cbhΔhis3)在产孢培养基上28℃恒温培养箱培养2 d后,室温培养8 d。
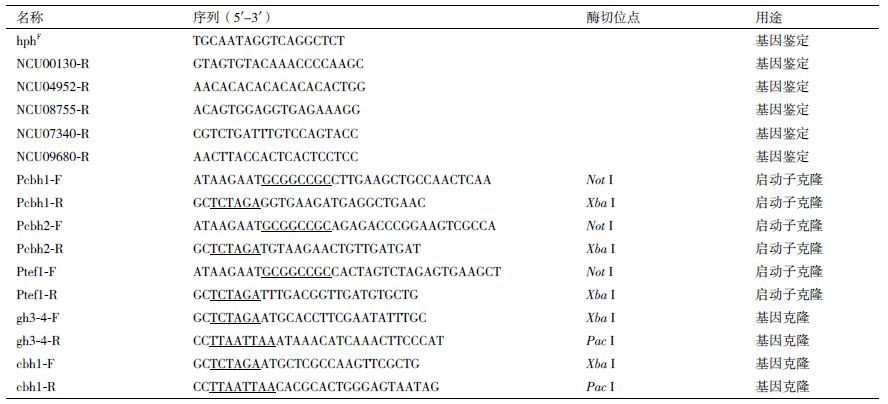
1.2.2 真菌杂交构建表达宿主菌株挑取分生孢子制成孢子悬液,依据Wu等[15]的方法,菌株3ΔβG和Δ2cbhΔhis3进行杂交,于28℃黑暗条件下培养2周后,将培养皿取出放到光照下放置1周,待子囊孢子喷射到皿盖上,用200 μL无菌水从皿盖上洗下孢子收集到离心管中,60℃水浴热激45 min后涂BDES筛选培养基,然后挑取的单菌落到产孢培养基上,提取基因组DNA对其进行PCR鉴定(引物如表 1所示),获得的六突变宿主菌株(Δ3βG∷Δ2cbh∷Δhis3)。
1.2.3 表达载体的构建含有ccg-1强启动子的pMF272作为骨架质粒,带有tev基因、绿色荧光蛋白gfp和his6标签的融合蛋白tev-6×his-gfp由北京金唯智公司合成,并连接至Pac Ⅰ和EcoR Ⅰ酶切线性化的pMF272质粒,转化到Top10感受态细胞中,挑选阳性克隆送到北京金唯智公司测序,测序正确的质粒命名为Pccg1-THG。以野生型粗糙脉孢菌WT(FGSC 2489)的基因组DNA为模板,PCR分别扩增NCU02003(翻译延长因子eEF-1,translation elongation factor eEF-1)、NCU07340(纤维二糖水解酶CBH1基因)、和NCU09680(纤维二糖水解酶CBH2基因)上游1.0 kb的启动子(引物见表 1),将扩增产物进行纯化并连接至Not Ⅰ和Xba Ⅰ酶切线性化的质粒Pccg1-THG,转化到Top10感受态细胞中,挑选阳性克隆测序,测序正确的重组质粒分别命名为Ptef1-THG、Pcbh1-THG和Pcbh2-THG。
以野生型粗糙脉孢菌WT的基因组DNA为模板,PCR分别扩增NCU04952(β-葡萄糖苷酶GH3-4)和NCU07340(纤维二糖水解酶CBH1)基因的ORF,(引物如表 1所示)扩增产物纯化并分别连接至Pac Ⅰ和Xba Ⅰ酶切线性化的质粒Pccg1-THG、Ptef1-THG、Pcbh1-THG和Pcbh2-THG,转化到Top10感受态细胞中,挑选阳性克隆测序,测序正确的质粒命名为Pccg1-GH3-4-THG、Pccg1-CBH1-THG、Ptef1-GH3-4-THG、Ptef1-CBH1-THG、Pcbh1-GH3-4-THG、Pcbh1-CBH1-THG、Pcbh1-GH3-4-THG和Pcbh1-CBH1-THG。
以粗糙脉孢菌六突变菌株(Δ3βG∷Δ2cbh∷Δhis3)菌株为受体菌,依据Margolin等[16]的方法,将1.2.3构建的质粒通过电穿孔的方法转化进入受体菌中,通过组氨酸表型进行转化子筛选,对筛选出的转化子进行荧光显微镜下观察菌丝GFP,从而筛选出GFP表达最强的阳性转化子。
1.2.5 重组蛋白的诱导表达含有ccg-1强启动子的重组菌株孢子接种终浓度为106个/mL,乙酸钠产酶培养基装液量为100 mL培养基/250 mL三角瓶,25℃摇床200 r/min光照培养3 d。依据Znameroski等[17]的方法,含有tef1、cbh1和cbh2强启动子的重组菌株孢子接种终浓度为106个/mL,纤维二糖产酶培养基装液量为100 mL培养基/250 mL三角瓶,25℃摇床200 r/min光照培养3 d。发酵上清液蛋白浓度采用Bradford法测定,以牛血清白蛋白作为标准。实验重复3次,取平均值,同时进行SDS-PAGE电泳检测蛋白表达情况。上清液用Western blot检测重组融合蛋白GH3-4-GFP 和 CBH1-GFP,所用一抗为GFP-Tag鼠单克隆抗体,二抗为羊抗鼠ⅠgG-HRP抗体。
1.2.6 酶活测定β-葡萄糖苷酶酶活测定:发酵液用柠檬酸钠缓冲液(0.05 mol/L,pH4.8)稀释至合适浓度,取250 μL稀释发酵液置于50℃水浴锅中预热5 min,取250 μL对硝基苯葡萄糖苷(p-nitrophenyl-β-D-glucoside,pNPG,1 mg/mL)底物同样预热5 min后将两者混匀,置于50℃水浴锅中反应10 min后迅速加入500 μL浓度为1 mol/L的碳酸钠溶液终止反应,置于冰上,OD420测定吸光度值。空白对照采用灭活的发酵液。3个平行样品取平均值。
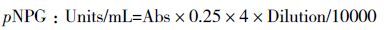
外切纤维素酶酶活测定:发酵液用柠檬酸钠缓冲液(0.05 mol/L,pH4.8)稀释至合适浓度,取250 μL稀释发酵液置于50℃水浴锅中预热5 min,取250 μL对硝基苯纤维二糖苷(p-nitrophenyl-β-D-cellubioside,pNPC,1 mg/mL)底物同样预热5 min后将两者混匀,置于50℃水浴锅中反应10 min后迅速加入500 μL浓度为1 mol/L的碳酸钠溶液终止反应,置于冰上,OD420测定吸光度值。空白对照采用灭活的发酵液。3个平行样品取平均值。
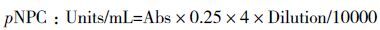
对发酵液中的GH3-4-GFP和CBH1-GFP 融合蛋白表达产物的进行纯化,取诱导3 d的发酵液于4℃,12 000×g 离心30 min,收集上清进行50 kD超滤浓缩,取蛋白浓缩液参照Qiagen公司的Ni-NTA Matric操作手册进行纯化。用buffer A(20 mmol/L NaH2PO4,500 mmol/L NaCl和20 mmol/L imidazole,pH7.4)平衡柱子,样品以1 mL/min的流速流穿Ni-NTA纯化柱,然后用buffer B(20 mmol/L sodium phosphate,500 mmol/L NaCl 和500 mmol/L imidazole pH7.4)进行梯度洗脱,紫外检测仪监控,收集各洗脱峰,SDS-PAGE进行检测,将上述经Ni-NTA层析纯化后的样品用Sephadex G-10 层析介质进行脱盐处理,用0.05 mol/L的醋酸铵缓冲液洗脱Sephadex G-10层析柱,洗脱速度为2 mL/min,收集洗脱峰。将经脱盐处理的蛋白样品参照上海索莱宝生物科技有限公司TEV蛋白酶操作手册进行tev-6×his-gfp的切割,蛋白上清液30℃反应6 h后,于4℃,12 000×g 离心30 min,收集上清进行50 kD超滤浓缩从而去除6×his-gfp标签。
1.2.8 酶特性分析 1.2.8.1 温度和酸碱度对酶活力的影响分别在40、50、60、70、80和90℃下测定酶活,计算各反应温度与最适温度下酶活的百分比值,作为相对酶活。测定最适pH时,所用底物分别以pH3-12的缓冲液配置,同理计算相对酶活。
1.2.8.2 酸碱度和热稳定性测定将酶液分别在pH 3.0-12.0,40、50、60、70、80和90℃下处理10 min后,立即冰浴,然后在最适反应温度和最适pH下测定酶活。
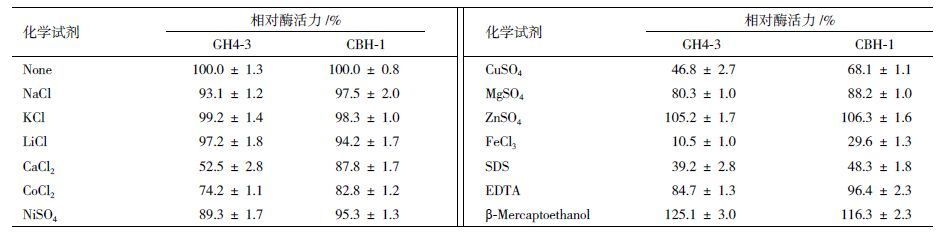
1.2.8.3 金属离子和螯合剂的影响在最适pH与最适温度下,分别测定在10 mmol/L不同金属离子溶液(NaCl、KCl、LiCl、CaCl2、CoCl2、NiSO4、CuSO4、MgSO4、ZnSO4和FeCl3)或金属螯合剂SDS,β-mercaptoethanol和EDTA浓度下的酶活,计算相对酶活。
1.2.8.4 底物专一性分别以1 mg/mL pNPG,pNPC,p-nitrophenyl-β-D-xylopyranoside(pNPX;Sigma-Aldrich)or p-nitrophenyl-α-L-arabinofuranoside(pNPA;Sigma-Aldrich)作底物,在最适pH与最适温度下测定酶活,计算相对酶活。
2 结果 2.1 蛋白表达宿主菌的构建前期研究表明,敲除主要的3个β-葡萄糖苷酶后,粗糙脉孢菌可以在纤维二糖诱导条件下,诱导纤维素酶基因的表达。本研究利用这一特点,开展蛋白表达系统的构建,使目标蛋白可以被纤维二糖显著诱导表达。为了实现这一目标,首先构建出敲除3个主要β-葡萄糖苷酶的缺失菌株3ΔβG,为了减少主要纤维素酶对目标蛋白表达和后期纯化干扰,敲除主要分泌的纤维素酶CBH1和CBH2。为了方便筛选,将组氨酸营养缺陷his3也整合进来,最终构建了六突变菌株(Δ3βG∷Δ2cbh∷Δhis3),命名为LQ-1。
根据文献[15]中的方法对六突变菌株进行PCR鉴定,并对其蛋白分泌情况进行了分析。将野生型粗糙脉孢菌WT(FGSC 2489)、β-葡萄糖苷酶缺失的三突变体菌株(3ΔβG)和六突变菌株LQ-1(Δ3βG∷Δ2cbh∷Δhis3)在2%纤维二糖产酶培养基中200 r/min,25℃振荡培养3 d,对其上清液进行SDS-PAGE电泳检测蛋白表达情况。结果(图 1)显示,在纤维二糖诱导条件三突变体菌株(3ΔβG)分泌的纤维二糖水解酶CBH1和CBH2蛋白条带显著增粗,表明3ΔβG菌株在纤维二糖(CB)培养基上培养后,纤维二糖水解酶CBH1和CBH2表达量明显提高,该检测结果与文献[17]报道的一致,确认纤维二糖为粗糙脉孢菌产纤维素酶的诱导物,而在六突变菌株(Δ3βG∷Δ2cbh∷Δhis3)中由于缺少CBH1和CBH2基因,因此未检测到CBH1和CBH2蛋白,其分泌蛋白的总量也显著减少。观察野生型、三突变体菌株(3ΔβG)和六突变菌株(Δ3βG∷Δ2cbh∷Δhis3)培养基上的生长情况发现,六突变体菌株生长较慢菌丝较稀疏(图 1),构建的六突变体具有低分泌蛋白的背景,用来作为重组蛋白表达的宿主菌株。
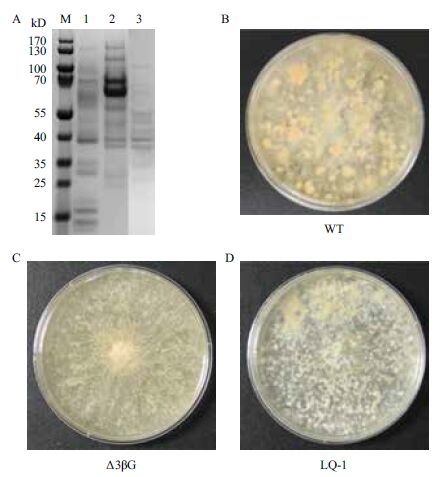
|
| 图 1 蛋白表达宿主菌株的构建 |
强启动子是丝状真菌体内高效表达基因的关键所在。从粗糙脉孢菌的数字基因表达谱测序中,发现了3个在不同纤维素诱导条件下都高效表达的基因,分别是NCU02003(翻译延长因子eEF-1,trans-lation elongation factor eEF-1)、NCU07340(纤维二糖水解酶CBH1基因)和NCU09680(纤维二糖水解酶CBH2基因),选择其上游1.0 kb作为启动子。粗糙脉孢菌常用强启动子ccg-1(可以被乙酸钠显著诱导)被选为对照进行后续表达研究。以pMF272为骨架,按照材料与方法中所述的过程,在待表达的目的基因C端添加融合标签tev-6×his-gfp,构建了4个用于粗糙脉孢菌重组蛋白表达的载体(图 2-A)。
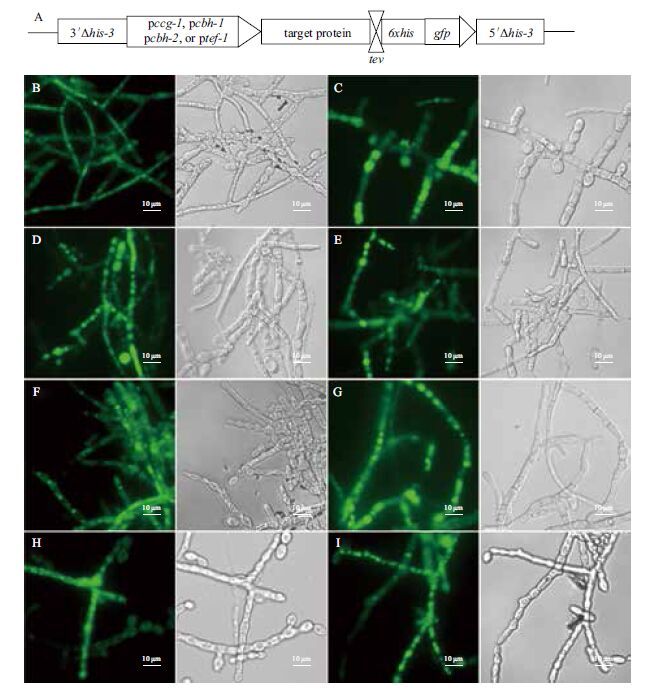
|
| 图 2 不同启动子驱动的融合蛋白GH3-4-GFP和CBH-1-GFP在粗糙脉孢菌菌丝中的表达 A:表达载体构建示意图;B:Pccg1-GH3-4-GFP 阳性转化子;C:Ptef1-GH3-4-GFP 阳性转化子;D:Pcbh1-GH3-4-GFP 阳性转化子;E:Pcbh2-GH3-4-GFP阳性转化子;F:Pccg1-CBH-1-GFP阳性转化子;G:Ptef1-CBH-1-GFP阳性转化子;H:Pcbh1-CBH-1-GFP阳性转化子;I:Pcbh2-CBH-1-GFP阳性转化子,(B-J中的标尺为 10 µm) |
利用六突变宿主株LQ-1基因缺失特性,选取粗糙脉孢菌两个分泌型蛋白(GH3-4和CBH-1)作为测试对象,研究重组蛋白表达分泌情况。将目标蛋白基因通过同源重组定点导入到his3位点上,对成功回补组氨酸缺陷的转化子再进行荧光显微镜观察,筛选出表达绿色荧光蛋白的阳性转化子。将含有强启动子ccg-1的转化子于乙酸钠产酶培养基中进行培养,将含有强启动子Ptef1、Pcbh1和Pcbh2的转化子于纤维二糖产酶培养基中进行培养,48 h后进行观察转化子的菌丝中表达绿色荧光蛋白情况。通过进行荧光显微镜(图 2)的观察,发现获得的转化子具有强烈的绿色荧光,融合蛋白GH3-4-GFP和CBH-1-GFP均已经成功在转化子中表达(图 2),以上结果说明这3个启动子在纤维二糖诱导条件下具有很强的启动能力,可用于蛋白的过量表达,可以利用纤维二糖诱导体系发展粗糙脉孢菌蛋白表达系统。
2.4 重组蛋白GH3-4和CBH-1的表达和纯化含有融合蛋白GH3-4-GFP和CBH-1-GFP的阳性转化子进行诱导产酶培养,3 d后对其发酵的上清液进行SDS-PAGE电泳分析和Western blot检测分析。结果(图 3-A)显示,融合蛋白GH3-4-GFP和CBH-1-GFP的大小约110和100 kD。以空载体pMF272转入宿主菌株作为阴性对照,未发现该融合蛋白。对上清液中分泌的融合蛋白进行Western检测分析,抗体为GFP-Tag标签,结果(图 3-B)显示融合蛋白GH3-4-GFP和CBH-1-GFP成功表达,且分子大小与SDS-PAGE电泳分析结果一致。含有表达盒Pccg1-GH3-4-GFP、Ptef1-GH3-4-GFP、Pcbh1-GH3-4-GFP和Pcbh2-GH3-4-GFP的转化子,分泌的GH3-4-GFP蛋白分别为2.22(±0.08)、2.87(±0.05)、3.01(±0.06)和2.98(±0.08)mg/L。含有表达盒Pccg1-CBH-1-GFP、Ptef1-CBH-1-GFP、Pcbh1-CBH-1-GFP和Pcbh2-CBH-1-GFP的阳性转化子,融合GH3-4-GFP蛋白的分泌水平分别为2.38(±0.02)、2.92(±0.05)、3.04(±0.08)和2.99(±0.06)mg/L。融合蛋白的诱导上清液通过Ni-NTA亲和层析进行SDS-PAGE电泳鉴定(图 3-C)后,最终获得110 kD和100 kD的GH3-4-GFP和CBH-1-GFP纯化样品,该纯化样品通过TEV蛋白酶进行tev-6×his-gfp的切割,最终获得最75 kD和70 kD的GH3-4和CBH-1纯化样品(图 3-C)。蛋白表达水平表明,本研究构建的纤维二糖诱导体系的蛋白表达全部超过目前粗糙脉孢菌最常用的强启动子ccg1。
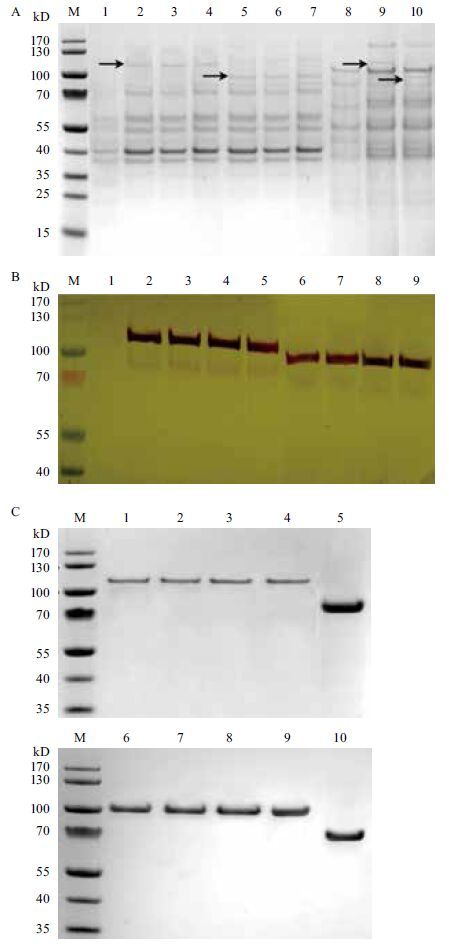
|
| 图 3 SDS-PAGE电泳和Western blotting检测分析 A:上清液SDS-PAGE电泳分析:M:蛋白Marker;1,8:空载体pMF272转入宿主菌株作为阴性对照;2-7:分别为Ptef1-GH3-4-GFP、Pcbh1-GH3-4-GFP、Pcbh2-GH3-4-GFP、Ptef1-CBH-1-GFP、Pcbh1-CBH-1-GFP和Pcbh2-CBH-1-GFP转化子;9,10:Pccg1-GH3-4-GFP和Pccg1-CBH-1-GFP。B:Western blot检测分析:1:宿主菌株作为阴性对照;2-5:Pccg1-GH3-4-GFP、Ptef1-GH3-4-GFP、Pcbh1-GH3-4-GFP和Pcbh2-GH3-4-GFP的转化子;6-9:Pccg1-CBH-1-GFP、Ptef1-CBH-1-GFP、Pcbh1-CBH-1-GFP和Pcbh2-CBH-1-GFP的转化子。C:纯化后的蛋白SDS-PAGE电泳分析:1-4:GH3-4-GFP;6-9:CBH-1-GFP;5,10:TEV蛋白酶切割后GH3-4和CBH-1纯化样品 |
对纯化样品进行酶学特性分析,GH3-4蛋白样品对pNPG表现很强的底物专一性,对pNPC、pNPX和pNPA几乎没有任何反应。CBH-1蛋白样品对pNPC表现很强的底物专一性,对pNPG、pNPX和pNPA几乎没有任何反应。GH3-4 和CBH-1最适反应温度均为60℃,最适反应均为pH4.8(图 4)。热稳定性分析结果(图 4-A,图 4-C)显示,经40-60℃的热处理后,GH3-4和CBH-1都可以保留50%以上的酶活力,70℃时的酶活在20%,当在温度大于70℃时的酶活急剧下降。pH稳定性分析结果(图 4-B和4-D)显示,在pH4.5-6.0范围内,GH3-4有50%及以上的酶活力,高于或低于此pH值酶活均呈下降趋势,CBH-1的酸碱度稳定性高于GH3-4,CBH-1在pH3.0-9.0都可以保留50%以上的酶活力,在pH10.0时酶活性还有20%。

|
| 图 4 温度和pH值对GH3-4(A和B)和CBH-1(C和D)的影响 |
各种化学试剂及离子的对GH3-4和CBH-1的影响(表 2)显示,钠离子、钾离子、锂离子和锌离子对该酶的活性无显著影响,而钙离子、钴离子和铜离子对其酶活性则有显著抑制作用,镍离子和金属螯合剂EDTA对酶活有轻微的抑制作用,铁离子和SDS对酶活抑制影响最大,10 mmol/L铁离子浓度就能抑制GH3-4酶活的90%以上和CBH-1酶活的70%以上,SDS能抑制GH3-4 和CBH-1酶活50%以上。β-mercaptoethanol对酶活有促进作用,可以提高酶活20%左右。
丝状真菌由于其拥有强大的蛋白质表达分泌能力,已经有多个菌种发展成为蛋白质表达系统[3-5]。但是,由于目标蛋白千差万别,任何单一菌种都不能满足所有蛋白质生产的需求,如曲霉和木霉各有优点和局限,因此近年来,有更多的丝状真菌加入到蛋白质表达宿主菌的候选名单,需要深入研究开发新蛋白质表达系统。粗糙脉孢菌具有良好的外源蛋白表达分泌能力,并且拥有很好的遗传学研究基础和基因组数据,目前已经有开发粗糙脉孢菌作为蛋白质表达体系的研究,包括表达生产植物蛋白、疫苗抗体和内切葡聚糖酶等[8-10],这些研究表明粗糙脉孢菌是发展新型异源蛋白表达的良好体系,具有较大的潜力。本研究从模式丝状真菌粗糙脉孢菌出发,通过真菌杂交的方法构建了蛋白质表达分泌的六突变宿主菌,利用基因工程技术构建3个新的诱导型高表达载体,利用纤维二糖可作为表达诱导物,初步建立了粗糙脉孢菌蛋白质表达系统。
近年来,随着真菌分子遗传技术和菌株改良策略的提高,研究者进行了多方面的努力,使得丝状真菌表达分泌异源蛋白的产量得到提高。蛋白质生产首先是在转录水平调节,为了提高蛋白的表达量和分泌量,选择以丝状真菌自身的强启动子构建表达盒来表达重组蛋白。因此,本研究的目的之一是挖掘和识别强启动子来实现对重组蛋白表达的调控。在粗糙脉孢菌中,报道使用最多的是生物钟控制基因(clock controlled protein,ccg-1)[18]和丙酮酸脱羧酶(pyruvate decarboxylase,cfp)的启动子[19]。纤维二糖水解酶Ⅰ强启动子(Pcbh-1)和纤维二糖水解酶Ⅱ强启动子(Pcbh-2)虽然常常在T. reesei的表达系统中被报道使用[20-23],但是在目前已知的粗糙脉孢菌的表达系统中尚未被报道使用。此外,通过对本实验室数字基因表达转录谱的分析比较(数据尚未发表),发现基因NCU02003(translation elongation factor eEF-1)在不同碳源培养条件下都具有很高的表达水平。因此,本研究以基因cbh-1、cbh-2和tef-1的强启动子构建了表达载体,我们发现这3个启动子在粗糙脉孢菌纤维二糖条件下均能高效的表达目的基因,而且全部超过了最常用的启动子ccg1在乙酸钠诱导条件下的表达水平。
其次,高效表达宿主是建立成功的蛋白表达系统的关键因素之一。最近研究发现,3个主要的β-葡萄糖苷酶缺失的三突变体菌株(3ΔβG),该突变体能够以纤维二糖为诱导物显著表达和分泌纤维二糖水解酶CBH1和CBH2[17]。纤维二糖作为诱导物成本上比现有槐糖诱导物低,纤维二糖是可溶物,诱导纤维素酶表达生产优于晶体纤维素等固体诱导物,如在纤维素酶和目标蛋白的分离纯化工艺。我们以3ΔβG为出发菌株,通过真菌杂交进一步缺失了两个纤维二糖水解酶CBH1和CBH2,构建了组氨酸缺陷型的六突变菌株LQ-1(Δ3βG∷Δ2cbh∷Δhis3),该菌株作为表达宿主,可以用纤维二糖为诱导底物诱导产生纤维素酶,同时又能消除纤维二糖水解酶蛋白的背景条带,为粗糙脉孢菌蛋白表达系统的成功构建提供了良好的受体菌株,有利于目标蛋白纯化。我们以两个纤维素酶GH3-4和CBH-1为目标蛋白,与带有tev基因、绿色荧光蛋白gfp和his6的标签蛋白(tev-6×his-gfp)进行融合,利用纤维二糖作为诱导物,融合蛋白在本研究构建的表达系统中进行表达。通过组氨酸缺陷表型和报告基因gfp的荧光显微镜的观察,本研究建立了高效方便的阳性转化子鉴定体系。通过发酵上清液进行酶活力的测定、SDS-PAGE电泳分析和Western blot检测,表明融合蛋白成功进行了表达和分泌,本研究初步建立了粗糙脉孢菌纤维二糖诱导蛋白质的表达系统。GH3-4和CBH-1的酶特性分析,显示它们具有相同的最适反应温度、pH值和热稳定性,其中CBH-1酶活力有广泛稳定的pH耐受值,这可能会对未来碱性纤维素酶的应用发展提供参考。
同三突变体菌株(3ΔβG)分泌的总蛋白量相比较,阳性转化菌株重组蛋白的分泌水平相对较低,而通过荧光显微镜观察显示其转录水平却很高,收集完上清液后,胞内菌丝依然能观察到大量的绿色荧光,这种现象表明了其重组蛋白产量低的瓶颈发生在分泌途径。分泌途径是胞外蛋白生产的关键,丝状真菌中囊泡转运和蛋白分泌途径可能是蛋白生产的瓶颈所在,同时也是具有潜在的可提高分泌生产能力的机制[24, 25]。我们下一步将针对这一瓶颈,在本研究已经初步建成的粗糙脉孢菌表达体系中进一步提高靶蛋白的分泌水平。
4 结论本研究从粗糙脉孢菌出发,构建了纤维二糖诱导的重组蛋白表达体系,包括表达宿主六突变菌株LQ-1(Δ3βG∷Δ2cbh∷Δhis3)和3个含不同强启动子的高效表达载体。以两个纤维素酶GH3-4和CBH-1为例,该系统可以实现重组蛋白的有效表达分泌,为重组蛋白质的表达提供了一个新的技术体系。
| [1] | 林章凛, 李爽. 工业酶-制备与应用[M]. 北京: 化学工业出版社, 2006. |
| [2] | 马延和. 生物炼制-工业过程与产品[M]. 北京: 化学工业出版社, 2007. |
| [3] | Nevalainen KM, Te'o VS, Bergquist PL. Heterologous protein expression in filamentous fungi[J]. Trends in Biotechnology, 2005, 23(9) : 468–474. |
| [4] | Conesa A, Punt PJ, van Luijk N, et al. The secretion pathway in filamentous fungi:a biotechnological view[J]. Fungal Genet Biol, 2001, 33(3) : 155–171. |
| [5] | Ward OP. Production of recombinant proteins by filamentous fungi[J]. Biotechnol Adv, 2012, 30(5) : 1119–1139. |
| [6] | Yaver DS, Lamsa M, Munds R, et al. Using DNA-tagged mutagenesis to improve heterologous protein production in Aspergillus oryzae[J]. Fungal Genet Biol, 2000, 29(1) : 28–37. |
| [7] | 钟耀华, 王晓利, 汪天虹. 丝状真菌高效表达异源蛋白研究进展[J]. 生物工程学报, 2008, 24(4) : 531–540. |
| [8] | Rasmussen-Wilson SJ, Palas JS, Wolf VJ, et al. Expression of a plant protein by Neurospora crassa[J]. Appl Environ Microbiol, 1997, 63(9) : 3488–3493. |
| [9] | Allgaier S, Weilan N, Hamad I, et al. Expression of ribonuclease A and ribonuclease N-1 in the filamentous fungus Neurospora crassa[J]. Appl Microbiol Biotechnol, 2010, 85(4) : 1041–1049. |
| [10] | Allgaier S, Taylor RD, Brudnaya Y, et al. Vaccine production in Neurospora crassa[J]. Biologicals, 2009, 37(3) : 128–132. |
| [11] | Royer JC, Moyer DL, Reiwitch, S G, et al. Fusarium-Graminearum- a-3/5 as a novel host for heterologous protein production[J]. Nat Biotechnol, 1995, 13 : 1479–1483. |
| [12] | Borkovich, K A, Alex LA, Yarden O, et al. Lessons from the genome sequence of Neurospora crassa:tracing the path from genomic blueprint to multicellular organism[J]. Microbiol Mol Biol Rev, 2004, 68(1) : 1–108. |
| [13] | Znameroski EA, Glass NL. Using a model filamentous fungus to unravel mechanisms of lignocellulose deconstruction[J]. Biotechnol Biofuels, 2013, 6 : 6. |
| [14] | Tian C, Beeson WT, Iavarone AT, et al. Systems analysis of plant cell wall degradation by the model filamentous fungus Neurospora crassa[J]. Proc Natl Acad Sci USA, 2009, 106(52) : 22157–22162. |
| [15] | Wu WH, Hildebrand A, Kasuga T, et al. Direct cellobiose production from cellulose using sextuple beta-glucosidase gene deletion Neurospora crassa mutants[J]. Enzyme Microb Technol, 2013, 52(3) : 184–189. |
| [16] | Margolin BS, Freitag M, Selker EU. Improved plasmids for gene targeting at the his-3 locus of Neurospora crassa by electroporation[J]. Fungal Genet Newsl, 1997, 44 : 34–36. |
| [17] | Znameroski EA, Coradetti ST, Roche CM, et al. Induction of lignocellulose-degrading enzymes in Neurospora crassa by cellodextrins[J]. Proc Natl Acad Sci USA, 2012, 109(16) : 6012–6017. |
| [18] | Freitag M, Hickey PC, Raju NB, et al. GFP as a tool to analyze the organization,dynamics and function of nuclei and microtubules in Neurospora crassa[J]. Fungal Genet Biol, 2004, 41(10) : 897–910. |
| [19] | Temporini ED, Alvarez ME, Mautino MR, et al. The Neurospora crassa cfp promoter drives a carbon source-dependent expression of transgenes in filamentous fungi[J]. J Appl Microbiol, 2004, 96(6) : 1256–1264. |
| [20] | Margolles-Clark E, Harman GE, Penttila M. Enhanced expression of endochitinase in Trichoderma harzianum with the cbh1 promoter of Trichoderma reesei[J]. Appl Environ Microbiol, 1996, 62(6) : 2152–2155. |
| [21] | Zou G, Shi S, Jiang Y, et al. Construction of a cellulase hyper-expression system in Trichoderma reesei by promoter and enzyme engineering[J]. Microb Cell Fact, 2013, 11 : 21. |
| [22] | Zhong YH, Liu X, Xiao P, et al. Expression and secretion of the human erythropoietin using an optimized cbh1 promoter and the native CBH I signal sequence in the industrial fungus Trichoderma reesei[J]. Appl Biochem Biotechnol, 2011, 165(5) : 1169–1177. |
| [23] | Zhang JW, Zhong YH, Zhao XN, et al. Development of the cellulolytic fungus Trichoderma reesei strain with enhanced beta-glucosidase and filter paper activity using strong artifical cellobiohydrolase 1 promoter[J]. Bioresour Technol, 2010, 101(24) : 9815–9818. |
| [24] | Saloheimo M, Pakula TM. The cargo and the transport system:secreted proteins and protein secretion in Trichoderma reesei(Hypocrea jecorina)[J]. Microbiology, 2012, 158 : 46–57. |
| [25] | Fleibner A, Dersch P. Expression and export:recombinant protein production systems for Aspergillus[J]. Appl Microbiol Biotechnol, 2010, 87(4) : 1255–1270. |