Escherichia coli
在强光下,产氧光合生物如植物(包括藻类)以及蓝细菌(蓝藻)很容易遭受光氧化胁迫。单线态氧(1O2)是光氧化胁迫中主要的活性氧形式,具有很高反应性,攻击和氧化蛋白质、脂类和核酸,特别是能激发光合反应中心PSII中D1蛋白的降解,产生光氧化损伤及光抑制现象[1-6]。另外,1O2能作为信号分子在植物应对光氧化胁迫中起着重要作用,而这个过程可能涉及到类胡萝卜素分子的参与[7-9]。
1O2可通过多种方式产生,但一个共同的途径是从光敏剂(色素或染料)分子的三线态形式通过电子能量转移形成。在产氧光合作用中,叶绿素(蓝藻中为胆色素)分子是很好的光敏剂,受光能激发形成三线态叶绿素(或胆色素),然后与分子氧反应很容易形成1O2。特别是强光条件下,光合电子传递链大量减少以及电子传递速率饱和,过剩光能会激发大量的三线态叶绿素(或胆色素)和1O2产生,从而形成氧化胁迫[1, 3, 5, 9]。
植物和蓝藻都已形成一套光保护机制,减少强光下到达光合反应中心的能量和1O2的产生[1, 5, 7-9]。在植物中,与类囊体膜上叶绿素共存的类胡萝卜素除了能辅助捕获光能外,还能将强光下的过剩光能耗散为热,并能直接作为1O2的底物进行非酶氧化,从而减少光合反应中心1O2的浓度,舒缓光氧化胁迫。因此,植物中的类胡萝卜素是能量和单线态氧的双重淬灭剂[5, 7]。另外,类胡萝卜素由1O2非酶氧化形成的醛类或酮类、含有一个活性羰基的裂解产物能够起到信号分子作用,诱导1O2应答基因的表达,从而增强植物对光氧化胁迫的抗性[8]。
相比较,这种能量和1O2双重淬灭的光保护作用在蓝藻中则主要由橙色类胡萝卜素蛋白(Orange Carotenoid Protein,OCP)来完成[1]。OCP是一种结合酮式类胡萝卜素(如3’-羟基玉米黄素)的可溶性蓝藻蛋白,在绝大多数含有藻胆体的蓝藻中都有存在[10]。蓝藻OCP在光感应和能量猝灭方面是必需的。在强的蓝绿光下,OCP被光激活,在藻胆体中将过剩光能耗散为热,同时减少1O2形成[11-14]。不过,最新研究发现,在强的橙红光条件下,OCP不被光激活,但仍能保护蓝藻细胞,这种光保护与OCP作用减少了1O2的浓度有关,体外实验表明OCP在没有类胡萝卜素存在情况下本身就是一个很好的1O2清除剂[15]。OCP的水溶性、结合类胡萝卜素的特性以及本身具备的1O2淬灭功能使得它在抗氧化应用方面具有潜在应用价值。目前,已有报道在大肠杆菌中重组表达OCP和合成类胡萝卜素,进而生产结合类胡萝卜素的OCP[16]。
但是,游离态OCP(不结合类胡萝卜素)本身清除1O2的活性仍然缺乏体内实验证据。本研究首先从蓝藻水体提取的宏基因组中扩增OCP基因SyOCP,然后以大肠杆菌(本身不合成类胡萝卜素)为背景,以光敏剂染料亚甲基蓝(MB:Methylene blue)产生光氧化胁迫[17],通过分析SyOCP重组大肠杆菌对MB的耐受性,旨在体内验证游离态蓝藻OCP内在的抗1O2功能。
1 材料与方法 1.1 材料大肠杆菌菌株DH5α和BL21(DE3)以及质粒pET30a(+)均为本实验室保存。Phusion高保真DNA聚合酶、限制性内切酶Nde Ⅰ和Sac Ⅰ、DNA连接酶均为Thermo Scientific公司产品;质粒DNA提取试剂盒、DNA凝胶纯化试剂盒、PCR mix、DNA和蛋白分子量标准均为北京Transgene公司产品。亚甲基蓝为Sigma公司产品,其它生化试剂均为国产分析纯。
1.2 方法 1.2.1 蓝藻水体宏基因组DNA的提取取一定体积的蓝藻水体(取自昆明滇池),12 000 r/min离心2-5 min,离心后的沉淀相当于1.2 mL过夜培养的大肠杆菌离心后的菌体。加0.5 mL提取缓冲液(50 mmol/L Tris-HCl pH8.5,5 mmol/L EDTA,50 mmol/L NaCl),重悬彻底;加等体积的Tris饱和酚,混匀,65℃加热5-10 min,中间短促混匀2-3次,12 000 r/min离心5 min;取上清,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),混匀,12 000 r/min离心5 min;取上清,加入等体积的氯仿,混匀,12 000 r/min离心5 min;取上清,加入1/10体积的3 mol/L醋酸钠(pH5.2)和2倍体积的预冷无水乙醇,-20℃放置30 min;12 000 r/min离心10 min,沉淀用70%乙醇洗一次,室温干燥5-10 min;加入50-100 mL H2O 溶解沉淀。
1.2.2 蓝藻SyOCP基因的克隆根据GenBank中蓝藻Synechocystis sp. PCC 6803的OCP对应DNA序列(Acc. CP003265.1的1765600-1766800 nt)设计PCR引物(表 1)。取0.5-1 μL提取的蓝藻水体宏基因组DNA为模板,利用引物SyOCP-Fw、SyOCP-Rv和Phusion 高保真DNA聚合酶进行第一轮PCR(退火温度为56℃)。扩增产物经电泳检测,根据情况进行适当倍数稀释或不稀释,取1 μL为模板,用引物SyOCP-5Nd、SyOCP-3Sc和Phusion 高保真DNA聚合酶进行第二轮PCR(50℃退火,1个循环;60℃退火,30个循环)。将胶回收的第二轮PCR产物SyOCP用Nde Ⅰ、Sac Ⅰ双酶切,纯化后与同样酶切的质粒pET30a(+)连接、转化DH5α,然后利用引物SyOCP-5Nd和Tt7Dw-Rv、通过菌落PCR(退火温度为53℃)鉴定阳性重组克隆pET(SyOCP),随后通过测序验证。
将表达载体pET(SyOCP)转化大肠杆菌BL21(DE3)。挑单克隆接菌于LB液体培养基(含100 μg/mL 氨苄青霉素),37℃培养过夜;按1∶100比例将菌液转接于相同培养基,37℃培养至OD600为0.6;然后,加ⅠPTG至终浓度0.5 mmol/L,30℃继续培养7 h。诱导表达菌离心后的菌体用PBS缓冲液(pH7.4)重悬,然后进行超声破菌。取16 μL 细菌裂解物,12 000 r/min离心5 min;转移全部上清作为样品S,沉淀用16 μL PBS缓冲液重悬后作为样品P,同时取16 μL 细菌裂解物作为样品T。另外,在加IPTG前取200 μL菌液,离心后菌体用16 μL PBS缓冲液重悬,作为未诱导样品(UI)。所有样品加4 μL 5×蛋白上样缓冲液,混匀后煮沸5 min,然后用12% SDS-PAGE进行电泳分析[18]。通过比较诱导前后的蛋白电泳条带判断SyOCP基因在大肠杆菌中的表达情况。
1.2.4 大肠杆菌对亚甲基蓝的抗性分析从大肠杆菌BL21(DE3)[含表达载体pET(SyOCP)或对照空载体pET30a(+)]的LB平板上挑单克隆接菌,37℃培养过夜;按1∶100比例进行菌液转接,37℃培养至OD600为0.6(或调至0.6),然后进行以下两种实验:(1)菌落点板:将菌液进行梯度倍数(1、2、4和8)稀释,各取2 μL成排点样在LB平板[含100 μg/mL 氨苄青霉素、0.5 mmol/L IPTG以及不同浓度(20、30和40 μmol/L)的亚甲基蓝]上,平板于37℃光照下培养1-2 d,最后通过Bio-Rad公司的凝胶成像系统拍照。(2)细菌生长曲线测定:往菌液加入终浓度0.5 mmol/L IPTG以及不同终浓度(0 μmol/L和25 μmol/L)的亚甲基蓝,37℃光照下继续培养9 h,每隔1 h测定OD600值;最后以OD600值为纵坐标、培养时间(h)为横坐标进行作图。该实验重复2次,通过比较表达菌[含pET(SyOCP)]和对照菌[含pET30a(+)]的菌落生长状态和生长曲线,判定其对亚甲基蓝的抗性。
1.2.5 生物信息学分析和统计分析引物设计、核酸和蛋白序列分析通过Invitrogen公司的分子生物学软件Vector NTI Advance 11进行。使用NCBI在线工具Blastn和Blastp分别进行核酸和蛋白的序列多重比对,并采用邻近法(Neighbor-joining)生成与其关联的系统进化树。实验数据分析及作图使用Microsoft Excel程序。
2 结果 2.1 蓝藻SyOCP基因的克隆蓝藻在营养丰富的淡水中能大量繁殖。本工作从取自昆明滇池的蓝藻水体中提取宏基因组总DNA,取1 μL作为模板,用引物SyOCP-Fw、SyOCP-Rv进行第一轮PCR,取5 μL进行电泳检测,结果(图 1-A)未能明显观察到目的扩增条带(预期大小为1 036 bp)。直接取第一轮PCR产物1 μL作为模板,用引物SyOCP-5Nd、SyOCP-3Sc进行第二轮PCR(巢式),取5 μL进行电泳检测,结果获得了非常明亮的、特异性好的扩增条带,但大小似乎偏小(图 1-B)。但该条带的胶回收产物1 μL经电泳检测后,大小与预期(972 bp)一致(图 1-C),取名为SyOCP。由于引物SyOCP-5Nd、SyOCP-3Sc的5’末端分别引入了酶切位点Nde Ⅰ和Sac Ⅰ,因此第二轮PCR产物SyOCP通过Nde Ⅰ、Sac Ⅰ双酶切,直接克隆到了大肠杆菌表达载体pET30a(+)上,菌落PCR(使用引物SyOCP-5Nd和Tt7Dw-Rv)条带明亮、大小正确(图 1-D),表明获得了蓝藻SyOCP基因的大肠杆菌重组表达载体pET(SyOCP)。
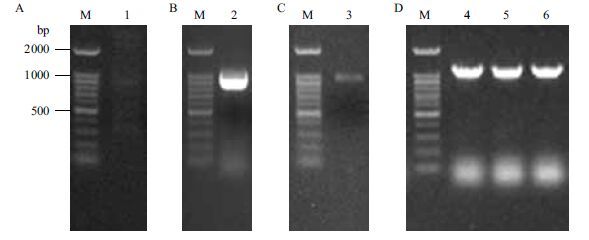
|
| 图 1 SyOCP基因的克隆 1:第一轮PCR;2:第二轮PCR;3:纯化的PCR产物;4-6:重组克隆的菌落PCR鉴定;M:100 bp DNA ladder |
利用T7启动子和终止子引物对pET(SyOCP)质粒DNA进行双向测序,结果表明扩增的SyOCP基因编码区大小为954 bp,编码一个317氨基酸的蛋白(理论分子量大小为34.7 kD)。与GenBank数据库中蓝藻Synechocystis PCC 6803的OCP相应序列进行比对分析,结果显示扩增的SyOCP基因有4个碱基突变(T与C之间互变),但均为沉默突变,未造成蛋白的氨基酸序列改变(图 2,黑体阴影字母为突变产生碱基)。

|
| 图 2 SyOCP基因的核苷酸序列及其推导的蛋白序列 黑体阴影字母表示突变碱基(‘C→T’或‘T→C’),均为沉默突变,未改变氨基酸序列 |
分别以SyOCP基因编码区及其推导的蛋白序列作为检索对象,利用NCBI 在线Blastn、Blastp工具进行核酸和蛋白的序列多重比对,随后分别生成基于邻近法的系统进化树。结果(图 3)显示,本研究从蓝藻水体中克隆的SyOCP与其直系同源物(Ortholog)在基因和蛋白进化上似乎仅局限于蓝细菌内,它们的最远亲缘体为拟甲色球藻(Chroococcidiopsis,一种耐极端环境的最原始蓝藻),植物中没有其同源物。而且,SyOCP几乎可以认为就源自于自然界中的主要集胞藻菌(Synechocystis sp. PCC 6803)。另外还发现,就SyOCP同源比较而言,在基因水平上集胞藻与聚球藻(Synechococcus)、无类囊体蓝藻(Gloeobacter violaceus)等最同源(图3-A),而在蛋白水平上集胞藻则与螺旋藻(Spirul-ina)和节旋藻(Arthrospira)的亲缘关系最近(图3-B)。有趣的是,在基因系统进化树中发现了SyOCP的高度同源基因存在于枯草芽胞杆菌(Baci-llus subtilis)中(图 3-A),其中原因还不得而知。
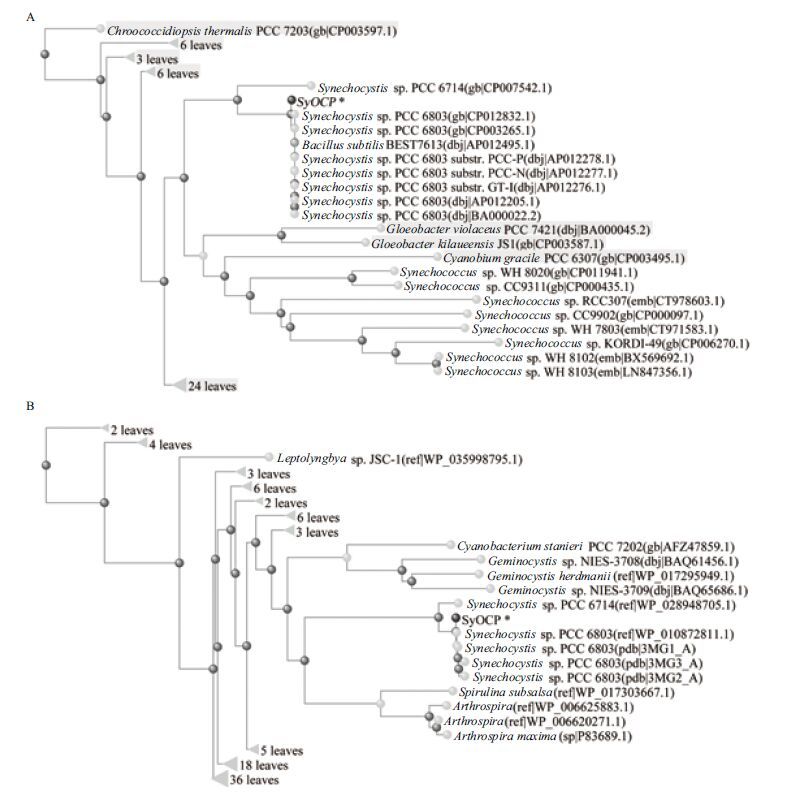
|
| 图 3 邻近法构建SyOCP基因(A)及蛋白(B)的系统进化树 ‘*’表示SyOCP的基因或蛋白;‘▲’标示未被展开显示的SyOCP蓝细菌直系同源物 |
含表达载体pET(SyOCP)的大肠杆菌BL21(DE3)用0.5 mmol/L IPTG于30℃诱导表达7 h,超声裂解后经12% SDS-PAGE分析,结果(图 4)表明SyOCP基因在大肠杆菌中获得了高水平的表达,而且重组表达蛋白大部分可溶,位于上清组分(S)中,大小接近于其理论分子量(34.6 kD)。
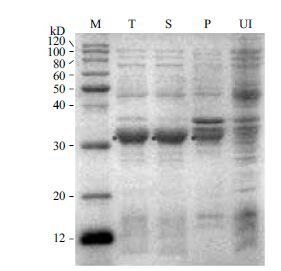
|
| 图 4 SyOCP基因在大肠杆菌BL21(DE3)中的重组表达 M:蛋白质分子量标准;T:细菌裂解总蛋白;S:‘T’的上清;P:‘T’的沉淀;UI:未诱导细菌。‘*’表示重组表达蛋白SyOCP |
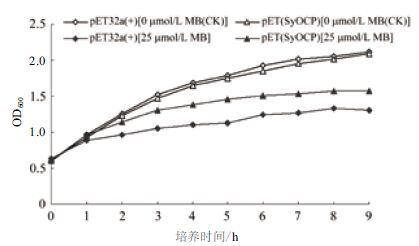
本研究进一步分析了SyOCP在大肠杆菌中的功能,即检测异源表达SyOCP的大肠杆菌对亚甲基蓝(MB)的抗性。菌落点板实验结果(图 5)显示,含表达载体pET(SyOCP)的大肠杆菌BL21(DE3)菌株相比含对照空载体pET30a(+)的菌株,在无MB平板上的菌落生长没有明显差异;而在所有含不同浓度(20、30 和40 μmol/L)MB平板上的菌落生长都受抑制,但前者状况更好,而且这种差异整体上随点菌稀释倍数的增加和MB浓度的增加而愈加显著。同时,细菌生长曲线测定结果(图 6)也表明,大肠杆菌生长确实受MB(25 μmol/L)抑制,但含pET(SyOCP)的菌株相比对照菌株[含pET30a(+)]生长得更快,受抑制程度更低。这些结果归纳起来说明,在大肠杆菌中异源表达SyOCP显著提高了宿主菌对MB的抗性。
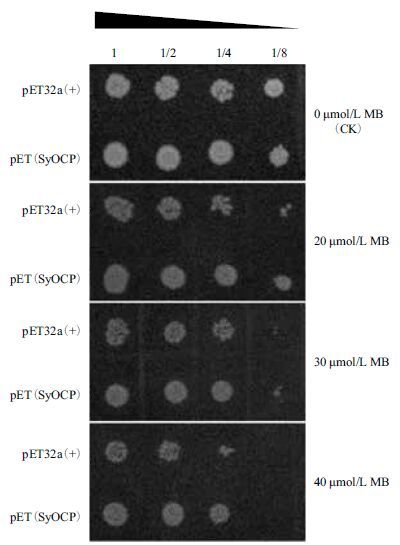
|
| 图 5 菌落点板分析SyOCP表达大肠杆菌对亚甲基蓝(MB)的抗性 |
|
| 图 6 细菌生长曲线分析SyOCP表达大肠杆菌对亚甲基蓝(MB)的抗性 |
蓝藻水溶性橙色胡萝卜素蛋白(OCP)在强光下被激活发挥双重光保护作用——淬灭过剩能量和1O2,帮助蓝藻细胞抵御光氧化胁迫[1, 11-14];同时,OCP蛋白本身还可以直接作为1O2的清除剂[15],但游离态OCP的体内生物学活性仍没有得到验证。
本研究成功从滇池蓝藻水体提取的宏基因组中扩增得到OCP基因SyOCP。生物信息学分析表明SyOCP就是来源于主要蓝藻种类——集胞藻(Synechocystis sp. PCC 6803)。这种不需要预先分离蓝藻特定菌株、直接从蓝藻水体宏基因组中扩增OCP基因的简捷方法可用于克隆其它蓝藻基因,甚至可用作借鉴从其它环境宏基因组中分离目标基因。不过,特别要提及的是,最好采用两轮PCR扩增,因为首轮PCR的目标产物量经常较低,而第二轮嵌套式PCR则很容易扩增出足量的目标基因。
通过IPTG诱导,SyOCP基因在大肠杆菌中获得了高水平的蛋白表达,并且大部分可溶。该结果印证了OCP的水溶特性。另外,我们通过菌落点板法和细菌生长曲线测定法分析,发现异源表达SyOCP显著增强了重组大肠杆菌对常见1O2光敏诱发剂——亚甲基蓝的耐受性(图 5,图 6)。大肠杆菌本身不合成类胡萝卜素,所用培养基中也没有添加类胡萝卜素,因此这种耐受性应该归因于大肠杆菌重组表达的SyOCP蛋白对1O2(亚甲基蓝受光激发产生)的直接清除。该结果是通过细胞体内分析验证了游离态OCP直接淬灭1O2的生物学活性。
水溶性抗1O2的OCP能结合脂溶性的类胡萝卜素,可被认为是一类“载脂蛋白”。 类胡萝卜素又是重要的抗氧化剂(包括抗1O2),因此推测结合类胡萝卜素的OCP应该起着独特的抗氧化作用(面大、部位广、效果佳),它在抗氧化方面的应用前景十分广阔。目前已有报道在大肠杆菌中重组生产结合类胡萝卜素的OCP[16],可以作为抗氧化添加组分用于食品、化妆品等行业。另外,我们注意到,植物中的强光保护机制主要是通过类囊体膜上与叶绿素共存的类胡萝卜素直接起作用,将过剩光能耗散为热,减少三线态叶绿素和1O2产生,并作为底物以非酶氧化方式清除1O2,从而最终减少光反应活性中心PSII中的1O2浓度,缓解光氧化胁迫和光抑制[5, 7]。生物信息学分析表明植物中没有OCP的直系同源物,那么蓝藻中独有的、由OCP介导的光保护机制是否可以通过转基因引入以提高植物对强光的耐受性,是我们下一步要探讨的问题,而本研究已为此奠定了较好的前期研究基础。
4 结论本研究直接从蓝藻水体提取的宏基因组中扩增得到OCP基因SyOCP,该基因来源于主要蓝藻种类——集胞藻(Synechocystis sp. PCC 6803)。通过IPTG诱导,SyOCP基因在大肠杆菌中获得了高水平的可溶性表达。而且,异源表达SyOCP的重组大肠杆菌对亚甲基蓝的耐受性得到了显著提高,从而在体内验证了蓝藻OCP(不结合类胡萝卜素)内在的抗1O2功能。
| [1] | Kirilovsky D. Modulating energy arriving at photochemical reaction centers:orange carotenoid protein-related photoprotection and state transitions[J]. Photosynth Res, 2015, 126(1) : 3–17. |
| [2] | 刘科, 孙健, 徐英凯, 等. 光系统Ⅱ颗粒内单线态氧诱导产生超氧阴离子自由基[J]. 植物学报, 2005, 43(9) : 988–990. |
| [3] | Ogilby PR. Singlet oxygen:there is indeed something new under the sun[J]. Chem Soc Rev, 2010, 39(8) : 3181–3209. |
| [4] | 陶宗娅, 邹琦. 植物光合作用光抑制分子机理及其光保护机制[J]. 西南农业学报, 1999(12S) : 9–18. |
| [5] | Telfer A. Singlet oxygen production by PSII under light stress:mechanism,detection and the protective role of β-carotene[J]. Plant Cell Physiol, 2014, 55(7) : 1216–1223. |
| [6] | Triantaphylidès C, Krischke M, Hoeberichts FA, et al. Singlet oxygen is the major reactive oxygen species involved in photooxidative damage to plants[J]. Plant Physiol, 2008, 148(2) : 960–968. |
| [7] | Ramel F, Birtic S, Cuiné S, et al. Chemical quenching of singlet oxygen by carotenoids in plants[J]. Plant Physiol, 2012, 158(3) : 1267–1278. |
| [8] | Ramel F, Mialoundama AS, Havaux M. Nonenzymic carotenoid oxidation and photooxidative stress signalling in plants[J]. J Exp Bot, 2013, 64(3) : 799–805. |
| [9] | Triantaphylidès C, Havaux M. Singlet oxygen in plants:production,detoxification and signaling[J]. Trends Plant Sci, 2009, 14(4) : 219–228. |
| [10] | Boulay C, Abasova L, Six C, et al. Occurrence and function of the orange carotenoid protein in photoprotective mechanisms in various cyanobacteria[J]. Biochim Biophys Acta, 2008, 1777(10) : 1344–1354. |
| [11] | Gwizdala M, Wilson A, Kirilovsky D. In vitro reconstitution of the cyanobacterial photoprotective mechanism mediated by the orange carotenoid protein in Synechocystis PCC 6803[J]. Plant Cell, 2011, 23(7) : 2631–2643. |
| [12] | Wilson A, Ajlani G, Verbavatz JM, et al. A soluble carotenoid protein involved in phycobilisome-related energy dissipation in cyanobacteria[J]. Plant Cell, 2006, 18(4) : 992–1007. |
| [13] | Wilson A, Boulay C, Wilde A, et al. Light-induced energy dissipation in iron-starved cyanobacteria:roles of OCP and IsiA proteins[J]. Plant Cell, 2007, 19(2) : 656–672. |
| [14] | Wilson A, Punginelli C, Gall A, et al. A photoactive carotenoid protein acting as light intensity sensor[J]. Proc Natl Acad Sci USA, 2008, 105(33) : 12075–12080. |
| [15] | Sedoud A, López-Igual R, Ur Rehman A, et al. The cyanobacterial photoactive orange carotenoid protein is an excellent singlet oxygen quencher[J]. Plant Cell, 2014, 26(4) : 1781–1791. |
| [16] | de Carbon CB, Thurotte A, Wilson A, et al. Biosynthesis of soluble carotenoid holoproteins in Escherichia coli[J]. Sci Rep, 2015, 5 : 9085. |
| [17] | Kim SY, Kim EJ, Park JW. Control of singlet oxygen-induced oxidative damage in Escherichia coli[J]. J Biochem Mol Biol, 2002, 35(4) : 353–357. |
| [18] | 萨姆布鲁克J, 拉塞尔DW, 黄培堂, 等. 分子克隆实验指南[M]. 北京: 科学出版社, 2008. |





