肌动蛋白(Actin)是真核生物细胞中普遍存在的重要蛋白质,构成细胞骨架中的微丝(microfilament)系统。作为构成细胞骨架微丝系统的基本组分,肌动蛋白起着重要作用,如参与细胞分裂、细胞器运动、细胞形态维持、细胞极性的建成、细胞壁沉积以及细胞伸长等生命活动[1, 2]。该蛋白主要包括α-actin、β-actin 和γ-actin 3种类型,其中,α-actin通常存在于平滑肌细胞中,而β-actin和γ-actin则几乎在所有细胞中存在。目前在高等真核生物中已报道了多个不同的actin基因,在真菌中报道较多的是γ-actin基因[3]。actin基因在各组织和细胞中的表达相对恒定,是高度保守的管家基因,因此,通常在实时定量PCR中作为内参基因。此外,actin基因现已在植物界、动物界和真菌界作为分子系统学研究的重要基因之一[4]。
球根白丝膜菌(Leucocortinarius bulbiger)隶属于担子菌亚门(Basidiomycotina)、伞菌目(Agarica-les)、丝膜菌科(Cortinariaceae)、白丝膜菌属(Leucocortinarius),分布于黑龙江、甘肃、吉林、内蒙古等地[5]。球根白丝膜菌可以食用,具有广阔的经济用途,并且球根白丝膜菌侵染油松,能与油松形成典型的外生菌根[6],对油松生长有显著的促进作用,菌根形成后不仅可以有效提高寄主植物耐干旱性[7, 8]、抗重金属性[9]、促进植物在盐渍环境下的生长[10],而且能够显著提高油松的抗旱能力。前人研究仅揭示菌根真菌影响植物抗逆性的一些现象,但本质上菌根真菌对于植物抗逆性的调节是基于对相关基因表达的调控,即通过上调或下调某些基因的表达以及诱导新的逆境基因表达来增强植物抗逆性[11],菌根同时能增强植物的防病、抗病能力[12]。球根白丝膜菌功能基因的研究需要一个表达量相对恒定的内参基因,actin基因被证明在逆境胁迫条件下表达量相对恒定[13],也经常作为内参应用于植物抗旱基因。
由于受全球环境变化的影响,内蒙古大青山降水量逐年下降,干旱导致的大量菌根真菌丧失,在常规造林的过程中使其自然感染菌根真菌比较困难,人为菌根化苗木的培育显得十分重要,因此,利用球根白丝膜菌侵染油松等植物提高寄主植物的抗干旱性,对于提高造林成活率、提高林地肥力利用率及促进贫瘠林地上的林木生长有着十分重要的意义,在我国广大西部干旱区筛选不同树种的优良菌根真菌是实现菌根化苗木造林的重要技术基础[14]。而有关球根白丝膜菌菌丝体方面研究报道较少,卢丽君[15]报道了其在不同培养基和pH值培养条件下生长特性的研究,邰图雅[16]报道了其分离及培养特性的研究。迄今为止,关于球根白丝膜菌的actin基因研究还未见报道,因此,本研究以球根白丝膜菌菌丝体培养物为材料,用简并PCR法和RACE技术克隆球根白丝膜菌γ-actin cDNA,分析其在不同培养条件下的表达,并验证其作为内标基因的可靠性,旨在为探究球根白丝膜菌与油松菌根共生体的抗逆性相关基因表达和调控机制奠定基础。
1 材料与方法 1.1 材料 1.1.1 材料及试剂球根白丝膜菌通过子实体组织分离获得,现保存于内蒙古农业大学林学院微生物实验室。EASY spin Plus植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司);GoldScript cDNA合成试剂盒(Invitrogen);MidiPurification Kit 离心柱型普通琼脂糖凝胶回收试剂盒(天根公司);5′ RACE 试剂盒(Invitrogen);SMAR TerTM RACE cDNA Amplification Kit 试剂盒(Clontech);Taq DNA 聚合酶(TaKaRa);克隆载体pMD19-T(TaKaRa);感受态大肠埃希菌(Escherichia coli)DH5α(TaKaRa)。
1.1.2 引物根据已知真菌的肌动蛋白基因序列,在其保守区域设计简并引物Lb-actF和Lb-actR,利用简并PCR扩增球根白丝膜菌γ-actin cDNA核心片段;根据分离得到的核心片段序列,设计该基因的特异性引物GSP-1、GSP-2、GSP-3和GSP-4、GSP-5,用于5′和3′-RACE-PCR,引物由上海生工生物技术公司合成(表 1)。
采用RNA提取试剂盒提取球根白丝膜菌总RNA,利用紫外分光光度计测定其纯度和浓度,通过琼脂糖凝胶电泳进行浓度和完整性检测。利用GoldScript cDNA合成试剂盒合成第一链cDNA,具体操作步骤参照试剂盒说明书。
1.2.2 球根白丝膜菌γ-actin cDNA全长扩增及产物克隆、测序核心片段扩增,以cDNA 为模板进行RT-PCR扩增。反应体系(总体积50 μL):10×PCR缓冲液5 μL,2 mmol/L dNTPs 3 μL,10 μmol/L 的上游和下游引物各2 μL,cDNA(约30 ng)5 μL,5 U/μL Taq酶0.5 μL,去离子水32.5 μL。PCR反应条件:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min,4℃保存。PCR 产物经1.0%的琼脂糖凝胶电泳分离,将目的DNA片段用琼脂糖凝胶回收试剂盒回收纯化。
5′-RACE扩增基因末端,采用5′-RACE试剂盒克隆球根白丝膜菌总γ-actin基因的5′端序列。参照试剂盒说明,对总RNA进行目的基因第1链cDNA的合成,纯化后,对cDNA末端加上多聚C。用引物GSP-2和试剂盒内的桥连铆钉引物AAP对已经加dC尾的cDNA进行PCR第1轮扩增。PCR反应体系:加dC尾的cDNA 5.0 μL,10×PCR buffer 5.0 μL,25 mmol/L MgCl2 3 μL,10 mmol/L dNTPs 1.0 μL,10 μmol/L的引物GSP-2和桥连铆钉引物AAP各2.0 μL,5 U/μL Taq酶0.5 μL,无菌去离子水补至50 μL。PCR反应程序:94℃预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,35个循环;72℃延伸5 min,4℃保存。用引物GSP-3和试剂盒内的桥连通用扩增引物AUAP进行第2轮巢式PCR扩增。PCR反应体系:第1轮PCR产物5.0 μL,10×PCR buffer 5.0 μL,25 mmol/L MgCl2 3 μL,10 mmol/L dNTPs 1.0 μL,10 μmol/L的引物GSP-3和引物AUAP各1.0 μL,5 U/μL Taq酶0.5 μL,无菌去离子水补至50 μL。反应程序同上。将第2 轮PCR产物进行电泳并对目的条带进行切胶回收纯化。
3′-RACE 扩增基因末端,参照RACE 试剂盒说明书,使用逆转录酶SMARTScribeTM Reverse Transcriptase和引物3′ CDS primer A对总RNA进行逆转录合成cDNA。以上述合成的cDNA为模板,用引物GSP-4和UPM进行第1轮PCR扩增。反应体系:cDNA 2.5 μL,引物各1 μL,Maser Mix 41.5 μL,无菌去离子水补至50 μL,降落PCR反应程序:94℃ 30 s,72℃ 3 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 3 min,5个循环;94℃ 30 s,68℃ 30 s,72℃ 3 min,27个循环。将第1轮PCR扩增产物稀释50倍,用引物GSP-5和UPM进行第2 轮PCR扩增,反应体系同上。PCR反应程序:94℃ 30 s,68℃ 30 s,72℃ 3 min,20个循环。将第2轮PCR产物进行电泳,并对目的条带进行切胶回收纯化。将上述3个纯化后的PCR产物分别与pMD19-T连接,转化到感受态细胞大肠埃希菌DH5α,菌落PCR检测阳性克隆后送至上海生工生物技术有限公司进行测序。
将上述3个纯化后的PCR产物与pMD19-T连接,转化到感受态细胞大肠埃希菌DH5α,菌落PCR检测阳性克隆后送至上海生工生物技术有限公司进行测序。
1.2.3 球根白丝膜菌γ-actin表达分析分别在不同碳源、磷水平条件下培养球根白丝膜菌菌丝体,进行其γ-actin的表达特异性分析。PACH培养基中分别选用不同碳源(葡萄糖、麦芽糖、蔗糖、D-山梨醇、可溶性淀粉);用0.025、0.05、0.1、0.2、0.4和0.8 mmol/L 6个水平磷(KH2PO4)浓度,28℃培养菌丝体20 d后提取菌丝体总RNA。以等量的RNA反转录cDNA,取等量cDNA进行RT-PCR反应,再取等量的PCR产物进行琼脂糖凝胶电泳,经过3次重复,通过比较目的条带的灰度判定基因表达的强弱。
1.2.4 序列比较与系统进化树构建根据获得的mRNA拼接序列,网上Blast搜索同源性高的序列,进行同源性分析。利用NCBI的OFR Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.Html)识别OFR(open reading frame)序列并推定其所对应的氨基酸序列。使用ExPASy数据库的PortParam软件在线(http://www.expasy.org/tools/protparam.html)分析推定蛋白质基本性质。利用NCBI保守结构域搜索(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),分析蛋白质的保守结构域。在GenBank中,搜索不同真菌的肌动蛋白序列,与球根白丝膜菌肌动蛋白序列进行Clustal W多重序列比较,使用MEGA5软件邻接法(Neighbor-Joining,NJ法)运算1 000次构建系统进化树,用自展法(Bootstraping)对进化树进行评估。
2 结果 2.1 总RNA的检测结果取10 μL RNA样液,稀释100倍,在核酸蛋白测定仪(Eppendrof BioPhotometer)中进行检测,OD260/OD280为1.94-1.96,OD260/OD230为2.45-2.60,说明RNA纯度高,无蛋白质、酚污染,均一性很好。电泳结果(图 1)表明,28S rRNA、18S rRNA与5S rRNA带形整齐,无拖尾,说明RNA完整性很好,点样孔中及其附近也未发现有DNA的污染,证明提取的RNA质量较高,可以用于后续的RT-PCR。
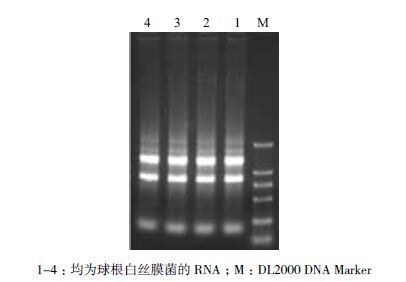
|
| 图 1 球根白丝膜菌RNA 电泳结果 |
用简并PCR法扩增出球根白丝膜菌肌动蛋白基因核心片段,结果(图 2-A)显示,在标准分子质量1 kb处出现较亮的DNA条带,大小基本接近目的条带。图 2-B和图 2-C显示,分别在250 bp处出现了较亮的条带,表明5′和3′末端片段大小分别为200-250 bp和250-500 bp。将测序结果经过全长拼接,球根白丝膜菌肌动蛋白基因的cDNA全长序列除1 137 bp的开放阅读框(ORF),起始密码子为ATG,终止密码子为TAA。还包含5′端92 bp的非编码片段和3′端128 bp的非编码片段,同时3′端有一个27个核苷酸的polyA尾,将其命名为Lb-act,cDNA全长序列提交GenBank,登录号为KC995173。
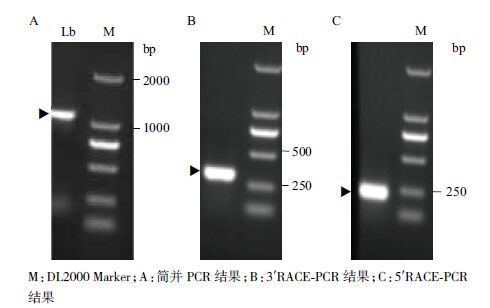
|
| 图 2 简并PCR 及RACE-PCR 产物凝胶电泳 |
Lb-act编码378个氨基酸,理论分子质量大小为95.022 kD,理论等电点是5.12;根据Lb-act氨基酸序列,Blast搜索出12 种同源性高的序列,其中,Lb-act氨基酸序列与担子菌肌动蛋白序列有较高的相似性。该序列与Punctularia strigosozonata、裂褶菌(Schizophyllum commune)、粗毛硬革菌(Stereum hirsutum)、双色蜡蘑(Laccaria bicolor)4 种真菌的肌动蛋白氨基酸序列(EIN04355、XP003026150、EIM-85406和XP001884444)相似性最高,达99%,其次与嗜蓝孢孔菌属的Fomitiporia mediterranea、双孢蘑菇(Agaricus bisporusva)、干朽菌(Serpula lacrymans)、毒蝇伞(Amanita muscaria)4 种真菌的肌动蛋白氨基酸序列(EKM82128、EJD00785、ABQ17974和EGO04181)相似性达98%,与原毛平革菌属(Phanerochaete)的Phanerochaete carnosa、皱木耳(Auricularia delicate)、乳牛肝菌等真菌的肌动蛋白氨基酸序列(EKM59011、EJD35981和AF156258)相似性达97%。
2.4 不同碳源和磷水平培养条件下表达特性及稳定性分析半定量PCR 分析结果(图 3,图 4)显示,不论是单糖葡萄糖,还是双糖麦芽糖和蔗糖,多糖可溶性淀粉以及醇类物质D-山梨醇,还是在不同磷水平条件下Lb-act基因均表达,且表达量基本一致,表明该基因的表达不受外界碳源和磷水平变化的影响。

|
| 图 3 不同碳源培养条件下Lb-act 的表达 |

|
| 图 4 不同磷水平下Lb-act 的表达 |
为进一步探讨球根白丝膜菌肌动蛋白与其他担子菌(包括腐生型和外生菌根真菌)、丛枝菌根真菌(AMF)和子囊菌肌动蛋白在分子系统学上亲缘关系,根据Lb-act蛋白序列,在 GenBank中搜索并参考卓侃等[3]报道,获得16种真菌的肌动蛋白序列。利用MEGA5.0软件,通过N-J法运算1 000次,获得了球根白丝膜菌与上述15种真菌的肌动蛋白系统进化树(图 5)。

|
| 图 5 16 种真菌的肌动蛋白系统进化树 |
从系统进化树可以看出,上述16种肌动蛋白序列聚类为担子菌、AM真菌和子囊菌3个分化群。本研究的球根白丝膜菌肌动蛋白聚在担子菌分化群,与双色蜡蘑聚为一支,其亲缘关系最近,接着与毒蝇伞、粘盖牛肝菌的肌动蛋白亲缘关系近,与灰拟鬼伞和黄孢原毛平革菌的肌动蛋白亲缘关系较远。这在一定程度上可以说明能够形成外生菌根的真菌肌动蛋白相似性较高。本系统进化树中的AM真菌肌动蛋白由2个次级分化群组成,光壁无梗囊霉与Funneliformis caledonium聚为一支,珍珠巨孢囊霉与双紫盾巨孢囊霉聚为其姊妹支。子囊菌肌动蛋白由2个次级分化群组成。
3 讨论肌动蛋白是真核生物细胞中普遍存在的最保守的古老蛋白之一,在进化上具有高度的保守性[17]。本研究通过简并PCR法和RACE技术首次克隆了球根白丝膜菌γ-肌动蛋白的cDNA 全长序列,其具有actin基因的保守特征序列,与前人报道的真菌γ-actin基因特征一致[18]。 许多研究结果表明不同的生物中肌动蛋白的数目变化很大[19],除了大多数酵母菌和丝状子囊菌只有1个单一的肌动蛋白基因外,其他真菌有少数肌动蛋白基因[20]。从外生菌根真菌乳牛肝菌克隆得到2个肌动蛋白基因,并通过实验证实其肌动蛋白基因在营养菌丝及与宿主植物形成的菌根共生体中表达恒定[21],一个理想的内参基因应该是稳定的表达于不同类型的细胞和组织中,且表达量是无显著差别的[22],本实验也得到相同结果,在不同碳源和磷水平培养条件下,Lb-act表达恒定。16种真菌actin基因氨基酸序列同源性比对分析表明,球根白丝膜菌与其它15种真菌的Actin的氨基酸序列仅在少数位点上有差异,由此说明Actin在氨基酸序列水平上具有高度的同源性[23],进一步证明actin基因是高度保守的看家基因。因此,本实验获得的Lb-act可为将来球根白丝膜菌-油松菌根共生体功能基因的研究奠定基础。
由于肌动蛋白基因在进化上的保守性,常被用于构建物种和基因系统进化树,以衡量不同物种之间的亲缘关系和分化时间[24]。本研究构建的肌动蛋白系统进化树中16种不同真菌肌动蛋白聚为担子菌、AM真菌和子囊菌3个分化群,这一聚类结果与传统形态分类结果一致。另外,有学者认为担子菌是由子囊菌进化而来[25],但在该进化树中,担子菌与子囊菌亲缘关系并不是最近,尽管不断发现的分子特征给真菌系统学的研究提供了新的信息,但分子系统学并不能解决所有与生物系统发育有关的问题,因为分子本身也存在一定的局限性,某一特定的分子信息可能缺乏解决真菌某一类群系统发育历史所必需的一些性状[26],因此γ-actin基因能否反映较低分类阶元,如属级阶元物种的分类进化关系及子囊菌与担子菌的系统进化关系有待更多物种γ-actin基因的获得来进一步验证。根据肌动蛋白基因序列构建的系统进化树还只是基因的分子进化树,虽然在区分亲缘关系较远的物种时具有一定的参考价值,但对具较近亲缘关系的物种则无法做出精确衡量。完善的物种进化树有待于今后更多肌动蛋白基因的发现和系统进化分析方法的改进。将球根白丝膜菌Lb-act蛋白序列与Blast搜索出的高同源性序列进行比对分析发现,该序列与多种担子菌肌动蛋白氨基酸序列高度相似,由聚类图可知,球根白丝膜菌与双色蜡蘑亲缘关系最近,但这两种菌形态及分类地位差异较大。在肌动蛋白序列分析中不同目真菌聚为一类,一方面可能表明其肌动蛋白在进化上具有高度保守性,另一方面可能与外生菌根真菌本身的进化有关,这些疑问是今后关注的热点。本聚类结果在肌动蛋白序列上初步分析了球根白丝膜菌与其他15种真菌间的相互关系,但由于未搜索到更多真菌肌动蛋白基因方面的信息,不能在较低的分类阶元更好地反映球根白丝膜菌的分类进化地位,因此球根白丝膜菌与其他真菌间的亲缘关系有待于更进一步的研究。
4 结论球根白丝膜菌肌动蛋白基因的cDNA全长序列除1 137 bp的开放阅读框(ORF)外,还包含5′端92 bp的非编码片段和3′端128 bp的非编码片段,同时3′端有一个27个核苷酸的polyA尾,将其命名为Lb-act,Lb-act氨基酸序列与担子菌肌动蛋白序列有较高的相似性,该基因在不同碳源和磷水平条件下表达恒定,可作为内参基因,cDNA全长序列提交GenBank,登录号为KC995173。
| [1] | Vidali L, Hepler PK. Actin and pollen tube growth[J]. Protoplasma, 2001, 215 : 64–76. |
| [2] | Collings DA, Harper JD, Marc J, et al. Life in the fast lane:actin based motility of plant peroxisomes[J]. Can J Bot, 2002, 80(4) : 430–441. |
| [3] | 卓侃, 罗梅, 廖金玲. 等淡紫拟青霉γ-actin基因cDNA全长的克隆与序列分析[J]. 植物保护, 2010, 36(3) : 78–81. |
| [4] | 方玲, 刘歧莎, 李倩, 等. 肌动蛋白基因和β-微管蛋白基因用于真黏菌系统发育的可行性研究[J]. 菌物学报, 2013, 32(6) : 1004–1011. |
| [5] | 白淑兰. 菌根研究及内蒙古大青山外生菌根资源[M]. 呼和浩特: 内蒙古人民出版社, 2011 : 160-161. |
| [6] | 邵东华, 杨喜平, 张晓东, 等. 浅黄根须腹菌侵染油松形成外生菌[J]. 生态学杂志, 2013, 32(1) : 80–83. |
| [7] | 赵平娟, 安锋, 唐明. 丛枝菌根真菌对连翘幼苗抗旱性的影响[J]. 西北植物学报, 2007, 27(2) : 396–399. |
| [8] | Zhong CL, Zhang Y, Zheng R, et al. Casuarina research and application in China[J]. Symbiosis, 2010, 50(12) : 107–114. |
| [9] | 张小燕, 黄建国, 许金山, 等. 外生菌根真菌与重金属相互作用研究现状[J]. 江苏林业科技, 2004, 31(2) : 42–43. |
| [10] | 李喜梅. 外生菌根菌对盐碱化土壤生物修复的初步研究[D]. 哈尔滨:东北林业大学林学院,2009. |
| [11] | 李涛, 陈保冬. 丛枝菌根真菌通过上调根系及自身水孔蛋白基因表达提高玉米抗旱性[J]. 植物生态学报, 2012, 36(9) : 973–981. |
| [12] | 吴小芹, 孙民琴, 高悦, 等. 几种外生菌根菌对松苗抗非根部病害的影响[J]. 林业科学, 2007, 43(6) : 88–93. |
| [13] | 蒋晓梅, 张新全, 严海东, 等. 柳枝稷根组织实时定量PCR 分析中内参基因的选择[J]. 农业生物技术学报, 2014, 22(1) : 55–63. |
| [14] | 姚庆智, 闫伟. 11株外生菌根真菌菌株纯培养营养生理特性的研究[J]. 内蒙古大学学报:自然科学版, 2005, 36(2) : 187–191. |
| [15] | 卢丽君. 大青山外生菌根真菌培养特性及油松菌根合成研究[D]. 呼和浩特:内蒙古农业大学林学院,2005. |
| [16] | 邰图雅, 春蕾, 斯日古楞, 等. 球根白丝膜菌的分离及培养特性研究[J]. 内蒙古师范大学学报:自然科学汉文版, 2015, 44(3) : 412–415. |
| [17] | 张少斌, 刘国琴. 植物肌动蛋白异型体研究进展[J]. 植物学通报, 2006, 23(3) : 242–248. |
| [18] | Diez B, Marcos AT, Rodrguez M, et al. Structural and phylogenetic analysis of the γ-actin encoding gene from the penicillin-producing fungus Penicillium chrysogenus[J]. Current Microbiology, 2001, 42(2) : 117–121. |
| [19] | 李园莉, 江元清, 赵武玲, 等. 谷子肌动蛋白基因的克隆及序列分析[J]. 植物学通报, 2002, 19(3) : 310–316. |
| [20] | 朱雯雯, 林晓飞, 张文波, 等. 兴安落叶松肌动蛋白基因的分离与序列分析[J]. 生物技术通报, 2011(7) : 95–100. |
| [21] | Tarkka MT, Vasara R, Gorfer M, et al. Molecular characterization of actin genes from homobasidiomycetes:two different actin genes from Schizophyllum commune and Suillus bovines[J]. Gene, 2000, 251(1) : 27–35. |
| [22] | 朱芷葳, 董常生. 持家基因作为相对定量内标物的稳定性比较[J]. 生物技术通讯, 2006, 17(5) : 807–809. |
| [23] | Monizde S, Drouin G. Phylogeny and substitution rates of angiosperm actin genes[J]. Molecular Biology and Evolution, 1996, 13 : 1198–1212. |
| [24] | 孙鹏, 郭玉海, 祁建军. 地黄肌动蛋白基因片段的克隆与序列分析[J]. 安徽农业科学, 2008, 36(20) : 8470–8471. |
| [25] | 邢来君, 李明春. 普通真菌学[M]. 北京: 高等教育出版社, 1999. |
| [26] | 孙广宇, 彭友良, 李振歧, 等. 核苷酸序列分析在真菌系统学研究中的应用[J]. 西北农林科技大学学报:自然科学版, 2003, 31 : 187–192. |





