2. 天津农学院食品科学与生物工程学院,天津 300384
2. College of Food Science and Biotechnology,Tianjin Agricultural University,Tianjin 300384
微生物多糖安全无毒、理化性质优良,在食品、医药、材料等许多工业领域具有广泛的应用价值,比动物多糖、植物多糖具有更为广泛的应用前景[1]。鞘氨醇胶是鞘氨醇单胞菌属菌株合成的一类微生物多糖的统称,其多糖主链结构相似,侧链基团种类多样[2]。韦兰胶是由Sphingomonas sp. ATCC 31555发酵产生的一种胞外多糖,是继黄原胶和结冷胶之后最具市场前景的微生物胶之一。韦兰胶的主链由D-葡萄糖、D-葡糖醛酸、D-葡萄糖和L-鼠李糖的四糖重复单元组成,侧链由单链的L-甘露糖或单链的L-鼠李糖构成[3]。韦兰胶溶液具有独特的剪切稀释性能,以及增稠性、悬浮性和乳化性[4],在石油开采、水泥及混凝土制品等领域具有广泛的应用,并具备在食品、医药等领域应用的潜力[5]。
目前韦兰胶的工业化生产仍存在一些问题,其碳源转化率仅有40%-50%、产量只有15-20 g/L,与黄原胶等微生物胶的发酵生产相比,韦兰胶的碳源转化率和产量都较低,生产成本较高[6],为解决此问题,研究者在培养基和发酵调控方面进行了大量研究,使韦兰胶的发酵产量得到不同程度的提高[7, 8]。但韦兰胶合成菌原生质体制备与再生条件的研究还未见报道,本研究以韦兰胶合成菌Sphingo-monas sp. ATCC 31555为出发菌株,对影响菌株原生质体制备与再生的因素进行了研究,以期获得生产成本低及产量提高的目的菌株,为利用原生质体融合及基因组改组等选育更为优良的菌株提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株韦兰胶产生菌(Sphingomonas sp.)ATCC 31555。
1.1.2 试剂磷酸缓冲液:0.1 mol/L磷酸氢二钠,0.1 mol/L磷酸二氢钠 pH7.0;高渗缓冲液:0.1 mol/L磷酸氢二钠,0.1 mol/L磷酸二氢钠,0.8 mol/L甘露醇 pH7.0;原生质体稳定液(SMM):0.5 mol/L蔗糖,20 mol/L MgCl2,0.02 mol/L顺丁烯二酸,pH6.5;溶菌酶:用SMM溶液配制,终浓度0.5 mg/mL,过滤除菌,-20℃保存备用。酚藏花红染色剂(Sigma)。
1.1.3 培养基固体培养基(g/L):蔗糖15.0,蛋白胨5.0,牛肉膏3.0,酵母膏3.0,琼脂粉15.0,pH7.0。液体培养基(g/L):蔗糖15.0,蛋白胨2.5,磷酸氢二钾2.5,磷酸氢二铵1.5,硫酸镁0.1,酵母粉1.5,pH7.0。补充基本培养基(BNK)(%):蔗糖18.1,蛋白胨0.5,牛肉膏0.3,琼脂粉2.0,pH7.0。再生补充培养基(BZNK)(%):BNK配方中琼脂改为0.8。
1.2 方法 1.2.1 菌种活化取-70℃保藏的菌种Sphingomonas sp. ATCC 31555,在无菌操作条件下将其划线到固体平板培养基上,30℃恒温培养72 h,挑取单菌落在试管斜面上蛇形划线,30℃恒温培养72 h。
1.2.2 菌株发酵曲线的测定在无菌操作条件下,用5 mL无菌水将试管斜面上的菌体冲洗下来,按10%的接种量将其接种到含有100 mL液体培养基的250 mL三角瓶中,30℃,180 r/min摇床培养72 h,定时取样,并测定发酵液的pH、菌数、黏度和韦兰胶的产物量。
1.2.3 原生质体的制备菌株Sphingomonas sp. ATCC 31555液体培养至对数生长前期,取适量菌液在8 000 r/min条件下离心5 min,弃上清液,用磷酸缓冲液洗涤菌体细胞。将菌体悬浮于适量的SMM缓冲液中,使溶液中细胞浓度约含108-109 CFU/mL。取菌液0.1 mL,用无菌水倍比稀释,涂布平板培养基,30℃培养4 d后得菌落数A(菌落总数)。在剩余的菌悬液中加入溶菌酶,混合均匀后于37℃保温一定时间,4 000 r/min 离心10 min,弃上清液,用高渗缓冲液洗涤除酶,取菌液0.1 mL,用无菌水倍比稀释,进行剩余菌数B(未被酶裂解的剩余细胞)的测定。
1.2.4 原生质体的再生取0.1 mL酶解后的原生质体悬液,用SMM缓冲液倍比稀释,取1 mL加入底层BNK补充培养基的中央,再倒入上层BZNK培养基,混匀,30℃培养4-5 d后计数,将菌落数计为C(再生菌落数)。原生质体形成率与再生率的计算公式:原生质体形成率(%)=(A-B)/A×100%,原生质体再生率(%)=(C-B)/(A-B)×100%。
1.2.5 菌体与原生质体的荧光显微镜观察用SMM溶液作溶剂配制0.01%的酚藏花红染色剂[9]。将菌悬液和制备好的原生质体溶液分别与酚藏花红染色剂按1∶1的比例进行染色,然后取少量滴于载玻片上,加盖玻片,在荧光显微镜下进行观察。
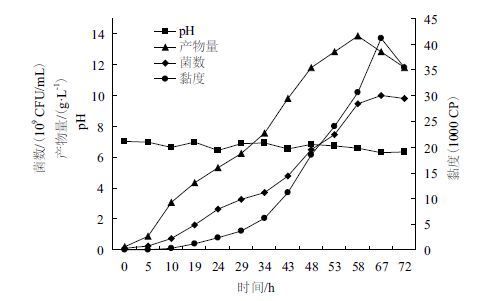
2 结果 2.1 菌株Sphingomonas sp. ATCC 31555的发酵曲线对菌株Sphingomonas sp. ATCC 31555进行72 h的摇瓶发酵,其间进行pH、黏度、菌数和韦兰胶产物量的测定。细胞生长曲线(图 1)显示,菌株在培养5 h后进入对数生长期,58 h进入稳定期,此时菌数达9.5×109 CFU/mL;韦兰胶产物量曲线与细胞生长曲线近乎平行,在58 h时达到韦兰胶产量最高;发酵液的pH在6-7之间小范围波动,因韦兰胶属于酸性多糖,且使用高碳氮比培养基,发酵期间pH总体呈降低趋势,发酵67 h时pH最低为6.31;发酵液的黏度在对数生长期的后期迅速增加,在67 h达到最大值。由于菌株合成产物后,细胞外包裹高分子多糖不利于原生质体的制备,选择黏度较低的10 h菌龄发酵液进行原生质体制备的研究。

|
| 图 1 菌株Sphingomonas sp. ATCC 31555 的发酵曲线 |
本研究对不同浓度梯度的EDTA对菌体进行预处理,结果(图 2)显示,原生质体的形成率随着EDTA浓度的增大而增大,再生率则在12 mmol/L之前呈上升趋势,之后呈下降趋势。随着EDTA浓度的增大,菌体细胞壁的破坏程度越来越大,酶的作用增强,形成率和再生率上升,再生率在EDTA浓度为12 mmol/L之后下降。以原生质体形成率与再生率乘积作为判别标准[10],选择EDTA浓度为12 mmol/L作为原生质体制备与再生的最佳浓度。

|
| 图 2 EDTA 浓度对原生质体形成率与再生率的影响 |
本实验在菌体培养10 h时,加入0-100 μg/mL浓度梯度的青霉素继续培养2 h后,加入EDTA预处理和溶菌酶进行作用,观察青霉素预处理对原生质体制备与再生的影响,结果如图 3所示。菌株原生质体的形成率呈下降趋势,青霉素对再生率的影响比较明显,在青霉素浓度为10 μg/mL之后,原生质体再生率急剧下降,原因是随着青霉素浓度的增大,抑制了菌体的正常生长,细胞数量下降,再加上酶对原生质体的伤害,使得原生质体的形成率和和再生率都降低。综合考虑原生质体的形成率与再生率,选择不加青霉素作为菌株原生质体制备与再生的最佳条件。

|
| 图 3 青霉素浓度对原生质体形成率与再生率的影响 |
对5-245 µg/mL之间浓度梯度的溶菌酶进行实验,结果(图 4)显示,随着酶浓度的增加,原生质体形成率逐渐增大,再生率在酶浓度为45 µg/mL时值最大,为31.1%,之后迅速下降。依据原生质体形成率与再生率乘积最大原则[10],选择酶浓度为45 µg/mL作为原生质体制备与再生的最佳条件。
|
| 图 4 酶浓度对原生质体形成率与再生率的影响 |
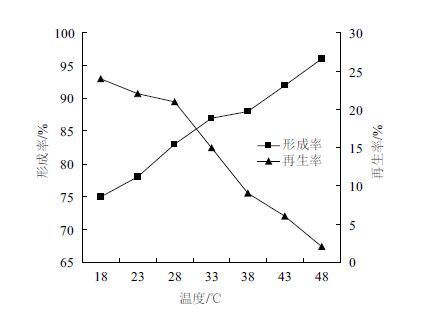
本研究在不同的酶解温度下进行了原生质体制备与再生实验[11],结果如图 5所示。随着温度的升高,原生质体的形成率一直上升,原因是随着温度的升高,酶的活性增强。再生率则相反,呈下降趋势,一方面是因为酶在作用过程中,不仅酶解了细胞壁,还对早期形成的原生质体膜造成了损伤,另一方面是因为菌体的最适培养温度为30℃,温度升高使原生质体的活性降低,导致其破坏甚至死亡,因而再生率较低[12]。综合考虑,选择酶解温度为28℃作为原生质体制备与再生的最佳条件。
|
| 图 5 酶解温度对原生质体形成率与再生率的影响 |
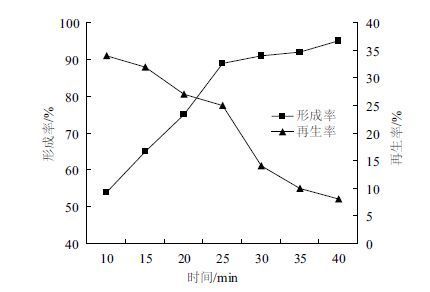
对不同的酶解时间进行研究,结果(图 6)显示,酶解时间在25 min之前,原生质体的形成率上升较快,之后增长缓慢,再生率则一直处于下降趋势。原因是随着酶解时间的延长,在25 min时原生质体基本释放完全,再延长酶解时间,原生质体形成率也不会大幅度增加。由于酶解时间过长,细胞脱壁太彻底,使细胞失去再生的引物,且杂酶的损害程度也增强[13],因而再生率下降。综合考虑,选择酶解时间为25 min作为原生质体制备与再生的最佳条件。
|
| 图 6 酶解时间对原生质体形成率与再生率的影响 |
在最佳条件下,菌体培养至对数生长前期10 h,12 mmol/L EDTA预处理,溶菌酶浓度45 μg/mL,酶解温度28℃,酶解时间25 min的条件下进行实验。结果表明,原生质体形成率达97.3%,再生率达33.9%。菌株Sphingomonas sp. ATCC 31555及其原生质体经酚藏花红染色后,在荧光显微镜下的细胞形态。由图 7可以看出菌株Sphingomonas sp. ATCC 31555的细胞为杆状,两端略窄,大小为(0.5-0.7)μm×(1.0-1.7)μm。其原生质体大多数菌体呈类球状,直径0.6-0.9 μm,实现了原生质的制备。
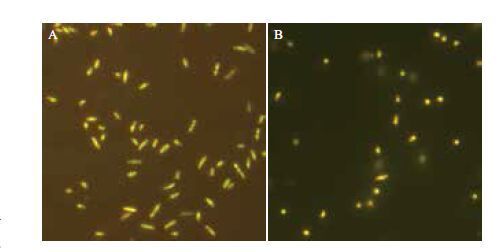
|
| 图 7 韦兰胶合成菌的细胞(A)及其原生质体(B)形态 (1 000×) |
本研究用酶法去除菌株细胞壁制备原生质体,在原生质体的形成与再生过程中,要获得较高的原生质体形成率与再生率,应综合考虑各个影响因素[14]。微生物的生理状态对原生质体的形成非常重要,对数生长期的细胞生长比较旺盛,活力较强,酶解易于释放原生质体[15],但随着培养时间的延长,胞外多糖产物会阻挡酶对实验菌株的作用,因此选择对数生长期初期作为原生质体制备的最佳菌龄。原生质体制备时,溶菌酶作用于细胞壁肽聚糖主链的β-1,4-糖苷键上,从而破坏细菌的细胞壁结构[16],但革兰氏阴性菌的原生质体制备更为复杂,阴性菌细胞壁的肽聚糖结构外还有脂多糖层,会阻挡溶菌酶的作用,EDTA可以螯合Ca2+和Mg2+,使脂多糖解体,进而暴露内层的肽聚糖分子被溶菌酶所水解[17],结果显示EDTA有利于对实验菌株的酶解。青霉素可以与转肽酶的活性中心结合,抑制肽桥的形成,从而抑制细菌细胞壁中肽聚糖的交联,使细胞壁结构疏松,有利于溶菌酶的作用[18],但本实验的结果显示青霉素影响菌株生长,降低了原生质体形成率,因此不选择使用青霉素进行预处理。不同的微生物菌种细胞壁组分有差异,因而对酶的敏感性不同,不同厂家溶菌酶的活性差异以及实验菌株的生长温度范围,都会影响酶促反应的条件,如酶浓度、酶解温度及时间等,进而影响原生质体的形成率与再生率,因此,有必要对酶促反应条件进行研究。原生质体制备时,随着溶菌酶浓度的增加,酶与菌体的作用更加充分,所以原生质体形成率上升,但过高的酶浓度,使溶菌酶中混有的杂酶(核糖核酸酶、过氧化物酶等)作用呈现,造成原生质体的活力降低[19]。酶解时间过短,原生质体释放不充分;酶解时间过长,会使形成的原生质体皱缩,且损害细胞质膜或造成原生质体破裂,导致再生率下降[20]。
4 结论本研究通过对影响韦兰胶合成菌Sphingomonas sp. ATCC 31555原生质体制备与再生的最佳条件:菌龄10 h,12 mmol/L EDTA预处理,溶菌酶浓度45 µg/mL、酶解温度28℃、酶解时间25 min,在此条件下菌株原生质体的形成率和再生率分别达到97.3%和33.9%。
| [1] | 张伟, 沈年汉, 陈秀芳. 几种微生物多糖的特性及在食品工业中的应用[J]. 食品工业科技, 2010, 31(6) : 358–360. |
| [2] | 黄海东, 刘云, 刘如林. 合成生物聚合物的重要微生物资源-鞘氨醇单胞菌[J]. 微生物学报, 2009, 49(5) : 560–566. |
| [3] | Jansson PE, Widmalm G. Welan gum(S-130)contains repeating units with randomly distributed L-mannosyl and L-rhamnosyl terminal groups,as determined by FABMS[J]. Carbohydrate Research, 1994, 256(2) : 327–330. |
| [4] | 郭建军, 李建科, 陈芳, 等. 韦兰胶的特性、生产和应用研究进展[J]. 中国食品添加剂, 2008(2) : 87–91. |
| [5] | 吉武科, 赵双枝, 等. 新型微生物胞外多糖-韦兰胶的研究进展[J]. 中国食品添加剂, 2011(1) : 210–215. |
| [6] | 姬彬. 威兰胶发酵及其流变性研究[D]. 无锡:江南大学,2012. |
| [7] | 吴萌萌, 罗影, 等. 鞘氨醇单胞菌 TP-5 发酵生产韦兰胶的条件优化研究[J]. 南开大学学报:自然科学版, 2014(1) : 72–79. |
| [8] | 赵燕, 陈芳, 李建科, 等. 微生物多糖韦兰胶生产工艺优化[J]. 食品科学, 2010(23) : 219–223. |
| [9] | 龙建友, 唐世荣, 吴文君. 原生质体融合技术对秦岭霉素产量提高的影响[J]. 中国农业科学, 2007, 40(7) : 1416–1421. |
| [10] | 岑沛霖. 工业微生物学[M]. 北京: 化学工业出版社, 2001 : 335-344. |
| [11] | 姚曼, 张予心, 宋秋梅, 等. 产琥珀酸放线杆菌原生质体制备与再生研究[J]. 食品科技, 2014, 39(6) : 30–34. |
| [12] | 祁咏春, 徐军庆, 高艳华, 等. 黄色短杆菌原生质体制备与再生条件的研究[J]. 食品与药品, 2013, 15(1) : 18–22. |
| [13] | 余健秀, 李建华, 庞义. 芽孢杆菌原生质体融合技术[J]. 生物技术, 2000, 10(3) : 45–47. |
| [14] | 甘邱锋, 张晓琳, 王洁颖, 等. 刺糖多孢菌原生质体制备与再生条件优化[J]. 中国抗生素杂志, 2011, 36(1) : 18–24. |
| [15] | 郑重谊, 谭周进, 肖克宇, 等. 不同因素对两株细菌原生质体制备的影响[J]. 生物技术通报, 2007(5) : 131–135. |
| [16] | 李淼, 曾柏全, 等. 高产纤维素酶菌株原生质体制备及再生条件[J]. 中南林业科技大学学报, 2013, 33(12) : 174–180. |
| [17] | 沈萍, 陈向东. 微生物学[M]. 北京: 高等教育出版社, 2006 : 40-43. |
| [18] | 朱宏莉, 宋纪蓉, 张嘉, 等. 果胶酶产生菌ZH-g的原生质体形成与再生研究[J]. 食品科学, 2006, 27(8) : 68–71. |
| [19] | 黄磊. 原生质体制备和再生的影响因素[J]. 科技致富向导, 2013(32) : 172–172. |
| [20] | 呼吉雅, 卢萍, 等. 小花棘豆Embellisia内生真菌原生质体的制备与再生研究[J]. 生物技术通报, 2015, 31(5) : 134–139. |




