浓香型白酒的生产是以窖池作为容器,以黄水为介导,酒醅、大曲、窖泥中的复杂微生物区系统进行着更迭和复杂的物质能量代谢[1]。窖池中的微生物群落和物理因子相互作用、彼此影响共同构成了窖池特殊的微生物群落结构[2]。在发酵过程中,随着窖泥窖龄的增长,窖内理化指标呈现一定规律的变化,同时窖泥微生物经过长期的驯化,其中优势菌群呈现稳定的状态,形成独有的微生物群落,进而使窖池中微生物群落结构发生相应的改变,并且在此过程中形成的丰富的代谢产物构成了浓香型白酒酒体,使其具有独特的风味特征[3]。
目前除了传统方法如分离、纯化、镜检、理化特性研究外,诸多基因工程、生物化学技术、分子生物学等方法被引入微生物群落研究中来。近年来PCR-DGGE[4, 5]技术的运用愈加成熟[6-10],如侠小虎等[11]对利用PCR-DGGE技术研究窖泥微生物的电泳条件进行优化和探讨,陶勇等[12]采用PCR-DGGE技术研究了窖泥细菌群落结构演替及其与环境因子的相关性。在白酒窖内微生物研究中,该技术准确、直观、检测速度快,较好地反映样品的微生物群落结构,但总体来说,利用PCR-DGGE系统研究窖泥微生物群落结构与其理化指标的相关性研究相对较少。本研究以不同窖龄的窖泥为样本,借助连续流动化学分析仪和PCR-DGGE基因指纹分析技术,利用SPSS软件将不同窖龄窖泥的微生物多样性与其理化指标进行相关性分析,得到其规律,并利用这些规律对菌落中优势菌进行选择,择优选取条带进行测序研究,以了解不同窖龄窖泥微生物群落的变化趋势和特殊菌群的存在状态,以期给白酒生产提供理论指导和技术支持,利于中国浓香型白酒的长远发展。
1 材料与方法 1.1 材料 1.1.1 实验材料窖泥样品分别采自泸州、宜宾和邛崃地区,包括5年、30年、50年、100年和200年。于窖壁下层(距窖底50 cm)和窖底(窖池底部)分别取样混合,迅速置于冰盒运回,-20℃保藏。
1.1.2 主要试剂酒石酸钠、阿拉伯胶、氯仿、碘化汞、碘化钾、氢氧化钠、硼酸、盐酸、邻苯二甲酸氢钾、硫酸钾、硫酸铜、甲基红、溴甲基酚绿、氯化铵、氯化钾、氢氧化钠、乙二胺四乙酸二钠,以上均为分析纯;Taq DNA 聚合酶、dNTPs、DL2000TM DNA Marker(大连宝生物工程有限公司);琼脂糖、丙烯酰胺、N,N′-亚甲基双丙烯酰胺、去离子甲酰胺(Solarbio);引物由上海英潍捷基生物技术公司合成。
1.1.3 主要仪器连续流动化学分析仪(Micro-CFA,美国Astoria Pacific International);PCR仪(美国 Bio-Rad公司My cycle);DGGE电泳仪(美国 Bio-Rad公司Dcode);高速冷冻离心机(德国 Hettich 公司 UNIVERSAL 32R);凝胶成像系统(美国 SIM公司 Bio-Best200E);半自动凯氏定氮仪(丹麦福斯集团公司 FOSS2200);电热鼓风干燥箱(北京北方利辉试验仪器设备有限公司 DHG-9070A);紫外可见分光光度计(上海尤尼柯仪器有限公司 UV-2400);通用型恒压恒流电泳仪(北京君意东方电泳设备有限公司);gel caster及PowerPac Basic Power Supply(美国 Bio-Rad公司);可调式混匀仪(美国赛洛捷克MX-S)。
1.2 方法 1.2.1 理化指标的测定方法有效磷采用连续流动分析仪测定;总氮采用凯氏定氮法检测;腐殖酸在波长420 nm下采用直接提取比色法测定;用pH计测定pH值;以酚酞为指示剂,采用滴定的方法测定总酸。
1.2.2 微生物群落结构检测方法 1.2.2.1 样品总DNA提取和检测采用SDS-酚抽提法[13]和DNA纯化试剂盒相结合的方法提取、纯化窖泥中微生物总宏基因组,再利用核酸仪检测纯化后的窖泥DNA溶液的浓度和纯度。
1.2.2.2 PCR扩增细菌扩增选用通用引物968GCF-1401R,扩增出470 bp左右的片段,采用50 μL体系,其PCR反应程序为:Touch Down PCR:94℃ 4 min;94℃ 10 s,64℃ 20 s,72℃ 40 s,每两个循环温度降1℃ 20个循环;54℃ 15个循环;72℃ 10 min。
古菌扩增先使用上游引物ARCH46F与下游引物ARCH1017R进行扩增,再以其PCR产物为模板,使用上游引物PARCH344F与下游引物UNIV522R进行嵌套式PCR扩增,两轮均采用50 μL体系。第一轮程序为:94℃ 5 min;94℃ 1 min,62℃-53℃ 1 min,72℃ 1.5 min,20个循环;94℃ 1 min,52℃ 1.5 min,72℃ 1 min,5个循环;72℃ 10 min。第二轮程序为:94℃ 5 min;94℃ 1 min,62℃-53℃ 1 min,72℃ 1.5 min,20个循环;94℃ 1 min,55℃ 1 min,72℃ 1 min,5个循环;72℃ 10 min。
1.2.2.3 PCR产物的检测取5 μL PCR扩增产物加入1 μL 6×loading buffer混匀,取3 μL DL2000TM DNA Marker做对照。1%琼脂糖凝胶140 V电泳25 min,EB染色,凝胶成像系统中观察并拍照保存。
1.2.2.4 DGGE技术对上述PCR扩增产物进行变性梯度凝胶电泳分析。聚丙烯酰胺凝胶浓度为8%,变性范围为50%-70%。在120 V、60℃条件下电泳12.5 h,用银染液染色30 min,拍照保存DGGE图谱。
1.2.2.5 测序选取目标条带,利用丙烯酰胺凝胶回收剂盒回收目的条带DNA,对回收的DNA进行PCR扩增,引物选用无GC夹子引物,扩增条件同1.2.2.2。选用TaKaRa MiniBEST DNA Fragment Purification Kit对扩增DNA进行纯化,随后将DNA片段连接到T载体上,利用大肠杆菌 E. coli DH5α 感受态转化。各样品挑选克隆得到的白色菌落3个送至上海英潍捷基测序,引物为344f-522r。测序结果在GenBank上进行比对,确定对应条带种属信息。
1.2.3 数据分析通过Quantity One分析软件对DGGE图谱进行分析,对数据进一步分析得到Shannon-Wiener多样性指数,可反映出群落种类和均匀度。通过SPSS分析窖泥中理化因子(pH、总氮、腐殖酸、有效磷和总酸)和微生物多样性之间的相关性,分析物理因子对微生物群落的影响。
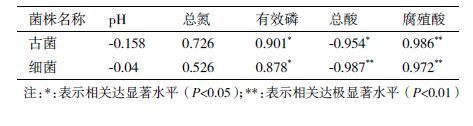
2 结果 2.1 理化指标检测结果本实验研究了不同窖龄的窖泥中pH、总氮、腐殖酸、总酸和有效磷的变化规律,结果发现:随着窖龄的增加,总氮呈先上升后下降的趋势(图 1),这是由于在封闭的环境中窖泥中的无机类氮在不断的利用过程中并不能得到对等的补充;窖泥中腐殖质含量是作为窖泥老熟程度的重要指标之一,而腐植酸是腐殖质中最为重要的组成成分,随着窖龄的增加,腐殖酸含量有着缓慢增加的趋势(图 1),窖泥年份不同,腐植酸结构与含量也会出现不同的分布;有效磷的含量随窖龄增加,并无明显规律,除50年窖龄较低,百年窖龄的含量明显高于其他3个窖龄,其中含量最高的为100年窖龄的老窖(图 2);pH在5-7之间呈中性偏酸,随着窖龄的增加,pH基本没有变化,保持较为稳定的状态(图 3),弱酸性的pH值是窖泥微生物正常代谢繁殖的必要条件,有利于己酸和乙酸乙酯的生成;而总酸与pH值呈反相关关系,总酸随窖龄的增加,呈缓慢下降的趋势(图 4),窖泥中若乳酸含量过高会导致己酸乙酯含量下降,加快窖泥老化速度。
|
| 图 1 总酸、总氮和腐殖酸含量的变化曲线 |

|
| 图 2 有效磷含量的变化曲线 |

|
| 图 3 pH 的变化曲线 |

|
| 图 4 总酸的变化曲线 |
核酸蛋白仪测定 DNA浓度的结果表示所提取 DNA 的A260/A280值均在为 1.8-2.0 之间。用相应的引物对窖泥中细菌16S rDNA和古菌16S rDNA进行扩增,获得470 bp和180 bp左右的片段(图 5),符合引物设计的片段。
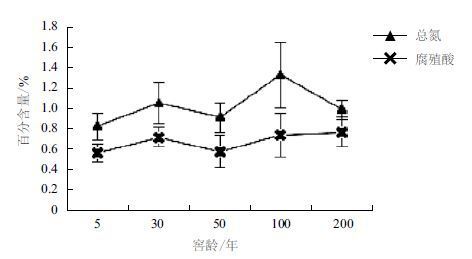
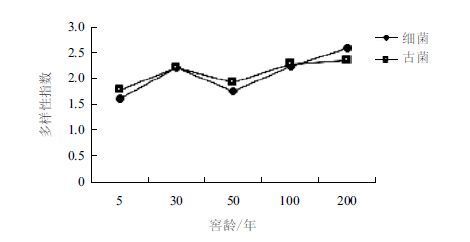
对PCR产物进行DGGE电泳分析,结果(图 6)表明,细菌的丰度值在9-22之间,随着窖龄的增加其丰度值也有所增加;第5、8、10号条带在所有样品中均有检出,且优势度较高,均在2%以上,表明这些条带所代表的细菌类群在窖池微生物中占有绝对优势;进一步分析可知细菌多样性指数在1.62-2.58之间,并随着窖龄的增加而逐渐增大,窖池内细菌类微生物体系逐渐达到稳定。古菌的丰度值在13-17之间,随窖龄的增加呈逐渐增大的趋势;其多样性指数在1.79-2.33之间,随窖龄的增加而缓慢增大,变化趋势较小,表明窖池内古菌类微生物体系已趋于稳定(图 7)。同时,这一系列数据也表明随着窖池窖泥在不断延续的发酵过程中慢慢驯化,其微生物群落结构也逐渐丰富而达到动态的平衡。

|
| 图 5 窖泥细菌(A)和古菌16S rDNA(B)PCR 扩增 结果 |

|
| 图 6 窖泥细菌(A)和古菌(B)DGGE 电泳条带位置比 较图 |
|
| 图 7 窖泥细菌和古菌多样性指数的变化规律 |
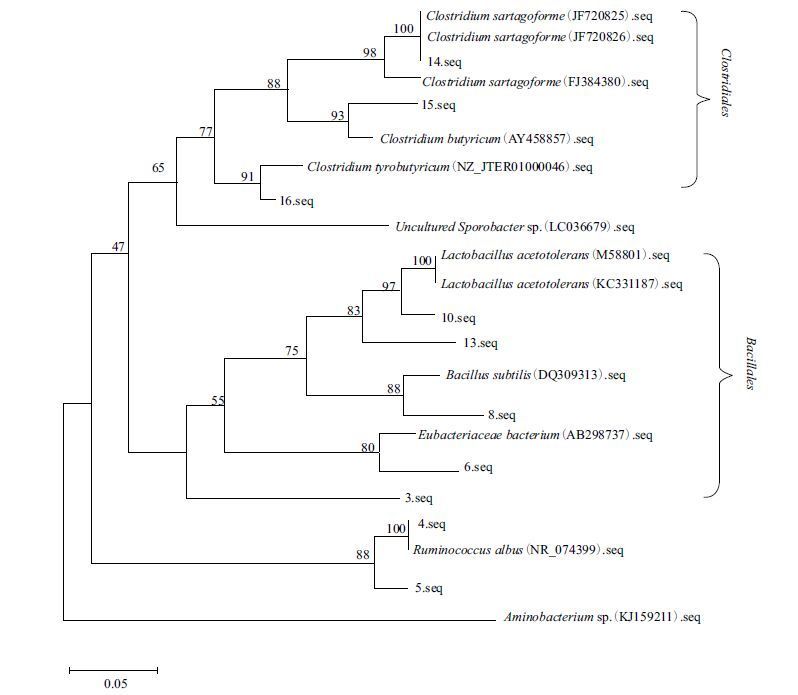
从细菌DGGE电泳图谱选取了11个优势条带进行切胶回收,测序结果在NCBI上进行比对,其相似率大于97%,比对结果显示11个条带所代表的细菌大多数分为两类,一类为Clostridiales,另一类为Bacillales,它们同属为厚壁菌门(Firmicutes),其中包括了常见的芽孢杆菌、梭菌等。7号条带为Uncultured bacterium,建立系统发育树(图 9),结果表明,13号与10号条带序列和Lactobacillus acetotolerans strain相似菌株聚为一个种族,同源性为83%。8号条带序列和Bacillus subtilis聚为一类,同源性为88%。14号条带序列和Clostridium sartagoforme聚为一类,同源性为100%。10号条带序列和Lactobacillus acetotolerans聚为一个种族,同源性为97%。
从古菌DGGE电泳图谱选取了4个优势条带进行切胶回收,其测序结果比对后,相似率基本上大于97%,比对结果显示4个条带所代表的古菌都是产甲烷菌,建立系统发育树(图 8),可发现13号条带序列和Methanosarcina siciliae strain相似菌株聚为一个族群,同源性为95%。15号条带序列与Methanoculleus bourgensis strain相似菌株聚为一个种族,同源性为98%,这类产甲烷菌在浓香型白酒窖池窖泥中所占比例为4.2%。14号条带序列和11号条带序列与Methanospirillum hungatei聚为一类,同源性分别为97%和99%。

|
| 图 8 以16S rDNA 序列为基础的古菌系统发育树图 |
|
| 图 9 以16S rDNA 序列为基础的细菌系统发育树图 |
通过SPSS软件对窖泥理化指标和微生物多样性进行了方差分析,找出这些因素之间的相互关系,结果(表 1)显示,细菌多样性与总酸呈极显著的负相关,而与腐殖酸呈极显著的正相关。这是由于腐植酸是窖池窖泥中微生物极易利用的一类营养物质,而且腐植酸对于窖池窖泥的老熟有着重要影响,因此腐植酸是窖池内环境因素中影响窖池内微生物发展最为重要的一个。同时,细菌多样性与有效磷也有显著的相关性,这说明了营养物质对微生物的影响在任何环境中都是显著的。对于古菌,仅与腐殖酸呈极显著的正相关,与有效磷、总酸呈显著的相关性,其他的指标相关性不显著。
窖池作为浓香型白酒发酵的容器,对优质白酒生产有着重要的作用。本实验研究了浓香型白酒窖池不同窖龄窖泥中主要微生物群落结构的多样性和窖泥理化指标(pH、总氮、腐殖酸、有效磷和总酸)的变化规律,掌握了它们之间相互作用的关系。其中细菌和古菌的多样性指数的变化规律与腐殖酸一致,随着窖龄的增加而增大,与总酸的变化规律相反,这是由于腐殖化程度的高低对窖泥老熟程度有一定的影响[14],腐殖酸中含有的维生素B1、B2、B6等营养物质,有益于微生物的生长、繁衍。老化的窖泥中活菌数明显下降[15, 16],如己酸菌的数量在400万个/g以下,放线菌在35万个/g以下,其与旺盛窖泥中活菌数相差近10倍,功能菌数量不足,比例不协调。在总酸中乳酸占有较大的比重,其含量会随着总酸含量的增大而增大,而乳酸含量过高时会抑制己酸菌的生长,影响己酸乙酯的产量,加快窖泥的老化速度,从而影响微生物的生长。这说明随着窖池窖泥的不断延续的发酵过程中,窖泥的理化指标不断的变化,对微生物的生长有重大影响,同时微生物群落结构的演替,也影响窖池窖泥的发酵过程。
经对优势条带进行割胶测序,本研究所得到的6株菌株,通过鉴定发现它们聚为5个类群,分别为甲烷八叠球菌属(Methanosarcina)、甲烷囊菌属(Methanoculleus)、甲烷螺菌属(Methanospirillum)、芽孢杆菌属(Bacillus)和乳杆菌属(Lactobacillus)。其中,Methanosarcina siciliae strain菌株是发酵过程中最重要的产甲烷菌群,这类菌株可以通过乙酸营养途径等多种途径,利用乙酸、CO2、甲醇等产生甲烷[17, 18]。同时,耐酸乳杆菌能在低pH环境中生长和存活[19],可发酵果糖、葡萄糖、乳糖、麦芽糖等,不能利用阿拉伯糖、蜜二糖、木糖等[20],而弱酸性的pH值也是窖泥微生物正常代谢繁殖的必要条件,Clostridiales多为厌氧或兼性厌氧菌,在发酵过程中对产酸有较大作用[21-23]。在发酵过程中,窖泥中这些菌群的生长还离不开营养物质的作用,如适当加入一些营养物质,有利于Bacillus subtili菌株的生长繁殖。由此可见,窖泥的各项理化指标的变化规律对这些菌群的生长、繁衍都有着重要的影响。
4 结论经鉴定,窖泥中的优势菌群为甲烷八叠球菌属(Methanosarcina)、甲烷囊菌属(Methanoculleus)、甲烷螺菌属(Methanospirillum)、芽孢杆菌属(Bacillus)和乳杆菌属(Lactobacillus),其相互作用影响着窖池窖泥的发酵过程和浓香型白酒酒体的风味特征。
窖泥的理化指标和微生物群落结构随窖龄的变化呈一定规律,其中有效磷、总酸、腐殖酸都与微生物群落结构有极大相关性,对微生物群落的演替有重要影响。
| [1] | 黄治国, 刘燕梅, 卫春会, 等. 浓香型酒醅微生物群落与理化指标的相关性分析[J]. 现代食品科技, 2014, 30(11) : 38–42. |
| [2] | 岳元媛, 张文学, 刘霞, 等. 浓香型白酒窖泥中兼性厌氧细菌的分离鉴定[J]. 微生物学通报, 2007, 34(2) : 251–225. |
| [3] | 王涛, 杜江, 陈泽军, 等. 窖泥放线菌的分离方法研究[J]. 酿酒科技, 2009(3) : 26–28. |
| [4] | Ercolini D. PCR-DGGE fingerp rinting:novel strate2gies for detec-tion ofmicrobes in food[J]. Journal of Microbiological Methods, 2004, 56 : 297–314. |
| [5] | Bekaert K, Devriese L, Maes S, et al. Characterization of the dominant bacterial communities during storage of Norway lobster and Norway lobster tails(Nephrops norvegicus)based on 16S rDNA analysis by PCR-DGGE[J]. Food Microbiology, 2015, 46 : 132–138. |
| [6] | Ling J, Zhang YY, Gong JD, et al. Spatial variability of cyanobacte-rial community composition in Sanya Bay as determined by DGGE fingerprinting and multivariate analysis[J]. Chinese Science Bulletin, 2013, 58(9) : 1019–1027. |
| [7] | 王洋清, 杨红军, 李勇. DGGE技术在森林土壤微生物多样性研究中的应用[J]. 生物技术通报, 2011, 5 : 75–79. |
| [8] | Hesham Ael-L, Qi R, Yang M. Comparison of bacterial community structures in two systems of a sewage treatment plant using PCR-DGGE analysis[J]. Science Direct, 2011, 23(12) : 2049–2054. |
| [9] | 刘慧杰, 杨彩云, 田蕴, 等. 基于PCR-DGGE技术的红树林区微生物群落结构[J]. 微生物学报, 2010, 50(7) : 923–930. |
| [10] | Chen HJ, Lin YZ, Fanjiang JM, Fan C. Microbial community and treatment ability investigation in AOAO process for the optoelectronic wastewater treatment using PCR-DGGE biotechnology[J]. Biodegradation, 2013, 24(2) : 227–243. |
| [11] | 陕小虎, 敖宗华, 周健, 等. 浓香型白酒窖泥原核微生物DGGE电泳条件的优化[J]. 酿酒科技, 2011(1) : 37–40. |
| [12] | 陶勇, 徐占成, 李东迅, 等. 窖泥细菌群落结构演替及其与环境因子的相关性[J]. 酿酒科技, 2011(9) : 42–46. |
| [13] | Zoet endal EG, Akkermans ADL, De Vos WM. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J]. Applied and Environmental Microbiology, 1998, 64(10) : 3854–3859. |
| [14] | 余有贵, 李侦, 熊翔, 等. 窖泥微生态的主要特征研究[J]. 食品科学, 2009(1) : 258–261. |
| [15] | Hargreaves PR, Brookes PC, Ross GJS, Poulton PR. Evaluating soil mcrobial biomasscar bonasanin dicato roflong - termenviron mental change[J]. Soil Biology and Biochemistry, 2003, 35 : 401–407. |
| [16] | 刘兰兰, 史春余, 梁太波, 等. 腐植酸肥料对生姜土壤微生物量和酶活性的影响[J]. 生态学报, 2009, 29 : 6136–6140. |
| [17] | Staley BF, de los Reyes FL, Barlaz MA. Effect of spatial differences in microbial activity,pH,and substrate levels on methanogenesis initiation in refuse[J]. Applied and Environmental Microbiology, 2011, 77(7) : 2381–2391. |
| [18] | Hao LP, Lu F, He PJ, et al. Predominant contribution of syntrophic acetate oxidation to themophilic methane formation at high acetate concentrations[J]. Environmental Science and Technology, 2011, 45(2) : 508–513. |
| [19] | Marteau P, Minekus M, Havenaar R, et al. Survival of Lactic acid bacteria in a dynamic model of the stomach and small intestine:validation and the effects of bile[J]. Dairy Science, 1997, 80(6) : 1031–1037. |
| [20] | 栗永乐, 李秀丽, 李传娟, 等. 内蒙古东部地区农家酸菜中乳酸菌的分离与初步鉴定[J]. 食品工业, 2012, 33 : 132–134. |
| [21] | Ryan P, Forbes C, McHugh S, et al. Enrichment of acetogenic bacteria in high rate. anaerobic reactors under mesophilic and thermophilic conditions[J]. Science Direct, 2010(44) : 4261–4269. |
| [22] | Pinder RS, Patterson JA. Growth of acetogenic bacteria in response to varying pH,acetate or carbohydrate concentration. Agriculture[J]. Food and Analytical Bacteriology, 2013(3) : 6–16. |
| [23] | Parameswaran P, Torres CI, Lee HS, et al. Hydrogen consumption in microbial electrochemical systems(MXCs):The role of homo-acetogenic bacteria[J]. Bioresource Technology, 2012(102) : 263–271. |