2. 江西农业大学生物科学与工程学院江西省农业微生物资源开发与利用工程实验室,南昌 330045
2. Engineering Laboratory for the Development and Utilization of Agricultural Microbial Resources,College of Biological Sciences and Technology,Jiangxi Agriculture University,Nanchang 330045
植物病害一直是影响作物产量、质量和食品安全的重要因素。据统计,全球每年因植物病害而造成的农业产量下降比例就高达10%-16%[1]。植物病害的主要病原包括细菌、病毒、真菌、线虫等,其中70%-80%的植物病害是由病原真菌侵染所致[2]。植物病原真菌常借助侵染垫、附着胞和吸器等侵染结构来完成寄主的侵染,并在寄主组织中大量生长,从而诱发植物真菌病害的发生[3, 4]。例如,由稻瘟病菌(Magnaporthe grisea)和水稻纹枯病菌(Rhizoctonia solani)而引发的水稻稻瘟病和纹枯病,已成为全球性的水稻主要病害[5, 6];尖孢镰刀菌(Fusarium oxysporum)是一种世界性的土传病原真菌,可引起瓜类、豆科、茄类、棉等100多种植物枯萎病的发生[7-9];此外,由炭疽病菌(Colletotri-chum)引发的植物炭疽病,也是造成蔬菜、果实和花木植物重大损失的一类常见真菌病害[10]。
目前,植物病害的防治主要依赖于化学农药的施用,但是长期大量使用化学药物不仅会造成农药残留,危害人畜健康,污染环境,而且在杀害病原菌的同时也杀伤了其他根际促生菌,破坏了生态平衡[11]。农业微生物资源是维系可持续发展农业生态环境的基础资源。利用农业微生物或其代谢产物进行植物病害的防治,具有安全、环保、无残留等优点,而且不易使病原菌产生耐药性,同时还能提高作物品质、增强植物抗性、改善土壤环境等多重作用,这都是化学农药无法匹敌的[12]。因此,微生物生防显示出越来越广阔的应用前景。
本研究以水稻纹枯病菌为指示菌,开展植物病原真菌拮抗菌的分离筛选、鉴定及其拮抗活性评价等研究,以期为其在植物病害的生物防治应用提供参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株拮抗菌株C2:由本实验室从采集江西省南昌市的某黄瓜菜地中分离筛选获得。供试植物病原真菌:水稻纹枯病菌(R. solani)、稻瘟病菌(M. grisea),西瓜枯萎病菌(F. oxysporum f. sp. niveum)、葡萄炭疽病菌(C. gloeosporioides)和橘青霉(P. citrinum),均由本实验室保藏。
1.1.2 培养基马铃薯葡萄糖培养基(PDA)、酵母浸出物麦芽膏培养基(ISP M2)、燕麦培养基(ISP M3)、无机盐淀粉培养基(ISP M4)、甘油天门冬酰胺培养基(ISP M5)、高氏一号培养基、察氏培养基、葡萄糖酪氨酸培养基(ISP M7)、普戈式二号培养基、柴斯钠培养基、纤维素分解培养基、明胶液化培养基、淀粉水解培养基、牛奶液化培养基和硝酸盐还原培养基[13, 14]。
1.1.3 主要试剂和仪器细菌基因组DNA提取试剂盒,Taq DNA聚合酶;DNA marker,PCR通用引物。2720 Thermal cycler PCR仪,3730-XL测序仪,Tanon 2500凝胶成像系统,双光速紫外分光光度计,光学显微镜,扫描电镜,超净工作台,恒温培养箱等。
1.2 方法 1.2.1 拮抗放线菌菌株的分离筛选放线菌菌株的分离纯化:为了获得丰富的放线菌资源,从云南、广东、安徽、湖北、江西等地共采集了18个不同类型的土样。分别称取10 g土样加入到装有90 mL无菌水的三角瓶中制成10-1的土壤悬浮液,以无菌水梯度稀释至10-3、10-4、10-5;吸取0.2 mL各梯度稀释液,分别涂布在加有50 mg/L放线菌酮和50 mg/L重铬酸钾的高氏一号培养基平板上,30℃培养7 d;挑取呈放线菌菌落特征的单菌落,转接高氏一号培养基进一步分离纯化和保存。
采用平板对峙培养法进行拮抗菌的筛选[15]:用无菌牙签挑取先期分离纯化的放线菌菌落放置在PDA平板中央,30℃下培养5 d后取出;在距拮抗放线菌四周2 cm处接种直径为8 mm的水稻纹枯病菌菌块,以不接种放线菌菌落的平板为对照;待对照组的水稻纹枯病菌菌丝长满平板时,测定实验组的抑菌带宽度(R2)和放线菌菌落直径(R1),并根据R2/R1的比值大小,筛选出抑菌活性强的放线菌菌株。
1.2.2 拮抗菌株的鉴定菌丝形态学观察:采用平皿插片法,将拮抗菌株接种于高氏一号固体培养基上,28℃培养7-14 d,取插片在光学显微镜下观察基内菌丝和气生菌丝的形态,用扫描电镜观察孢子丝和孢子的形态。
培养特征和生理生化特征:参照《链霉菌鉴定手册》[14]和《放线菌的分类和鉴定》[16]中的方法,进行拮抗菌的碳源利用、明胶液化、淀粉水解、牛奶凝固与胨化、硝酸盐还原、产H2S等实验。
分子生物学鉴定:使用AxyPrep细菌基因组DNA小量制备试剂盒提取拮抗菌株的基因组DNA,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)PCR扩增拮抗菌株的16S rDNA。PCR反应条件为:95℃预变性5 min;95℃变性30 s,55℃退火45 s,72℃延伸1 min 30 s,45个循环;最后72℃延伸7 min。待PCR反应完成后,取3 μL PCR产物进行1%琼脂糖凝胶电泳检测,确认PCR扩增片段。将测序得到的16S rDNA序列在NCBI网站进行BLAST比对,用MEGA 4.1软件以Neighbor-Joining法构建系统发育树,确定拮抗菌株的亲缘关系和分类地位。
1.2.3 拮抗菌株的抑菌谱测定采用菌丝生长速率法测定拮抗菌株对不同植物病原真菌的抑制效果[5]:挖取2 cm×1 cm大小的拮抗菌株菌块接种至装量为40 mL/250 mL三角瓶的液体发酵培养基(蔗糖 30 g/L,玉米淀粉 20 g/L,玉米浆 20 g/L,黄豆饼粉 10 g/L,(NH4)2SO4 1 g/L,KH2 PO4 0.25 g/L,MnCl2 0.05 g/L,MgSO4 1 g/L,NaCl 0.5 g/L,pH7.2-7.4)中,180 r/min、28℃下摇床培养96 h,发酵液无菌过滤;将无菌发酵上清液与冷却至50℃左右的PDA培养基按1∶25的体积比充分混合,制备含药平板;用打孔器(Φ=8 mm)将供试植物病原真菌菌块接种至平板中心,28℃恒温培养3-7 d,每处理做3次重复;以不加无菌发酵液的PDA平板为对照,用十字交叉法测定供试植物病原真菌的菌落直径,按如下公式计算菌丝生长抑制率:

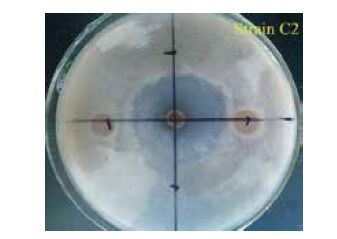
以水稻纹枯病菌为指示菌,采用平板对峙法从采自云南、广东、安徽、湖北、江西等地的18个土样中分离筛选到12株对水稻纹枯病菌具有较强拮抗作用的菌株。其中,菌株C2对水稻纹枯病菌的抑制能力最强,其抑菌带宽度和R2/R1值分别达到(29.18±0.48)mm和4.57(图 1)。
|
| 图 1 对峙培养下菌株C2 对水稻纹枯病菌的抑菌效果 |
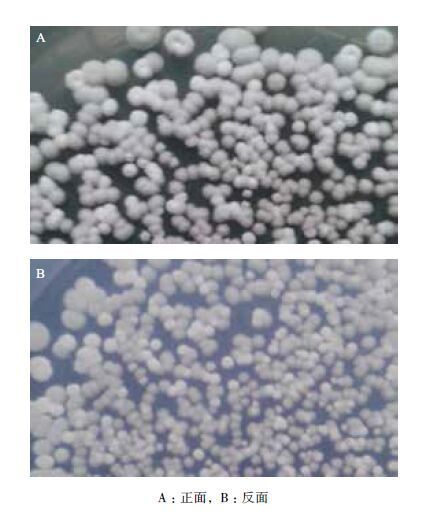
菌株C2在高氏一号培养基上的菌落特征(图 2)显示,菌株C2的单菌落较为饱满,呈白色,表面具有丰富的孢子,具有明显的放线菌菌落特征。为了进一步鉴定该菌株的种属情况,对其开展了菌体形态学观察、生理生化特征以及16S rDNA序列分析。
|
| 图 2 菌株C2 在高氏一号培养基的菌落形态 |
菌株C2在PDA培养基上培养7 d后,在光学显微镜和扫描电镜下观察到的菌丝体形态如图 3所示。
菌株C2在PDA培养基上生长发育良好,基内菌丝和气生菌丝发达丰富,气生菌丝发育成熟后分化成孢子(图 3-A箭头所指);在扫描电镜下,菌株C2的孢子丝呈螺旋弯曲的链状,单孢子呈圆柱状,表面光滑(图 3-B箭头所指)。根据光学显微镜和扫描电镜下的菌丝形态特征,可以初步鉴定菌株C2为链霉菌属。

|
| 图 3 菌株C2 菌丝形态特征 |
菌株C2在9种培养基上的培养特征(表 1)显示,菌株C2在大多数培养基上生长良好,在PDA和ISP M2培养基上产黄色可溶性色素,在马铃薯培养基上产黑色可溶性色素;菌株C2的菌落多为白色,在高氏一号和ISP M2培养基上可产丰富的孢子;气生菌丝呈白色或灰色,基内菌丝主要为浅黄色和污白色。
菌株C2的碳源利用情况和生理生化特征(表 2)显示,菌株C2可以利用D-甘露醇、蔗糖、山梨醇、肌醇、D-葡萄糖、麦芽糖、淀粉,不能利用D-木糖、D-果糖、棉籽糖和阿拉伯糖;菌株C2不能水解淀粉和分解纤维素,能使明胶液化以及牛奶凝固与胨化,不能产硫化氢和还原硝酸盐。
菌株C2的基因组DNA经PCR扩增后得到一条约为1.5 kb的特征带,经测序其16S rDNA的序列长度为1 393 bp。将该序列与NCBI数据库中相应的16S rDNA序列进行Blast比对,采用Neighbor-Joining方法构建菌株C2的系统发育树,结果(图 4)显示菌株C2与Streptomyces triostinicus的系列同源性达到99%。
根据菌丝形态观察、生理生化特征并结合16S rDNA序列分析,菌株C2初步鉴定为Streptomyces triostinicus,将其命名为Streptomyces triostinicus C2。

|
| 图 4 基于16S rDNA 序列构建的C2 菌株系统发育树 |
采用生长速率法测定了链霉菌C2发酵液对5种供试植物病原真菌的抑菌效果,结果(表 3)显示,链霉菌C2对供试的5种植物病原真菌(水稻纹枯病菌、水稻稻瘟病菌、葡萄炭疽病菌、西瓜枯萎病菌和橘青霉)均有不同程度的抑制作用,其抑菌率分别为49.78%、56.62%、180.96%、8.59%和94.10%。 由此可见,链霉菌C2对植物病原真菌具有广谱拮抗的特点,这为其应用于不同植物病害的生物防治提供了参考。
用于生物防治的微生物种类繁多,主要有细菌、真菌、放线菌等[17]。例如,作为植物根际促生菌中最大的细菌种群,假单胞杆菌(Pseudomonas spp.),尤其是荧光假单胞菌(P. fluorscens),能有效地定殖在植物根际,控制植物病害、促进植物生长,是植物病害生防研究中的一个重要类群[18]。放线菌具有复杂的次级代谢系统,能产生诸多结构新颖、生物活性显著的次级代谢产物,在植物病害防治中具有举足轻重的作用。据统计,目前大约有60%的农用抗生素是由链霉菌(Streptomyces spp.)产生的[19]。其中,由灰色产色链霉菌(S. griseochromogenes)产生的灭瘟素(Blasticidin S)、春日链霉菌(S. kasugaensis)产生的春日霉素(Kasugamycin)、可可链霉菌阿索变种(S. cacaoi var. asoensis)产生的多氧霉素(Polyoxins)、吸水链霉菌柠檬色变种(S. hygroscopicus var. limoneus)产生的井冈霉素(Validamycin A)等,更是成功地商业化运用于水稻、蔬菜和果类等的真菌病害防治之中[20]。
本研究筛选到一株广谱拮抗链霉菌C2,初步鉴定为Streptomyces triostinicus。同样,曹琦琦等[21]在开展植物病原真菌拮抗菌的分离筛选过程中,也获得一株对水稻纹枯病菌具有高效拮抗作用的Streptomyces triostinicus。然而目前的研究表明,Streptomyces triostinicus系喹喔啉类(Quinoxaline)抗肿瘤抗生素的主要产生菌[22],如三骨菌素A(Triostin A)和棘霉素(Echinomycin)[23, 24]。也有研究发现,Streptomyces triostinicus可以产具有抗肿瘤活性的放线菌素V(Actinomycin V)[25]。
值得注意的是,本研究是以生防为目的分离筛选到一株植物病菌真菌拮抗菌Streptomyces triostinicus,但该菌株是否也会产三骨菌素A、棘霉素和放线菌素V等抗肿瘤抗生素,有待进一步对其活性组分进行结构鉴定。另外,尽管菌株C2所具备的广谱性拮抗植物病原真菌特点为其在不同类型植物病害上的生防应用奠定了基础,但是其抑菌机理以及在田间的防病效果,也有待进一步研究。
4 结论本研究以水稻纹枯病菌为指示菌,从多地土壤中筛选到一株对水稻纹枯病菌、水稻稻瘟病菌、葡萄炭疽病菌、西瓜枯萎病菌和橘青霉等多种植物病原真菌均具有抑制效果的链霉菌,该菌株经鉴定并命名为Streptomyces triostinicus C2。
| [1] | Chakraborty S, Newton AC. Climate change,palnt diseases and food security:an over review[J]. Plant Pathology, 2011, 60 : 2–14. |
| [2] | 康振生. 我国植物真菌病害的研究现状及发展策略[J]. 植物保护, 2010, 36(3) : 9–12. |
| [3] | Berendsen RL, Pieterse CM, Bakker PAHM. The rhizosphere microbiome and plant health[J]. Trends Plant Sci, 2012, 17 : 478–486. |
| [4] | Doornbos RF, van Loon LC, Bakker PAHM. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. A review[J]. Agron Sustain Dev, 2012, 32 : 227–243. |
| [5] | Xiong ZQ, Tu XR, Wei SJ, et al. In vitro antifungal activity of antifungalmycin 702,a new polyene macrolide antibiotic,against the rice blast fungus Magnaporthe grisea[J]. Biotechnol Lett, 2013, 35 : 1475–1479. |
| [6] | Harikrishnan H, Shanmugaiah V, Balasubramanian N, et al. Antagonistic potential of native strain Streptomyces aurantiogriseus VSMGT1014 against sheath blight of rice disease[J]. World J Microbiol Biotechnol, 2014, 30 : 3149–3161. |
| [7] | Summerell BA, Laurence MH, Liew EC, et al. Biogeography and phylogeography of Fusarium:a review[J]. Fungal Divers, 2010, 44 : 3–13. |
| [8] | Zhao S, Liu DY, Ling N, et al. Bio-organic fertilizer application significantly reduces the Fusarium oxysporum population and alters the composition of fungi communities of watermelon Fusarium wilt rhizosphere soil[J]. Biol Fert Soils, 2014, 50 : 765–774. |
| [9] | Li CH, Zhao MW, Tang CM, et al. Population dynamics and identification of endophytic bacteria antagonistic toward plant-pathogenic fungi in cotton root[J]. Microbial Ecol, 2010, 59 : 344–356. |
| [10] | Araújo L, Gon?alves AE, Stadnik MJ. Ulvan effect on conidial germination and appressoria formation of Colletotrichum gloeosporioides[J]. Phytoparasitica, 2014, 42 : 631–640. |
| [11] | 彭卫福, 李昆太, 曾勇军. 水稻病害的微生物防治研究进展[J]. 江西农业大学学报, 2015, 37(4) : 625–631. |
| [12] | Compant S, Brader G, Muzammil S, et al. Use of beneficial bacteria and their secondary metabolites to control grapevine pathogen diseases[J]. BioControl, 2013, 58(4) : 435–455. |
| [13] | Shirling EB, Gottlieb D. Methods for characterization of Streptom-yces species[J]. Int Journal of Syst Bacteriol, 1966, 16(3) : 313–340. |
| [14] | 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975. |
| [15] | 余佳清, 张志斌, 李希茜, 等. 一株具有抗真菌活性的放线菌菌株FXj9的分离和鉴定[J]. 植物保护, 2013, 39(5) : 158–164. |
| [16] | 阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992. |
| [17] | Weller DM, Raaijmakers JM, Gardener BBM, et al. Microbial populations responsible for specific soil suppressiveness to plant pathogens 1[J]. Annu Rev Phytopathol, 2002, 40 : 309–348. |
| [18] | Sivasakthi S, Usharani G, Saranraj P. Biocontrol potentiality of plant growth promoting bacteria(PGPR)-Pseudomonas fluorescens and Bacillus subtilis:A review[J]. African Journal of Agricultural Research, 2014, 9(16) : 1265–1277. |
| [19] | Couillerot O, Loqman S, Toribio A, et al. Purification of antibiotics from the biocontrol agent Streptomyces anulatus S37 by centrifugal partition chromatography[J]. J Chromatogr B, 2014, 944 : 30–34. |
| [20] | Kim BS, Hwang BK. Microbial fungicides in the control of plant diseases[J]. J Phytopathology, 2007, 155 : 641–653. |
| [21] | 曹琦琦, 周登博, 郑丽, 等. 水稻纹枯病菌拮抗菌的筛选、鉴定及培养条件探索[J]. 中国生物防治学报, 2013, 29(2) : 270–276. |
| [22] | Glund K, Schlumbohm W, Bapat M, et al. Biosynthesis of quinoxaline antibiotics:purification and characterization of the quinoxaline-2-carboxylic acid activating enzyme from Streptomyces triostinicus[J]. Biochemistry, 1990, 29(14) : 3522–3527. |
| [23] | Praseuth AP, Wang CCC, Watanabe K, et al. Complete sequence of biosynthetic gene cluster responsible for producing triostin A and evaluation of quinomycin-type antibiotics from Streptomyces triostinicus[J]. Biotechnol Prog, 2008, 24(6) : 1226–1231. |
| [24] | Sato M, Nakazawa T, Tsunematsu Y, et al. Echinomycin biosynthesis[J]. Curr Opin Chem Biol, 2013, 17(4) : 537–545. |
| [25] | Singh V, Khan M, Khan S, et al. Optimization of actinomycin V production by Streptomyces triostinicus using artificial neural network and genetic algorithm[J]. Appl Microbiol Biot, 2009, 82(2) : 379–385. |