2. 中南林业科技大学 森林有害生物防控湖南省重点实验室,长沙 410004
2. Hunan Key Laboratory of Forest Protection,Central South University of Forestry and Technology,Changsha 410004
油茶(Camellia oleifera Abel)主要是指山茶科(Theaceae)山茶属(Camellia L.)植物中油脂含量较高且具有栽培经济价值的一类植物的总称[1],是原产于我国的食用木本油料树种。袁嗣令等[2]发现油茶炭疽病可以引起油茶落花、落果,给茶农带来极其严重的损失。近几十年来,国内植物病害学者对油茶炭疽病做了大量的研究,普遍认为胶孢炭疽菌(Colletotrichum gloeosporioides Penz.)是引起油茶炭疽病的病原菌[3-12]。但是,随着多基因序列鉴定病原菌方法的引入,可将形态学上很难区分的新种鉴定并从复合种中分离出来,大大提高了对炭疽属真菌鉴定的准确率。例如,张海英等[13-16]通过形态学观察及单基因序列分析,将中国草莓炭疽病的主要病原物鉴定为胶孢炭疽菌,而韩永超等[17]通过ACT、TUB2和CAL三个基因系统发育分析,将武汉地区草莓根颈腐烂病的病原鉴定为胶孢炭疽菌复合种内的C. siamense[18];杨友联等[19]采用多基因谱系方法将胶孢炭疽菌复合种划分成22个种和1个亚种;杨友联结合形态学及多基因系统学,将采自中国贵州、云南、广西等省的190株炭疽菌属菌株确定为22个分类单元。李河等[20-22]利用形态学观察及多基因分析方法,发现油茶炭疽病的病原除了胶孢炭疽菌外,还有果生刺盘孢菌(Colletotrichum fructicola)、暹罗刺盘孢菌(Colletotrichum siamense)及博宁炭疽菌(Colletotrichum boninense)。因此,有必要对油茶炭疽病致病菌进行进一步的研究,另外,油茶炭疽病菌对不同品种油茶致病性的研究在国内也鲜见报道。我们从湖南、江西及海南油茶产区采集病叶,对病原菌进行分离纯化,通过形态学观察并结合多基因序列分析方法,发现炭疽属的山茶刺盘孢(C. camelliae)也可以使油茶致病,并进行该菌对湘林1号、湘林69号、湘林89号、赣无1、赣无16、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号、长林190号等12个品种油茶致病性的测定,旨在为防治该病菌引起的病害提供理论依据。
1 材料与方法 1.1 材料 1.1.1 样品来源于2014年10月从湖南浏阳市、江西长埠镇及官山林场采集典型油茶炭疽病病叶,2015年4月从海南澄迈林场采集典型油茶炭疽病病叶。
1.1.2 培养基[23]PDA培养基:去皮马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水1 000 mL。SNA培养基:磷酸二氢钾1.0 g,硝酸钾1.0 g,七水硫酸镁0.5 g,氯化钾0.5 g,葡萄糖0.2 g,蔗糖0.2 g,琼脂14 g,蒸馏水1 000 mL。
1.1.3 试剂DNA快速提取试剂盒Fast DNA Kit,美国MPBIO公司;2×Taq PCRMaster Mix,天根生化科技(北京)有限公司。
1.1.4 仪器ABI 9700 PCR仪,美国应用生物系统公司;快速核酸提取仪,美国MPBIO公司;5145D离心机,德国Eppendoff公司;Nikon 80I显微镜,NIKON仪器(上海)有限公司。
1.2 方法 1.2.1 病原菌分离及纯化采用常规组织分离方法[23]进行病原菌分离和纯化。分离得到的菌株于4℃冰箱保存备用。
1.2.2 病原菌生物学鉴定将菌株接种在PDA及SNA平板上,28℃恒温培养10 d,每天观察记录菌落形态,并测量菌落直径。光学显微镜下观察分生孢子和附着孢形态,并测量分生孢子大小。
1.2.3 病原菌DNA的提取、扩增及核苷酸序列测定将纯化好的菌株接种至PDA平板,28℃培养7 d,用无菌牙签刮取适量菌丝放入1.5 mL离心管中,采用夏花等[24]的实验方法进行病原菌DNA的提取。基因选择及目的片段扩增与测序参照Weir等[18]的方法、反应体系及条件,实验所用引物及相关内容见表 1。PCR产物委托上海铂尚生物技术有限公司测序。
使用ClustalW软件对测序获得的3个基因分别进行比对和手工校正,然后按照ITS-CAL-GAPDH的顺序分别首尾相连,并下载GenBank中同时含有上述3个基因序列的炭疽属菌株的序列,按照ITS-CAL-GAPDH的顺序首尾相连后进行同源性分析,用软件MEGA6.0构建N-J系统发育树。
1.2.5 致病性测定选用湖南省种植广泛的油茶品种“湘林1号”进行病原菌的致病性测定。用无菌牙签蘸取分离到的5个菌株(编号见表 2)的分生孢子悬浮液(105个/mL)后刺扎油茶叶,CK组用无菌水处理,置于室外套袋保湿培养,每个菌株接种30个叶片,CK组处理30个叶片。每天观察叶片发病情况。对发病叶片再进行病原菌分离及与接种病原菌进行形态特征比较。
为了明确分离到的病原菌对不同品种油茶的致病性,对湘林1号、湘林69号、湘林89号、赣无1、赣无16、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号、长林190号等12个品种(两年生)叶片进行活体接种。接种方法同1.2.5。
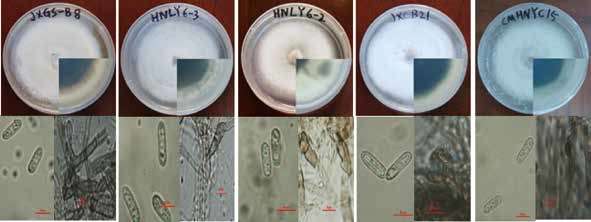
2 结果 2.1 病原菌分离及形态学鉴定从湖南、江西及海南三省油茶产区分离到5株形态特征疑似炭疽病原菌的菌株(编号分别为HNLY6-2、HNLY6-3、JXGS-B8、JXCB21、CMHN-YC15),5个菌株在PDA培养基上形态特征相似(图 1),培养7 d时,菌落直径约为6.5 cm,生长速率约为9.3 mm/d;菌落近似圆形,气生菌丝稀疏,紧贴培养基,初期为白色,培养7 d后菌落中央由白色渐变为灰白色,菌落边缘仍为白色;培养10 d时,黑色素大量沉积,致使整个培养皿背面变为黑色。在SNA培养基上,分生孢子无色、光滑,单孢,长椭圆形或圆柱形,两端圆或一端略粗,另一端稍尖,大小为(13±3.5)μm×(3±2)μm;附着孢从菌丝上产生,末端膨大,呈不规则形状,颜色较深(图 1)。
|
| 图 1 炭疽菌菌株(CMHNYC15)的形态特征 A-E:分别为菌株JXGS-B8、HNLY6-3、HNLY6-2、JXCB21及CMHNYC15在PDA上的菌落形态及其在SNA上的分生孢子、附着孢形态 |
经致病性测定发现,在接种3-4 d后,病原菌可使油茶叶片表现发病症状,病斑初期呈褐色不规则斑块,并逐渐扩展,渐变为深褐色或黑色,后期病斑呈灰色,病斑直径5-18 mm(图 2-A)。经进一步病原菌分离,获得与接种菌株一致的分离物,表明分离到的菌株为油茶炭疽病的病原菌。

|
| 图 2 山茶刺盘孢(CMHNYC15)接种不同品种油茶叶片上的症状 A:湘林1号;B:湘林69号;C:湘林89号;D:赣无1;E:赣无16;F:广西红花;G:长林3号;H:长林4号;I:长林23号;J:长林53号;K:长林148号;L:长林190号。A-D,H-L:5 d;E-G:10 d |
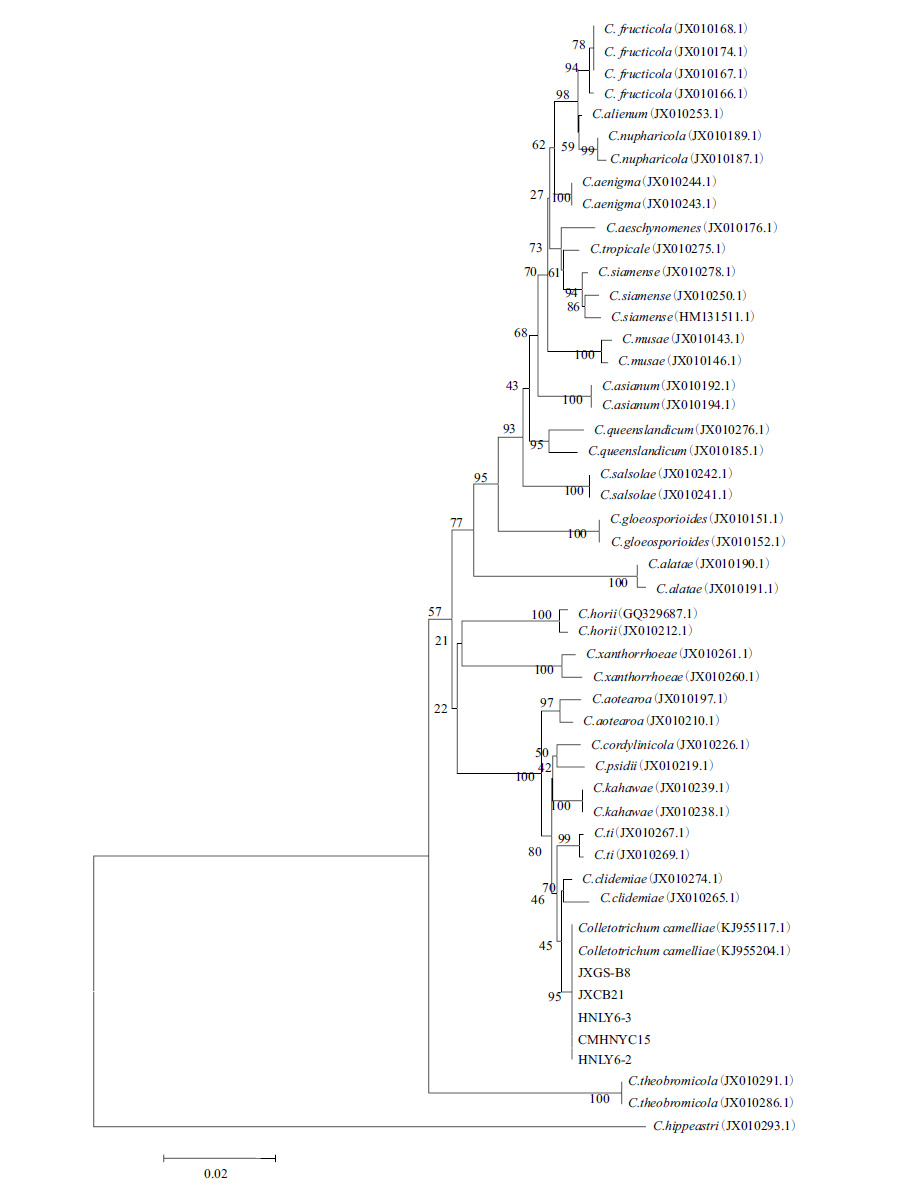
5个菌株的编号及每个基因的GenBank登录号见表 2,5个菌株的ITS-CAL-GAPDH序列与GenBank下载的菌株序列的聚类分析结果(图 3)显示,5个分离菌株与2株C. camelliae聚为一支,自展支持率为95%,能够与炭疽属其他种区分开;其它分支中,炭疽菌属同种菌株也都以非常高的支持率聚为一个进化枝。结合菌株形态特征及多基因系统发育分析,可将分离到的5株病原菌鉴定为山茶刺盘孢C. camelliae。
|
| 图 3 依据ITS-CAL-GAPDH 3基因合并序列用N-J法构建炭疽病病原菌系统发育树 |
不同品种油茶叶片接种实验(表 3)表明,C. camelliae均可侵染湘林1号、湘林69号、湘林89号、赣无1、赣无16、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号、长林190号等品种。其中,湘林1号、湘林69号、湘林89号、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号及长林190号等品种上的症状类似(图 2);广西红花、赣无1、赣无16品种叶片上形成的病斑不易扩展,且10 d后病斑明显比其他品种小。连续观察发现病菌在不同品种叶片上出现症状的时间(3-10 d)不同(表 3)。
炭疽属真菌危害全球多种植物,如谷物、蔬菜、水果等,给农民造成了严重的经济损失。炭疽属真菌早期主要依据形态特征进行鉴定,可用于鉴定的指标有分生孢子、附着孢的形状及大小,以及刚毛、分生孢子梗和产孢细胞大小,菌核、后垣孢子的有无及形态等。Von Arx[25]根据分生孢子的大小来界定种,将750多个种合并为11个种,使得一些种成为复合种或种群(Species group);Damm等[26]将分生孢子梗实际应用于分类中,结合其它形态特征,很好地界定了草生弯孢类该属真菌,引进了6个新的分类单元。20世纪90年代之后,随着分子生物技术的发展,ITS序列在该属真菌分子系统学研究中得到广泛应用,为很多物种的鉴定和系统进化分析提供了有利的工具。例如,C. boninense最初基于形态特征被鉴定为C. gloeosporioides,而Moriwaki等[27]利用ITS序列进行系统分析,将其独立为新的分类单元。然而Avise等[28]指出仅仅依靠ITS序列不能有效地进行种的识别,否则会导致错误的结论。此外,Crouch[29]也指出在GenBank所登录的序列中,约有86%的炭疽属真菌的ITS序列被错误定义。Cai等[30]提出采用多基因序列分析来对炭疽菌进行分子鉴定,这在一定程度上提高了对炭疽属真菌的鉴定准确率。例如,Crouch[31]运用ITS、Apn2、Mat1/Apn1和Sod2四个基因进行联合分析,对形态上极难识别的集合种C. gramincola区分开来,恢复C. cereale和C. eleusinsines为合格种,并引入了6个新种;Damm等[26]利用ITS、ACT、TUB2、CHSI、HIS3和GAPDH六个基因序列进行分析,将草本植物上的黑线炭疽菌区分开来,并引入了4个新种。
目前已报道能侵染油茶的炭疽病原有胶孢炭疽菌C. gloeosporioides、果生刺盘孢菌C. fructicola、暹罗刺盘孢菌C. siamense及博宁炭疽菌C. boninense。本研究从湖南、江西及海南3个省市油茶发病叶上分离到5株菌落形态特征一致的菌株,但与上述菌相比,在菌落颜色上,C. gloeosporioides、C. fructicola和C. siamense呈浅灰色至深灰色,C. boninense呈奶白色至橘红色,而分离到的5株菌株菌落初期呈雪白色,7 d时菌落背面出现黑色素沉积,10 d后菌落渐变为灰白色,整个菌落背面呈黑色;报道的油茶炭疽菌的分生孢子堆颜色都为橘黄色,分生孢子形态椭圆形或圆柱状、单胞、无色,菌丝附着孢椭圆形或不规则形,褐色,然而本研究分离的5株菌株在PDA上较难培养出分生孢子及附着孢,在SNA上,分生孢子长椭圆形或圆柱形,两端圆或一端略粗,另一端稍尖,附着孢形状不规则,颜色较深。通过形态学观察及多基因序列分析,将本研究分离到的5株菌株鉴定为山茶刺盘孢C. camelliae。
本研究分离鉴定了一个新的油茶炭疽病病原——C. camelliae,通过研究C. camelliae对不同品种油茶致病性测定,发现C. camelliae对湘林1号、湘林69号、湘林89号、赣无1、赣无16、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号、长林190号等品种的叶片致病,但出现病斑的时间不同,这可能与油茶品种的抗病性有关。目前国内有关不同油茶品种对炭疽病抗性的研究报道较多,杨光道[32]通过林间调查及室内实验,发现攸县油茶、徽州大红、徽州小红、舒城大红4个品种为抗炭疽病品种,并对不同油茶品种抗炭疽病机制进行了初步研究;匡蓉琳等[33]对14个油茶品种进行炭疽病菌(Colletotrichum gloeosporioides)接种实验,发现广宁红花油茶、腾冲红花油茶最为抗病,同时发现不同油茶品种的抗病性与油茶的净光合速率、气孔导度等生理指标相关;杨华等[34]对广东省栽培的不同油茶种和品种进行林间调查及室内测定,发现广宁红花油茶属于抗病种类。下一步将从形态结构、生理生化、分子生物学及抗性基因角度研究C. camelliae与不同品种油茶的互作机制,通过研究油茶品种与炭疽菌之间的关系,获得抗炭疽病优良品种,可为推进油茶产业的健康、快速发展提供重要的指导。
4 结论本研究分离纯化得到5株可引起油茶炭疽病的致病菌,利用形态学观察及多基因序列分析,将其鉴定为山茶刺盘孢(Colletotrichum camelliae)。同时进行病原对不同油茶品种致病性测定,发现可使湘林1号、湘林69号、湘林89号、赣无1、赣无16、广西红花、长林3号、长林4号、长林23号、长林53号、长林148号、长林190号等12个品种的叶片致病,且在不同品种油茶叶片上出现症状的时间不同。
| [1] | 阙龙善, 张国武, 杜天真, 等. 中国油茶技术研究与产业发展战略探讨[J]. 江西科学, 2007, 25(4): 505–510. |
| [2] | 袁嗣令, 张能唐, 翁月霞, 等. 油茶炭疽病的研究[J]. 植物保护学报, 1963, 2(3): 253–262. |
| [3] | 中国林业科学研究院主编. 中国森林病害[M]. 北京: 中国林业出版社, 1984.141-145. |
| [4] | 周仲铭. 林木病理学[M]. 北京: 中国林业出版社, 1990.117-119. |
| [5] | 袁嗣令, 邵力平, 李传道. 中国乔、灌木病害[M]. 北京: 科学出版社, 1997.42. |
| [6] | 杨光道, 束庆龙, 段琳, 等. 主要油茶品种对炭疽病的抗性研究[J]. 安徽农业大学学报, 2004, 31(4): 480–483. |
| [7] | 段琳, 杨光道, 束庆龙, 等. 油茶果皮颜色对炭疽病的抗性的影响[J]. 经济林研究, 2005, 2: 9–12. |
| [8] | 王军, 陈绍红, 黄永芳, 等. 水杨酸诱导油茶抗炭疽病的研究[J]. 林业科学研究, 2006, 5: 629–632. |
| [9] | 沈万芳. 油茶炭疽病发生与林分和气候因素的关系及叶片结构抗病机理的研究[D]. 合肥:安徽农业大学, 2008. |
| [10] | 杨光道. 油茶品种对炭疽病的抗性机制研究[D]. 合肥:安徽农业大学, 2009. |
| [11] | 刘伟. 油茶炭疽病的病原学、发生规律及防治技术研究[D]. 武汉:华中农业大学, 2012. |
| [12] | 崔之益, 李蕊萍, 胡加新, 等. 油茶炭疽病研究进展[J]. 现代农业科技, 2014, 12: 141–142. |
| [13] | 张海英, 张明会, 刘志恒, 等. 草莓炭疽病病原鉴定及其生物学特性研究[J]. 沈阳农业大学学报, 2007, 38(3): 317–321. |
| [14] | 任小杰, 梁艳, 陆金萍, 等. 上海地区草莓炭疽病病原鉴定[J]. 植物病理学报, 2008, 38(3): 325–328. |
| [15] | 吴金平, 曾祥国, 宋志红, 等. 草莓炭疽病病原菌的快速鉴定[J]. 湖北农业科学, 2010, 49(10): 2437–2439. |
| [16] | 靳宝川, 李兴红, 尚晶晶, 等. 北京地区设施栽培草莓根颈病病原菌的初步鉴定[J]. 植物病理学报, 2011, 41(增刊): 119–121. |
| [17] | 韩永超, 向发云, 曾祥国, 等. 草莓根颈腐烂病的病原鉴定[J]. 中国农业科学, 2014, 1: 53–60. |
| [18] | Weir BS, Johnston PR, Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73: 115–180. |
| [19] | 杨友联. 中国云南、贵州、广西炭疽菌属真菌多基因分子系统学研究[D]. 武汉:华中农业大学, 2010. |
| [20] | 李河, 周国英, 徐建平, 等. 一种油茶新炭疽病原的多基因系统发育分析鉴定[J]. 植物保护学报, 2014, 41(5): 602–607. |
| [21] | 李河, 周国英, 徐建平. 一种新油茶炭疽病原多基因序列鉴定[J]. 植物保护, 2015, 41(2): 92–96. |
| [22] | 汤铱泠, 周国英, 李河, 等. 多基因序列鉴定油茶炭疽病原Colletotrichum boninense新种[J]. 热带作物学报, 2015, 5: 972–977. |
| [23] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1997.249-253. |
| [24] | 夏花, 朱宏建, 周倩, 等. 湖南芷江辣椒上一种新炭疽病的病原鉴定[J]. 植物病理学报, 2012, 42(2): 120–125. |
| [25] | Arx JA von. Die Arten der Gattung Colletotrichum Cda[J]. Phytopathologische Zeitschrift, 1957, 29: 414–468. |
| [26] | Damm U, Woudenberg JHC, Cannon PF, et al. Colletotrichum species with curved conidia from herbaceous hosts[J]. Fungal Diversity, 2009, 39: 45–87. |
| [27] | Moriwaki J, Sato T, Tsukiboshi T. Morphological and molecular characterization of Colletotrichum boninense sp. nov. from Japan[J]. Mycoscience, 2003, 44: 47–53. |
| [28] | Avise JC, Wollenberg K. Phylogenetics and the origin of species[J]. Proceeding of the National Academy of Sciences USA, 1997, 94: 7748–7755. |
| [29] | Crouch JA, Clarke BB, Hillman BI. What is the value of ITS sequence data in Colletotrichum systematics and species diagnosis?A case study using the falcate-spored graminicolous Colletotrichum group[J]. Mycologia, 2009, 101: 648–656. |
| [30] | Cai L, Hyde KD, Taylor PWJ, et al. A polyphasic approach for studying Colletotrichum[J]. Fungal Diversity, 2009, 39: 183–204. |
| [31] | Crouch JA, Clarke BB, White JF Jr., et al. Systematic analysis of the falcate-spored graminicolous Colletotrichum and a description of six new species from warm season grasses[J]. Mycologia, 2009, 101(5): 717–732. |
| [32] | 杨光道. 不同油茶品种抗炭疽病机制及RAPD分析的研究[D]. 合肥:安徽农业大学, 2002. |
| [33] | 匡蓉琳, 冯皓, 孙思, 等. 油茶品种对炭疽病的抗性及与生理活动的关系[J]. 中国森林病虫, 2015, 3: 1–4. |
| [34] | 杨华, 赵丹阳, 秦长生, 等. 不同油茶种和品种对炭疽病的抗性观察[J]. 植物保护, 2015, 2: 195–199. |