2. 中国农业科学院生物技术研究所,北京 100081;
3. 中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室,北京 100193
2. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081;
3. State Key Laboratory for Biology of Plant Diseases and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193
玉米从种植到成熟过程中会发生各种虫害,如亚洲玉米螟、黏虫等地上害虫和地老虎、玉米根叶甲等地下害虫。在我国,亚洲玉米螟(Ostrinia furnacalis)是对玉米最具有破坏性的鳞翅目昆虫之一[1],对玉米整个生育期均会造成严重影响。玉米螟幼虫在玉米心叶期取食玉米叶肉或蛀食未展开心叶,抽雄后钻蛀茎秆,取食籽粒,使雌穗发育受阻而减产,遇大风则易由虫孔处折断,且在籽粒上的伤口成为玉米镰孢菌侵染的部位,引发或加重镰孢穗腐病的发生。棉铃虫(Helicoverpa armigera)又名玉米穗虫,以幼虫取食玉米叶片成孔洞或缺刻,并危害茎、雌穗,不仅使玉米减产,而且能诱发玉米穗腐病的发生[2-5]。黏虫(Mythimna separata)因其群聚性、迁飞性、杂食性、暴食性,成为全国性重要农业害虫[6],近几年黏虫大爆发带来的玉米减产不容忽视。害虫在咬食玉米嫩粒后,可造成籽粒缺损、霉粒、玉米品质降低。由于玉米霉变多次造成养殖场禽畜的群体发病,严重影响养殖业的生产,长期饲喂含有霉变的玉米,不仅危害动物,且残留在动物体内的有害物质会给人类健康带来隐患。
传统防治害虫的方法主要是施用化学农药,但大量施用化学农药,污染环境,误杀有益昆虫,破坏生态平衡,同时易造成人畜中毒。近年来,转基因植物的发展对于害虫的防治探索了一条新的途径[7]。国外转Bt基因抗虫玉米的研究起步较早[8],1996年转基因抗虫玉米已经开始商业化种植[9]。而国内抗虫转基因玉米的研究较国外晚,尚未获准商业化生产。Bt cry1Ah基因是从国内筛选的Bt菌株中鉴定克隆的新型Bt基因,具有自主知识产权[10]。Cry1Ah蛋白对鳞翅目害虫的毒力强于Cry1Ab和Cry1Ac蛋白[11]。已有研究表明,外源基因通过密码子优化可显著提高基因在植物中的表达水平[12]。将Bt cry1Ah基因利用不同的密码子优化形式和转化方法转化玉米,获得了抗虫的转基因玉米[13-15]。本研究通过农杆菌介导法将cry1Ah基因转入玉米自交系综31中,通过群体筛选,获得了对亚洲玉米螟有显著抗性的转基因植株HGK60。为了鉴定HGK60事件的抗虫效果,在田间和室内用HGK60转基因玉米分别饲喂亚洲玉米螟、棉铃虫和黏虫幼虫,观察幼虫取食情况,评价HGK60玉米的抗虫效果及应用潜力,以期为培育新型的抗虫玉米提供种质资源,用于玉米抗虫育种。
1 材料与方法 1.1 材料 1.1.1 植物材料玉米自交系综31(受体材料)及T3代转Bt cry1Ah基因抗虫玉米材料HGK60由本实验室保存。
1.1.2 供试虫源亚洲玉米螟由中国农业科学院植物保护研究所何康来研究员提供。棉铃虫由中国农业科学院植物保护研究所梁革梅研究员提供。玉米黏虫由中国农业科学院植物保护研究所黏虫组提供。
1.2 方法 1.2.1 PCR检测转基因植株取玉米幼苗的叶片用CTAB法提取基因组DNA,选用cry1Ah特异性引物对其进行PCR检测,筛选阳性植株。特异性引物序列为F:5'-GCATCTCCACCTACACCGACTA-3'和R:5'-CGGCTGGAATCTGGGTAATC-3',扩增产物长度为800 bp,反应条件为:95℃ 2 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,32个循环;72℃延伸10 min。
1.2.2 Cry1Ah蛋白表达含量取玉米不同生长时期(六叶期、抽穗期和灌浆初期)的展开叶片、心叶、茎、雄穗、花丝、雌穗轴、苞叶等组织,提取蛋白,利用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测转基因植株的Cry1Ah蛋白表达量,以纯化的Cry1Ah蛋白制作标准曲线。蛋白提取及ELISA检测方法均按试剂盒说明书进行,ELISA检测试剂盒购自美国Envirologix公司。
1.2.3 玉米螟室内外生测 1.2.3.1 玉米螟室内生测参考王冬妍等[16]方法,从田间采集玉米心叶,用毛笔将亚洲玉米螟初孵幼虫接入放有玉米心叶的24孔虫测板中,每24 h调查1次幼虫存活数。
1.2.3.2 玉米螟田间生测按照农业部953号公告-10-2007在大田进行随机区组设计。待玉米生长到7-8叶期时,以每株40-60 头玉米螟初孵幼虫的用量接于心叶中,3 d后重复接虫一次,以非转基因材料为阴性对照,处理方法同转基因材料。玉米吐丝期接虫方法同上,接虫部位是花丝,在接虫2 周后按照公告标准等级判定。
1.2.4 棉铃虫室内外生测 1.2.4.1 棉铃虫室内生测参考芮昌辉等[17]方法,分别测定玉米叶片、雄穗、苞叶、嫩粒、花丝和玉米芯等器官对棉铃虫1 日龄幼虫的杀虫活性。记录棉铃虫1日龄幼虫取食HGK60玉米不同器官3 d后的死亡率。
1.2.4.2 棉铃虫田间生测参考农业部953号公告-10-2007进行田间生测并进行等级判定。
1.2.5 黏虫室内外生测 1.2.5.1 黏虫室内生测参考文献[18, 19]实验方法,取HGK60小喇叭口期的玉米心叶进行室内生测。于12孔虫测板中放入玉米心叶,每孔接1头黏虫初孵幼虫,每个处理重复4次,以非转基因材料为阴性对照。视玉米组织的新鲜程度,及时更换相同来源的玉米叶片,培养12 d后用精度1/10 000电子分析天平称量幼虫重量。
1.2.5.2 黏虫田间生测参考农业部953号公告-10-2007进行田间生测并进行等级判定。
1.2.6 数据分析利用Excel软件进行数据整理,用SPSS数据处理软件对试验数据进行分析,对不同处理间平均数的差异显著性比较均采用t检验。
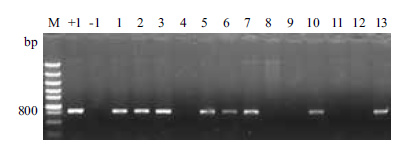
2 结果 2.1 PCR检测选择阳性植株对HGK60植株进行PCR检测,以cry1Ah特异性引物检测目的基因,以表达载体做阳性对照,以综31做阴性对照。结果(图 1)显示,含目的基因的转基因植株扩增出的片段大小为800 bp,与阳性对照片段大小一致,综31及阴性植株未扩增出目的片段,1、2、3、5、6、7、10和13有阳性条带,4、8、9、11和12无阳性条带。根据检测结果,留取阳性植株进行更进一步的检测分析。
|
| 图 1 cry1Ah基因玉米转化植株的PCR检测 M:DNA Marker;+1:阳性对照;-1:阴性对照;1-13:转化植株 |
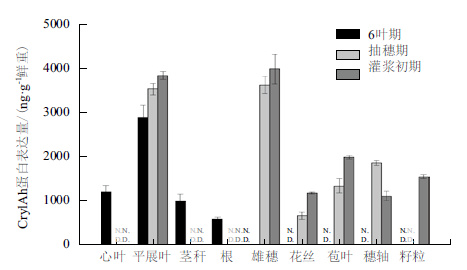
利用ELISA方法检测了HGK60不同时期不同部位的Cry1Ah蛋白含量。玉米六叶期属于玉米营养生长阶段,抽穗期和灌浆初期均属于生殖生长阶段。如图 2所示,HGK60玉米不同时期不同组织中的Cry1Ah蛋白含量存在差异。在营养生长阶段叶片中的Bt杀虫蛋白含量为2 881 ng/g(鲜重,下同),在抽穗期叶片中Cry1Ah蛋白的含量达到3 500 ng/g。在灌浆初期的雄穗中Cry1Ah蛋白含量最高,为3 977 ng/g。抽雄期的花丝中Cry1Ah蛋白含量较低,为657 ng/g,而在灌浆初期花丝中的Cry1Ah蛋白含量上升到1 168 ng/g;穗轴中所含杀虫蛋白含量的变化与花丝正好相反,Cry1Ah蛋白在抽雄期中高于在灌浆初期中的含量。
|
| 图 2 HGK60不同时期不同组织Cry1Ah蛋白表达 N.D.代表对应的时期未检测 |
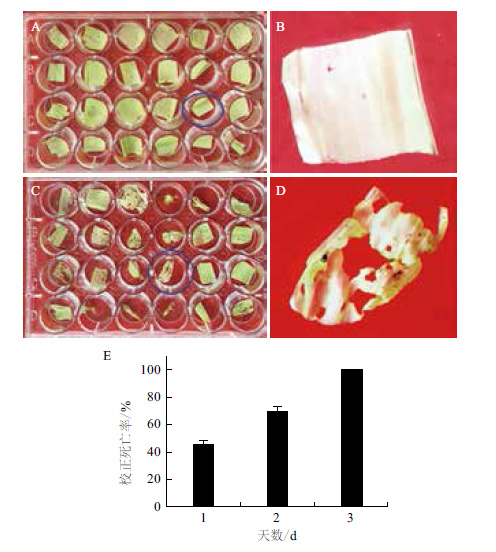
室内接虫3 d后,咬食HGK60转基因玉米校正死亡率如图 3所示。第1天时,咬食转基因玉米心叶的幼虫校正死亡率接近50%,第3天时玉米螟幼虫全部死亡。在3次统计中,取食转基因玉米心叶的玉米螟幼虫死亡率显著高于阴性对照(P<0.05),表明HGK60转基因玉米对玉米螟幼虫有显著抗性。由图 3可知,HGK60转基因玉米叶片在接虫3 d后基本没有受害,且玉米螟咬食的虫孔只有针头大小,而阴性对照则受害较严重,有较多虫孔。
|
| 图 3 取食HGK60转基因玉米的亚洲玉米螟室内生测 A:玉米螟咬食HGK60 3 d后;B:玉米螟咬食HGK60 3 d后叶片放大图;C:玉米螟咬食综31 3 d后;D:玉米螟咬食综31 3 d后受危害叶片放大图;E:取食HGK60转基因玉米的亚洲玉米螟初孵幼虫校正死亡率 |
由图 4可知,HGK60转基因玉米的叶片在接虫两周后基本无玉米螟危害,只有少量针孔大小的虫孔,而阴性对照叶片受害严重,有多个超过火柴头大小的虫孔,按照判定标准,HGK60田间抗性等级是1.29±0.72级,为高抗级别,相同处理的阴性对照平均抗性等级值为7.06±1.39级,为感虫级别。

|
| 图 4 HGK60对玉米螟田间生测结果 A:苗期,接虫两周后的HGK60;B:苗期,接虫两周后的综31;C:穗期,接虫两周后的HGK60;D:穗期,接虫两周后的综31 |
玉米吐丝期将玉米螟幼虫接于玉米花丝,HGK60转基因玉米的幼穗受害微小或者无危害(图 4),按照判定标准抗性级别为1.67±0.72,属高抗级别,而阴性对照幼穗受害较严重,抗性级别为6.34±0.88,属感虫级别,证明HGK60转基因玉米对玉米螟有很强的抗性,此结果与室内抗虫性鉴定结果一致。
2.4 棉铃虫室内和田间生物活性检测 2.4.1 棉铃虫室内生测以HGK60玉米和阴性对照玉米不同组织喂食棉铃虫,3 d后统计棉铃虫的死亡情况。HGK60玉米对棉铃虫幼虫有很强的毒杀作用,不同组织因为含有的Cry1Ah蛋白量不同,对棉铃虫的致死情况不同,比较棉铃虫1 日龄幼虫取食HGK60玉米不同器官3 d后的死亡率(图 5),初步认为在灌浆初期玉米各部位的杀虫活性顺序为叶片>苞叶>雄穗>籽粒>穗轴>花丝。咬食HGK60各部位的幼虫死亡率与阴性对照相比均有显著性差异(P<0.05),表明HGK60对棉铃虫有较好的抗虫性,可以在一定程度上保护植株免受棉铃虫的危害。

|
| 图 5 HGK60对棉铃虫的杀虫活性 A:HGK60不同器官对棉铃虫的杀虫活性;B:接虫两周后的综31幼穗;C:接虫两周后的HGK60幼穗 |
棉铃虫对于HGK60转基因玉米,雌穗的危害级别为0.97±1.44,而综31雌穗的危害级别为5.4±1.14,对比判定标准可知HGK60转基因玉米雌穗受棉铃虫的危害程度级别平均值在0-1之间,属于高抗型。而阴性对照雌穗受害严重,属于感虫型。图 5所示HGK60玉米雌穗不受棉铃虫危害,而阴性对照植株雌穗上籽粒已被棉铃虫咬食,并有真菌侵入。
2.5 黏虫室内和田间生物活性检测 2.5.1 黏虫室内生测用玉米心叶喂食黏虫初孵幼虫,培养7 d后HGK60和综31饲喂的黏虫幼虫均无死亡情况,而培养12 d后HGK60饲喂的黏虫平均体重为(0.003 5±0.001 4)g,而综31饲喂的黏虫平均体重为(0.044 8±0.009 6)g,P<0.05,二者之间有显著差异。如图 6所示,饲喂转基因材料和阴性对照12 d后的黏虫幼虫在长势上有明显的区别,表明HGK60转基因玉米对于黏虫的毒力没有对玉米螟的毒力强,但是HGK60转基因玉米对黏虫有明显的体重抑制。

|
| 图 6 HGK60玉米对黏虫的室内和田间生测结果 A:室内生测,HGK60转基因玉米叶片喂食黏虫3 d后;B:室内生测,综31非转基因玉米叶片喂食黏虫3 d后;C:室内生测,咬食HGK60转基因玉米叶片12 d后的黏虫幼虫;D:室内生测,咬食综31非转基因玉米叶片12 d后的黏虫幼虫;E:田间生测,接虫两周后的HGK60;F:田间生测,接虫两周后的综31 |
在接虫14 d后调查玉米叶片受黏虫的危害程度,根据其危害程度计算各小区黏虫对玉米叶片危害级别,HGK60的黏虫平均食叶级别为2.47±1.51,综31的黏虫平均食叶级别为6.19±1.56,对比评定标准可知HGK60对黏虫的食叶级别平均值在2.1-4.0之间,属于抗性级别。HGK60玉米叶片基本无黏虫咬食的虫孔或有少量弹孔大小的虫孔,而阴性对照的叶片有明显的大片缺刻,严重情况下玉米植株的生长发育受到影响。
3 讨论玉米螟在玉米幼苗期主要危害心叶,与目前我国批准进口的转基因玉米MON810和Bt11相比,HGK60六叶期心叶Bt蛋白表达量为1 192 ng/g,虽低于MON810和Bt11的1 880 ng/g和1 473 ng/g,但三者心叶对于亚洲玉米螟的杀虫效果基本相当,在第3天取食心叶的玉米螟幼虫全部死亡[16]。有研究证明,Cry1Ah蛋白对鳞翅目害虫的毒力强于Cry1Ab和Cry1Ac蛋白,尤其对亚洲玉米螟的杀虫活性约为Cry1Ab的4.6 倍,Cry1Ac的8.2倍[11],所以即使HGK60心叶的Cry1Ah蛋白含量低于MON810和Bt11的Cry1Ab的蛋白含量,HGK60对亚洲玉米螟的毒力不弱于MON810和Bt11,HGK60心叶中含有的Bt蛋白可以有效防治心叶期玉米螟。玉米螟在抽雄期取食幼嫩的雄穗,HGK60雄穗Bt蛋白含量为361 6 ng/g,高于MON810、Bt11中的563 ng/g、215 ng/g,HGK60苞叶中Bt蛋白表达量为1 330 ng/g。在田间生测时,HGK60雄穗没有出现折断及被咬食的情况,而大部分综31的雄穗在后期被咬食严重甚至折断。玉米螟还可在雌穗上取食花丝进入内部取食顶端的籽粒和幼嫩的穗轴,也可以通过取食苞叶钻入雌穗内部取食幼嫩籽粒;在灌浆后期钻蛀茎秆为害,茎秆的折损及虫害伤口引发的茎腐病、穗腐病,造成玉米严重减产[20]。在玉米吐丝期进行人工接虫,2周后综31被咬食严重,茎秆处多有蛀孔,伤口处多有霉菌,而HGK60转基因抗虫玉米没有受到危害。在抽雄期,HGK60雄穗和苞叶中含有的Bt蛋白可以有效防治穗期玉米螟。室内生测和田间试验结果均表明,无论叶片还是花丝,HGK60对亚洲玉米螟都具有非常好的抗性,能够短时间杀灭玉米螟幼虫,极大程度减少由于虫害引起的霉变。HGK60事件对于亚洲玉米螟有很好的抗性,与已商业化的转Bt基因抗虫玉米具有相同的杀虫效果。
棉铃虫食性杂、寄主种类多,近年危害十分猖獗,对玉米的危害也越来越大,转基因玉米的出现显著降低了针对棉铃虫的化学农药的使用量。一代棉铃虫主要在幼苗阶段取食心叶或展开的幼叶,二代幼虫主要危害刚吐丝的玉米雌穗花丝、雄穗,影响授粉,三代幼虫主要蛀食玉米雌穗籽粒,排出大量虫粪,被害部位被虫粪污染产生霉变。HGK60幼苗期和抽雄期时各组织中Bt蛋白量可以有效防治鳞翅目害虫。本试验中着重研究了雌穗部位对棉铃虫幼虫的影响。有研究表明,MON810雌穗不同组织对棉铃虫的杀虫效果不同,取食MON810苞叶的棉铃虫初孵幼虫5 d后全部死亡;取食MON810幼嫩籽粒和穗轴的棉铃虫初孵幼虫5 d的死亡率为90%,即使有少量存活的幼虫,其发育也受到了严重抑制[6]。本试验研究结果表明HGK60对于棉铃虫有明显的杀虫效果,3 d后取食HGK60各组织的棉铃虫初孵幼虫的死亡率均在95% 以上,能够在短期内快速灭杀棉铃虫幼虫,大田试验结果也显示HGK60玉米对棉铃虫有着很好的杀虫效果,接棉铃虫2周后的玉米与对照相比没有明显的受害情况,而阴性对照则咬食严重,且被害部位因虫粪污染,多出现霉变,对玉米品质造成极大损害[21],这充分说明了HGK60可以有效防治棉铃虫初孵幼虫。
黏虫主要在玉米幼苗期危害玉米叶片,高密度虫量的地区玉米叶片甚至被全部吃光仅剩光杆[22]。以七叶期的MON810和Bt11叶片喂食4日龄黏虫,第8天时,取食MON810和Bt11叶片的幼虫存活率分别为15%和22.5%[21],本试验以小喇叭口期HGK60玉米心叶喂食黏虫初孵幼虫,喂食12 d后的结果显示黏虫幼虫没有出现死亡,但是黏虫幼虫的体重与阴性对照相比则明显受到抑制,使得黏虫幼虫的发育受到影响。在黏虫后期生长过程中,取食阴性植株叶片的黏虫化蛹时间早于取食HGK60叶片的,化蛹率也是高于取食HGK60叶片的黏虫,此结果未在文中列出。有研究报道,室内取食MON810的1-3日龄黏虫幼虫在第14天时全部死亡,严重影响黏虫幼虫的生长发育[6]。HGK60对于黏虫幼虫的体重有抑制作用,对于取食HGK60的幼虫化蛹和羽化情况还需要进一步的研究。国内外室内和田间试验表明Bt玉米对黏虫的杀虫作用主要表现为影响幼虫存活和严重阻碍幼虫生长发育,这个结果也在本试验研究中得到证实。HGK60对于黏虫的防治效果不如对玉米螟的防治效果明显,与不同Bt蛋白针对的靶标生物不同,如Cry1Ac蛋白对棉铃虫毒性较高,相比较而言对于黏虫的毒性较低[23]。
国内外研究表明,Bt玉米对玉米螟具有高效的杀虫效果[24],对玉米其他鳞翅目害虫如玉米穗虫等也有较好的控制效果[25]。本试验也证明了Bt玉米对于玉米螟、黏虫、棉铃虫有较好的控制效果,HGK60转基因玉米可以高效灭杀玉米螟和棉铃虫,可以严重抑制黏虫的生长发育,这对于多种害虫的共同防治有一定的研究意义,害虫发生演替是一个不断变化的生态学过程,发展害虫综合治理对策与技术体系,以便及时开展科学防治,确保Bt作物安全生产和持续利用[26-28]。
4 结论利用玉米螟、棉铃虫和黏虫3种鳞翅目害虫对转Bt cry1Ah基因抗虫玉米HGK60事件T3代植株进行室内和田间抗虫性分析,室内及田间生物活性测定结果表明,HGK60转基因抗虫玉米对玉米螟、棉铃虫有高抗性,对黏虫有抗性。在玉米各发育期,HGK60可有效防治玉米螟、棉铃虫和黏虫等鳞翅目害虫的发生。
| [1] | 张洪刚, 鲁新, 何康来, 等. 亚洲玉米螟抗寒及低温生存对策[J]. 植物保护学报, 2010, 37(5): 398–402. |
| [2] | 常雪艳, 何康来, 王振营, 等. 转Bt基因玉米对棉铃虫的抗性评价[J]. 植物保护学报, 2006, 33(4): 347–378. |
| [3] | 宋立秋, 石洁, 王振营, 等. 亚洲玉米螟为害对玉米镰孢穗腐病发生程度的影响[J]. 植物保护, 2012, 38(6): 50–53. |
| [4] | 李人杰, 魏铁松, 郭聪聪, 等. 棉铃虫为害与拟轮生镰孢侵染对玉米穗腐病发生及玉米籽粒中伏马毒素污染水平的影响[J]. 植物保护, 2015, 41(4): 68–72. |
| [5] | 段灿星, 王晓鸣, 宋凤景, 等. 玉米抗穗腐病研究进展[J]. 中国农业科学, 2015, 11(48): 2152–2164. |
| [6] | 常雪, 常雪艳, 何康来, 等. 转cry1Ab基因玉米对黏虫的抗性评价[J]. 植物保护学报, 2007, 34(3): 225–228. |
| [7] | Clive J. ISAAA Report on global status of biotech/GM crops:2013[J]. China Biotechnology, 2014, 34(1): 1–8. |
| [8] | Gordon-kamm WJ, Spencer TM, Mangano ML, et al. Transformation of maize cells and regeneration of fertile transgenic plants[J]. Plant Cell, 1990, 2(7): 603–618. |
| [9] | Denolf P, Hendrickx K, Van Damme J, et al. Cloning and characterization of Manduca sexta and Plutella xylostella midgut aminopeptidase N enzymes related to Bacillus thuringiensiis toxin-binding proteins[J]. Eur J Biochem, 1997, 248(3): 748–761. |
| [10] | Xue J, Liang GM, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin from Bacillus thuringiensis with high toxicity to the Asian corn borer and other lepidopteran insects[J]. FEMS Microbiology Letters, 2008, 280(1): 95–101. |
| [11] | Xue J, Zhou ZS, Song FP, et al. Identification of the minimal active fragment of the Cry1Ahtoxin[J]. Biotechnology Letters, 2011, 33(3): 531–537. |
| [12] | Rasheda J, Muhammad SK, Yusuf Z, et al. Codon optimization of cry1Ab gene for hyper expression in plant organelles[J]. Molecular Biology Reports, 2010, 37(2): 1011–1017. |
| [13] | Li XY, Lang ZH, Zhang J, et al. Acquisition of insect-resistant transgenic maize harboring a truncated crylAh gene via Agrobacterium-mediated transformation[J]. Journal of Integrative Agriculture, 2014, 13(5): 937–944. |
| [14] | 戴军, 李秀影, 朱莉, 等. 转Bt cry1Ah基因抗虫玉米的分子检测及农艺性状分析[J]. 生物技术通报, 2014, (5): 62–68. |
| [15] | 岳同卿, 郎志宏, 王延峰, 等. 转Bt cry1Ah基因抗虫玉米的获得及其遗传稳定性分析[J]. 农业生物技术学报, 2010, 18(4): 638–644. |
| [16] | 王冬妍, 王振营, 何康来, 等. Bt玉米杀虫蛋白含量的时空表达及对亚洲玉米螟的杀虫效果[J]. 中国农业科学, 2004, 37(8): 1155–1159. |
| [17] | 芮昌辉, 范贤林, 孟香清, 等. 转Bt基因抗虫玉米对棉铃虫杀虫活性的初步评价[J]. 农药学学报, 2000, 2(3): 88–90. |
| [18] | 邰桂玲, 邓曙东, 张青文, 等. Bt玉米(MG95)对黏虫的抗性和拒食作用[J]. 昆虫知识, 2004, 41(5): 422–426. |
| [19] | 王振营, 王冬妍, 何康来, 等. 转Bt基因玉米对黏虫的室内杀虫效果评价[J]. 植物保护学报, 2005, 32(2): 153–157. |
| [20] | 郭井菲. 玉米茎秆机械强度与抗玉米螟钻蛀为害的关系[D]. 北京:中国农业科学院, 2014. |
| [21] | 杨芳兰. 玉米田棉铃虫药剂防治试验效果[J]. 甘肃农业科技, 2002, 7: 45–46. |
| [22] | 刘杰, 姜玉英, 曾娟. 2013年我国黏虫发生特点分析[J]. 植物保护, 2015, 3(41): 131–137. |
| [23] | 宋萍. Bt Cry1Ac毒蛋白对棉铃虫和黏虫作用机理研究[D]. 保定:河北农业大学, 2003. |
| [24] | Krogh PH, Griffiths B, Dem?ar D, et al. Responses by earthworms to reduced tillage in herbicide tolerant maize and Bt maize cropping systems[J]. Pedobiologia, 2007, 51(3): 219–227. |
| [25] | 王冬妍, 王振营, 何康来, 等. 转Bt基因抗虫玉米在害虫综合治理中的作用及生态风险[J]. 植物保护学报, 2003, 30(1): 97–106. |
| [26] | 陆宴辉, 梁革梅. Bt作物系统害虫发生演替研究进展[J]. 植物保护, 2016, 1(42): 7–11. |
| [27] | 陆宴辉. Bt棉花害虫综合治理研究前沿[J]. 应用昆虫学报, 2012, 4(49): 809–819. |
| [28] | 林珠凤, 陈海燕, 吉训聪. 害虫对转Bt基因作物的抗性及治理[J]. 热带生物学报, 2015, 4(6): 497–503. |




