糖尿病现已经成为威胁全球人类健康和生活质量的一个主要慢性疾病,随着人们生活水平的提高和生活节奏的加快,糖尿病发病人数也在快速增加,据国际糖尿病联盟(IDF)2013年11月统计,全世界糖尿病在20-79岁成人中的患病率为8.3%,患者人数已达3.82亿,预计2035年全球将有近5.92亿人患糖尿病;中国2013年糖尿病的患病人数为984万,到2035年中国的糖尿病患病人数将达到1.43亿,仍然居于全球首位,短短20年间,增速高达30%。此外,糖尿病的成因非常复杂,糖类代谢功能紊乱造成胰岛素的相对缺乏并导致糖尿病的发生。长期存在的高血糖,能够导致各种组织,特别是眼、肾、心脏、血管及神经等产生慢性损害及功能障碍。90%的糖尿病患者均属于Ⅱ型,以相关的代谢紊乱为特征,包括β细胞功能下降,外周胰岛素抵抗(insulin resistance,IR)等,最终导致β细胞功能丧失或去分化[1]。对于II型糖尿病高血糖的成因,除了过去人们熟知的胰岛β细胞的分泌缺陷、肝糖原输出增加、肌肉组织葡萄糖摄取减少之外,还有更多的组织器官参与了糖尿病的病理生理过程,包括:(1)脂代谢紊乱;(2)肠促胰素效应减弱;(3)胰岛α细胞分泌胰高血糖素增多;(4)肾小管对葡萄糖的重吸收增加;(5)下丘脑对血糖的调控紊乱。这“八重奏”揭示了II型糖尿病病理生理的复杂性,也为临床用药带来了新的思考[2]。
当前,II型糖尿病的治疗面临着3大挑战:(1) 如何阻止β细胞功能的进行性减退。在II型糖尿病的发生发展过程中,β细胞功能呈5个阶段[3]进行性降低。在这5个阶段中,β细胞的数量、形态和功能发生着演变。β细胞功能性减退在II型糖尿病发生发展中起关键作用。保护胰岛β细胞功能在II型糖尿病治疗中至关重要。(2)如何解决治疗达标和低血糖之间的矛盾。血糖治疗达标无疑是延缓和降低糖尿病大血管和微血管并发症的重要手段。但随着血糖治疗达标率的提高,低血糖的发生率也随之增加。低血糖一直是糖尿病治疗中困扰医患的难题,可能导致严重心脑血管意外乃至危及生命[4]。(3)如何全面控制危险因素使糖尿病患者更多受益。随着糖尿病治疗方案的日益优化,糖尿病患者生存期逐渐延长,由糖代谢异常所致的靶器官损害成为了影响患者预后的主要因素。众所周知,除糖代谢异常外,还有很多危险因素与心脑血管事件独立相关,包括超重、高血压、血脂异常等。面对这些挑战,人们一直在不断探索一种既可以保护β细胞功能,又能在有效降糖的同时针对其他病理生理缺陷,改善其他代谢紊乱,甚至保护心血管的II型糖尿病治疗新思路。胰高血糖素样肽-1自发现以来的研究及应用探索,正反映了人们寻求糖尿病治疗新思路的这一趋势。
1 GLP-1的发现及结构特点继1902年,Bayliss和Starling发现第一个胃肠多肽激素——胰泌素(Secretin)后,1929年,我国学者冯德培、侯祥川和林可胜教授在国际上率先发现并命名了肠抑胃素(Enterogastrone)。同年,Zunz等和La Barre[5]发现缺少该组分的肠分泌物具有升血糖效果,于是La Barre首次引入了“incretin”这个词来描述这种可能具有促胰岛内分泌素分泌的物质。到了20世纪60年代,Mcintyre等[6]发现,口服葡萄糖对胰岛素分泌的促进作用明显高于静脉注射葡萄糖,这种额外的效应被称作“肠促胰素效应”;Perley等[7]证实肠促胰素效应产生的胰岛素占进食后胰岛素分泌总量的50%以上。 80年代的生理学研究表明,小肠内分泌细胞产生的一种激素可以调节胰岛对进餐的反应,该激素在餐后会促进胰岛素的适量分泌,因而被命名为肠促胰素(Incretin);1986年,Nauck等[8]发现II型糖尿病患者的肠促胰素效应减弱,提示肠促胰素系统异常可能是II型糖尿病的发病机制之一。随着细胞和分子生物学的快速发展,现在人们知道肠促胰素是人体内的一种肠源性激素,进食以后能够促进胰岛素的分泌,从而发挥葡萄糖依赖性的降血糖作用,主要由胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性胰岛素释放肽(glucose-dependent Insulin-tropic polypeptide,GIP)组成,其中,GLP-1在II型糖尿病的发生发展中起着更为重要的作用。
胰高血糖素样肽-1,顾名思义,同胰高血糖素一样,都源于胰高血糖素原基因。在胰岛α细胞中,胰高血糖素原基因的主要表达产物是胰高血糖素;但在肠黏膜的L细胞(主要由末端空肠、回肠和结肠的朗罕氏细胞所分泌)和大脑,胰高血糖素原160个氨基酸残基序列经过前激素转换酶(PC1)介导的翻译后加工,被剪切变成其羧基端的含有37个氨基酸残基肽链序列,之后再被酶解切除其N端的6个氨基酸(图 1)[9]。在人体内,GLP-1有两种生物活性形式,分别为31个氨基酸的GLP-1(7-37)和30个氨基酸的GLP-1(7-36)酰胺,两者只有一个氨基酸残基不同,并且GLP-1约80%的循环活性来自GLP-1(7-36)酰胺[1, 2]形式[10]。

|
|
图 1 活性GLP-1 与胰高血糖素氨基酸序列比对
|
GLP-1属于肽类激素中胰高血糖素超家族,胰高血糖素和源自沙漠毒蜥蜴唾液的Exendin-4都属于该家族。序列分析表明该原基因含有4个外显子,分别编码mRNA的5'非翻译区、信号肽、激素及3'非翻译区。GLP-1序列在动物进化中高度保守,表明它在调控生理过程的重要性。此外,研究还表明His1、Gly4、 Phe6、Thr7、Asp9、Phe22和Ile23这些位置的氨基酸残基对于GLP-1的亲和能力和生物活性至关重要。
2 GLP-1作用机制及功能多样性GLP-1的降糖作用具有葡萄糖浓度依赖性,即GLP-1作为一种肠源性激素,只有在营养物质特别是碳水化合物造成血糖水平升高的情况下,才发挥降糖作用,而在血糖水平正常时,则不会使其进一步降低。研究证实,Incretin以葡萄糖浓度依赖性的方式促进胰岛β细胞分泌胰岛素,并减少胰岛α细胞分泌胰高血糖素,从而降低血糖。也就是说,正常人在进餐后,促使肠促胰素分泌,进而促进胰岛素的分泌,从而减少餐后血糖波动。然而,II型糖尿病患者肠促胰素效应受损,表现在进餐后GLP-1浓度升高幅度较正常人有所减小,但其促进胰岛素分泌来降血糖的作用并无明显受损。GLP-1的这种葡萄糖浓度依赖性降糖特性免除了人们对现有糖尿病治疗药物及方案可能造成患者严重低血糖的担心,因此,GLP-1及其类似物可以作为II型糖尿病治疗的一个重要选择。
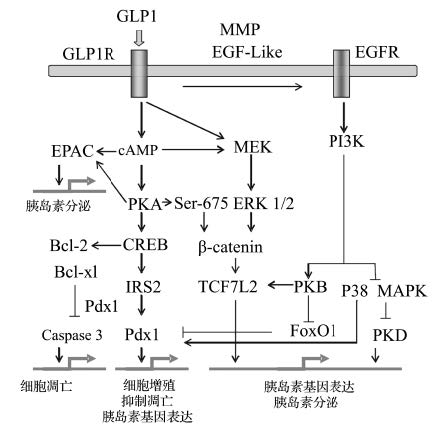
此外,越来越多的研究发现,GLP-1是一个多功能的降血糖激素,多重功效主要表现在:(1) 促进胰岛素的生物合成和分泌。GLP-1通过直接途径和间接途径来促进胰岛素分泌。在直接途径中,GLP-1对糖代谢的影响是通过与胰腺β细胞上特异的受体相互作用产生的,从而使葡萄糖诱导的胰岛素分泌显著增强。在间接途径中,GLP-1通过激活β细胞上的敏感神经和葡萄糖感受器来起作用[11]。不管是间接途径还是直接途径,GLP-1的作用都是血糖浓度依赖性的,即血糖越高,作用越强,血糖下降作用便减弱,直至血糖浓度小于3.6 mmol/L时,GLP-1不再发挥刺激胰岛素分泌的作用。因此,GLP-1的这种作用特性不会引起严重的低血糖;(2) 抑制胰高血糖素的分泌。GLP-1作用于胰岛α细胞,强烈地抑制胰高血糖素的释放[11];作用于胰岛δ细胞,促进生长抑素的分泌,而生长抑素可作为旁泌素抑制胰高血糖素的分泌。上述作用也是血糖浓度依赖的,当血糖降到一定的水平后,GLP-1将不再抑制胰高血糖素的分泌;(3) 保护胰岛β细胞。可刺激胰岛β细胞的增殖和分化[12],促进胰岛β细胞的再生和修复,许多研究表明,GLP-1可诱导胰腺细胞、小肠表皮细胞和胰腺中胰岛来源的前体细胞分化成为β细胞或具有分泌胰岛素功能的细胞来增加β细胞的数量[13];抑制胰岛β细胞凋亡,主要是通过保持β细胞形态、抑制前凋亡基因的表达来保护β细胞。研究表明,GLP-1通过上调抗凋亡蛋白Bcl-2抑制caspase3的活性,并激活核因子KappaB(NF-κB)启动子的活性来促进β细胞的存活(图 2);(4) 改善胰岛素敏感性(胰外作用),从而减少I型糖尿病患者对胰岛素的需求量[14];(5)抑制胃排空和胃酸分泌,通过多种途径降低体重[15]。这些作用都是通过迷走神经调节来实现的,并且这种抑制作用强度依赖于血清中GLP-1的剂量;(6)作用于中枢神经系统,特别是下丘脑,从而使人体产生饱胀感和食欲下降[16];(7)在胰岛素作用的靶器官肝脏、骨骼肌和脂肪组织上亦存在高亲和力的 GLP-1 结合位点,GLP-1 可促进肝脏、骨骼肌和脂肪组织的糖原合成和脂肪生成,可能发挥降脂降压作用,从而对心血管系统产生保护作用[17];(8)通过作用于中枢增强学习和记忆功能,保护神经(图 3)。
GLP-1的功能由GLP-1受体介导。GLP-1受体属于7次跨膜G蛋白耦联受体B家族中的胰高血糖素受体亚家族,含463个氨基酸,广泛分布在人的胰岛、心脏、肾脏、肺,以及中枢和周围神经系统的多个区域。当人体受到营养、激素、神经输入等就会刺激肠道L细胞分泌GLP-1,循环活性的GLP-1通过与其受体结合后,通过多向性传导途径激活cAMP/PKA/CREB,cAMP/Akt/PKB和MAPK等信号途径来发挥其多重生物学作用。一方面,GLP-1与胰岛β细胞表面的受体GLP-1R相结合活化Gα亚基,激活腺苷酸环化酶(AC),增加AC水平,引起胞内环腺苷酸(cAMP)浓度的增加,cAMP进一步激活下游的效应蛋白:蛋白激酶A(PKA)和直接被cAMP活化的鸟苷酸交换因子EPAC2。激活的PKA促使下游K-ATP通道关闭,线粒体膜电位去极化,激活Ca2+信号通路,Ca2+通道打开并内流,增加cAMP应答元件结合蛋白(CREB)的转录活性,上调胰岛素受体底物2(IRS2)的表达。或者GLP-1与胰岛β细胞表面的GLP-1R相结合活化Gβγ亚基,经由表皮生长因子β细胞素(beta-cellulin)或者基质金属蛋白酶9(MMP9),反式激活表皮生长因子受体(EGFR),进而激活磷脂酰肌醇3激酶(PI3K)以及下游的PKB/Akt和丝裂原活化蛋白激酶P38(P38MAPK)(图 2)。
另外,当血糖降至一定水平,分泌出来的胰岛素的浓度反过来抑制GLP-1的释放,负反馈机制的存在调控了GLP-1的分泌。这也从一定角度解释了GLP-1降血糖作用对人体葡萄糖浓度的依赖性。
综上所述,GLP-1在糖尿病患者体内的降血糖作用不会造成任何机体损伤,还免除了人们对现有糖尿病治疗药物及方案可能造成患者严重低血糖的担心,并且不存在口服降糖药物不可避免的副作用,再加上多重作用功效,为II型糖尿病的治疗提供了一个广阔的应用前景。利用肠促胰素来治疗II型糖尿病已经成为今后糖尿病药物研究的重要发展方向。
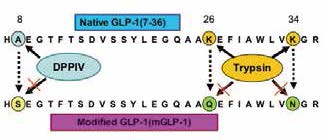
3 GLP-1应用于临床现面临的挑战前景虽好,然而,要将GLP-1应用于临床目前却面临着一个极大地挑战:人体自身产生的GLP-1 极易被体内广泛存在的二肽基肽酶Ⅳ(DPP-Ⅳ)从N端His7-Ala8处降解,产生GLP-1(9-36)NH2或GLP-1(9-37)形式而失活,导致其血浆半衰期不足2 min。此外,GLP-1分子量不足4 kD,如此小的分子量使其很容易在代谢中被肾小球滤过。因此,必须持续静脉滴注或持续皮下注射才能产生疗效,这极大地限制了GLP-1的临床应用。因此,如何延长GLP-1在人体内的作用成为临床制药的关键。如何科学地利用GLP-1的生理特性来积极寻找长效的新型类似物成为缓解或治疗II型糖尿病的关键问题。为解决这一难题,目前研究人员集中致力于3种解决方案:(1) 开发GLP-1类似物,让其既保有GLP-1的功效但同时又能抵抗二肽基肽酶Ⅳ的降解;(2) 开发DPP-Ⅳ抑制剂,通过抑制其活性,使体内自身分泌的GLP-1不被降解;(3) 利用重组的方法,将GLP-1基因前后串联起来形成多聚体蛋白,不仅可以提高其表达量,而且进而通过基因修饰和改造增加重组表达产物的稳定性。GLP-1给药方式的研究目前也多种多样,但一般集中在口服或腹腔注射上。迄今为止,这些研究都已经取得了一定的进展。
4 GLP-1类似物的研究与应用进展 4.1 采用化学合成法制备GLP-1类似物药物国外现在多采用化学合成的方法得到GLP-1或其类似物。自2005年国际上第一个肠促胰素类药物上市以来,此类药物的研究和临床应用均有了较快发展。截至目前,在我国已经上市包括2种GLP-1受体激动剂和5种DPP-VI抑制剂。
GLP-1受体激动剂通过模拟天然GLP-1来激活受体从而发挥作用,并且不易被DPP-VI降解,半衰期一定程度的延长增加了活性GLP-1在人体内的浓度,降糖效果明显。2005年,由Lily公司和Amylin公司合作的第一个GLP-1类似物药物艾塞那肽exenatide(Byetta,商品名百泌达),就是一种短效GLP-1受体激动剂,现已上市。Exenatide是美洲毒蜥蜴唾液中多肽exendin-4的人工合成多肽,如前文所述,exendin-4虽与GLP-1具有53%的同源性,但由于其活性形式具有不同于GLP-1(His-Ala)的His-Gly,而能有效抵抗DPP-VI降解。另外一种已经在中国上市的是Novo Nordisk公司研制的长效GLP-1受体激动剂——GLP-1类似物利拉鲁肽(1iraglutide,商品名诺和力),是对人GLP-1分子结构局部进行修饰加工而成,与GLP-1有97%的同源性,只是将GLP-l的Lys28转变为Arg28,同时在多肽C末端增加一个Gly,在Lys20侧链上增加了一个C16的脂肪酸侧链,该侧链通过与人血清白蛋白结合,从而增加GLP-1在体内的半衰期[20]。
DPP-IV抑制剂通过阻止DPP-IV酶解体内GLP-1,使得GLP-1的生理浓度在一定程度上升高,以葡萄糖浓度依赖的方式促进胰岛素释放,并降低胰高血糖素的水平来治疗糖尿病。目前在中国已上市的DPP-4抑制剂类药物有5种:西格列汀(sitagliptin,商品名捷诺维)、沙格列汀(saxagliptin,商品名安立泽)、维格列汀(vildagliptin,商品名佳维乐)、利格列汀(1inagliptin,商品名欧唐宁)和阿格列汀(alogliptin,商品名尼欣那)。
这些GLP-1类似物药物现在都已上市,适用于成人II型糖尿病患者,GLP-1受体激动剂服用方式同胰岛素一样,需要通过皮下注射才能发挥功效;DPP-IV抑制剂均为口服制剂。两者都伴有轻微低血糖症状发生,而且存在潜在的不良作用并且价格昂贵,这无疑令糖尿病患者悲喜交加。
4.2 采用基因工程方法制备GLP-1类似物药物国内由于受到化学合成成本、技术等原因的限制,多采用基因工程的方法获取重组hGLP-1,首选的蛋白表达系统是大肠杆菌。左翼等[21]于2006年将hGLP-1 cDNA基因插入pET-32a(+)载体中,构建成一个含硫氧还蛋白(thioredoxin)、六聚组氨酸(hexahistidine)与rhGLP-1的融合表达载体pET32-GLP-1,在此基础上将该融合基因序列进行同向串联,获得二串和三串的表达载体pET32-GLP-1-2和pET32-GLP-1-3,含多个hGLP-1基因的串联体,可以提高GLP-1的产量。利用上述3种表达载体分别转化大肠杆菌BL21(DE3)后获得相应的基因工程菌,经发酵和IPTG诱导后,3个工程菌均能正确表达目的蛋白,且目标蛋白的表达量随着基因串数的增加而得到一定提高。重组蛋白经分离纯化后,腹腔注射小鼠进行生物学活性测试,结果发现它们具有明显的降血糖作用。
2007年,Hou等[22]在大肠杆菌BL21(DE3)中表达hGLP-1八联体类似物,即将Ala8突变Ser8,将Lys26,34分别突变成Gln26和Asp34,然后His标签融合蛋白纯化后经20 mg/kg剂量给经链脲佐菌素(STZ)诱导的II型糖尿病大鼠口服,10 d后发现,大鼠的血糖明显下降,高血糖症状得到显著缓解。
2008年,窦文芳等[23]将hGLP-1 DPP-IV作用位点突变后进行串联,与谷胱甘肽-S转移酶(glutathione S-transferase,GST)标签融合,在大肠杆菌BL21(DE3)基因工程菌中获得表达,经发酵和IPTG诱导后,获得正确表达的目的蛋白。重组蛋白经分离纯化后,通过尾静脉注射小鼠进行口服葡萄糖耐受实验(OGTT)测定,结果显示目的蛋白不仅显著降血糖活性,且能有效抵抗DPP-IV的降解。
与此同时,也有人用酵母表达系统来制备重组GLP-1,并取得了很好的结果。酵母蛋白表达系统属于真核表达系统,相对大肠杆菌原核表达系统具有一定的优势。陈其亮等[24]于2008年采用基因串联的方法,将GLP-1序列上DPP-IV水解部位进行突变,克隆到毕赤酵母中,表达和纯化后得到的GLP-1在小鼠体外胰岛β细胞增殖实验中检测到有促细胞增殖活性。
2010年,李现丽等[25]继续陈其亮等人的工作,将突变串联后的GLP-1序列同人血清白蛋白(HAS)融合,转化毕赤酵母进行表达,融合蛋白经纯化后在C57BL/6小鼠体内进行OGTT,结果表明融合蛋白经皮下给药8 h后仍能发挥显著的降糖活性。
吴日等[26]在酿酒酵母中组成型表达10×GLP-1,将表达成功的长效促胰岛素降糖酵母(long-acting GLP-1 hypoglycemic yeast,LHY)作为益生菌口服灌胃给经STZ诱导和高脂高糖饮食联合诱导的II型糖尿病小鼠模型,结果表明,LHY口服灌胃治疗具有较好疗效,可以明显降低血糖水平。
此外,在植物中表达hGLP-1方面,也取得了不少喜人的成果。最值得关注的是,2008年日本人Jomori等[27]首先对人GLP-1即GLP-1(7-36)进行了修饰,将Ala8突变Ser8,将Lys26,34分别突变成Gln26和Asn34,然后将改造后GLP-1基因头尾串联,获得了5个GPL-1基因的串联体5×mhGLP-1(图 4),这种设计赋予GLP-1对DPP-IV和trypsin蛋白酶较高的抗性。将改造后的5×mhGLP-1基因导入水稻中进行表达发现,5×mhGLP-1重组蛋白在水稻胚乳中大量积累。将该转基因水稻种子研磨成粉经胰蛋白酶处理后饲喂糖尿病小鼠,结果发现,转基因水稻可显著降低小鼠血液中的葡萄糖含量。该研究成果现已申报了国际发明专利。
在此基础上,也有人将原始GLP-1肽链进行了改变,分别将Ala8→Ser8,Lys26→Gln26和Lys34→Asp34,保留了Arg36,原因是它是体内GLP-1酰胺化所必需的,而酰胺化可以延长GLP-1在体内的半衰期,并在多肽C末端添加一个Cys残基,以增加GLP-l的稳定性[28]。Cys残基可能促使GLP-1形成双体或者多聚体,降低水溶性,以更好地抵抗酶的降解,同时在注入体内之后可能继续保持双体或者多聚体形态,降低可溶性以达到缓释作用。即便Cys解链,它也可以与人血清白蛋白(HAS)结合,改善药物代谢动力学性质。金明飞等[29]在随后的体内实验中验证了改构之后的GLP-1显著的长效的降血糖活性。
Yasuda等[30]于2005年在水稻种子中表达由谷蛋白(glutelin)信号肽融合的GLP-1单体时失败,此发现证实GLP-1单体在转录后被siRNA沉默掉,也有可能由于短肽的不稳定性而被蛋白酶水解了。一年后,他们研究由glutelin或几丁质酶(chitinase)信号肽融合的GLP-1五聚体同样在水稻种子中表达时也失败了,由此证实工程植物信号肽不能从成熟融合蛋白正确切除因而影响目标蛋白的活性[31]。在此研究基础上,Brandsma等[32]将10×GLP-1串联重复转化烟草并在烟草叶片中获得表达量较为可观的可溶性蛋白,经纯化后在体外胰岛素分泌实验中证明,135 min后ELISA仍可检测到上清胰岛素。
5 展望GLP-1作为一种新型的生物药物,与当前市售与使用的化学类药物相比,优势显著,它能够调动人体多器官组织参与,多重调节人体血糖平衡,达到综合治疗糖尿病的效果。此外,它还能促进胰腺β细胞的增殖与分化,抑制β细胞的凋亡,恢复胰腺功能,标本兼治。因此,针对GLP-1研发能改善β细胞的功能、服用方便、控制血糖持久的药物意义重大,也引起了国内外研究的热点。目前,采用分子生物学及生物工程技术手段对延长GLP-1半衰期的研究经验比较丰富,但在临床应用上的步伐远跟不上化学合成类似物的方法,它在节约成本方面的优势显而易见,而且,对于口服GLP-1降糖药物的研究仍有很长远的路要走。当前,本实验室工作聚焦在采用分子生物学方法及生物工程技术对延长hGLP-1半衰期和类似物的口服药效方面进行研究。经过前期对影响hGLP-1半衰期的结构修饰,截至目前,已经在大肠杆菌和毕赤酵母中成功表达hGLP-1突变体融合蛋白,并正着手体外细胞实验以及动物实验进行突变体的活性鉴定。相信随着人们对GLP-1应用探索的深入,针对其半衰期的延长会提出更为巧妙的新思路,从而开发出更多有效的治疗糖尿病的新型药物,亲民的价格,简单的口服,便可以攻克糖尿病。
| [1] | Talchai C, Xuan S, Lin HV, et al. Pancreatic β cell dedifferentiation as a mechanism of diabetic β cell failure[J]. Cell, 2012, 150(6): 1223–1234. |
| [2] | DeFronzo RA. From the triumvirate to the ominous octet:a new paradigm for the treatment of type 2 diabetes mellitus[J]. Diabetes, 2009, 58(4): 773–795. |
| [3] | Weir GC, Bonner-Weir S. Five stages of evolving beta-cell dysfunction during progression to diabetes[J]. Diabetes, 2004, 53: 16–21. |
| [4] | Cryer P E, Davis SN, Shamoon H. Hypoglycemia in diabetes[J]. Diabetes Care, 2003, 26(6): 1902–1912. |
| [5] | Zunz E, La Barre J. Contributions à l'étude des variations physiologiques de la sécrétion interne du pancréas[J]. Arch Physiol Biochem, 1929, 31(2): 162–179. |
| [6] | Mcintyre N, Holdsworth C, Turner D. Intestinal factors in the control of insulin secretion[J]. The Journal of Clinical Endocrinology and Metabolism, 1965, 25(10): 1317–1324. |
| [7] | Perley MJ, Kipnis DM. Plasma insulin responses to oral and intravenous glucose:studies in normal and diabetic subjects[J]. Journal of Clinical Investigation, 1967, 46(12): 1954. |
| [8] | Nauck M, St?ckmann F, Ebert R, et al. Reduced incretin effect in type 2(non-insulin-dependent)diabetes[J]. Diabetologia, 1986, 29(1): 46–52. |
| [9] | Darleen AS, David AD. Physiology of proglucagon peptides:role of glucagon and GLP-1 in health and disease[J]. Physiological Reviews, 2015, 95(2): 513–548. |
| [10] | Wu TZ, Rayner CK, Horowitz M. Incretins[J]. Handbook of Experimental Pharmacology, 2015, 233: 137–171. |
| [11] | Ahrén B. Sensory nerves contribute to insulin secretion by glucagon-like peptide-1 in mice[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2004, 286(2): 269–272. |
| [12] | Flamez D, Van Breusegem A, Scrocchi LA, et al. Mouse pancreatic beta-cells exhibit preserved glucose competence after disruption of the glucagon-like peptide-1 receptor gene[J]. Diabetes, 1998, 47(4): 646–652. |
| [13] | Drucker DJ. The biology of incretin hormones[J]. Cell Metab, 2006, 3(3): 153–165. |
| [14] | Suzuki A, Nakauchi H, Taniguchi H. Glucagon-like peptide 1(1-37)converts intestinal epithelial cells into insulin-producing cells[J]. Proceedings of the National Academy of Sciences, 2003, 100(9): 5034–5039. |
| [15] | 单忠艳. GLP-1类似物在糖尿病治疗中的作用[J]. 药品评价, 2009, 6(12): 500–501. |
| [16] | Zander M, Madsbad S, Madsen JL, et al. Effect of 6-week course of glucagon-like peptide 1 on glycaemic control, insulin sensitivity, and β-cell function in type 2 diabetes:a parallel-group study[J]. The Lancet, 2002, 359(9309): 824–830. |
| [17] | Yamamoto H, Kishi T, Lee CE, et al. Glucagon-like peptide-1-responsive catecholamine neurons in the area postrema link peripheral glucagon-like peptide-1 with central autonomic control sites[J]. The Journal of Neuroscience, 2003, 23(7): 2939–2946. |
| [18] | Baggio LL, Drucker DJ. Biology of incretins:GLP-1 and GIP[J]. Gastroenterology, 2007, 132(6): 2131–2157. |
| [19] | 郭莉霞, 刘建辉, 陈刚, 等. 胰高血糖素样肽1类似物调节胰岛素分泌细胞增殖和功能的细胞信号通路研究进展[J]. 中国药理学与毒理学杂志, 2009, 23(4): 308–311. |
| [20] | 蔡德海, 宋光明, 丁全福. 利拉鲁肽人GLP-1类似物2型糖尿病的新疗法[J]. 河北医学, 2010, 16(2): 230–232. |
| [21] | 左翼, 黄静, 卞慧芳, 等. 人胰高血糖素样肽-1 串联体的克隆及其表达[J]. 华东师范大学学报:自然科学版, 2006, (4): 110–114. |
| [22] | Hou JH, Yan RX, Ding DF, et al. Oral administration of a fusion protein containing eight GLP-1 analogues produced in Escherichia coli BL21(DE3)in streptozotocin-induced diabetic rats[J]. Biotechnol Lett, 2007, 29(10): 1439–1446. |
| [23] | 窦文芳, 张莲芬, 雷楗勇, 等. 人胰高糖素样肽-1及其突变体在毕赤酵母中的表达与生物活性研究[J]. 生物技术通报, 2008, (6): 139–143. |
| [24] | 陈其亮, 窦文芳, 雷楗勇, 等. 重组胰高糖素样肽-1 融合蛋白的纯化及其活性测定[J]. 生物技术通报, 2008, (6): 147–151. |
| [25] | 李现丽, 窦文芳, 张晓梅, 等. 融合蛋白(GLP-1A2G)2-HSA的分离纯化及其活性评价[J]. 药物生物技术, 2010, 17(6): 487–492. |
| [26] | 吴日, 马超, 李晓丹, 等. 长效促胰岛素降糖酵母的构建及其对糖尿病模型小鼠的治疗效果[J]. 遗传, 2015, 37(2): 183–191. |
| [27] | Jomori T, Hayashi Y, Makino M, et al. GLP-1 derivative and use thereof[J]. Diabetes, 200857, 57: 409. |
| [28] | Wu YL, Huang J, Xu J, et al. Addition of a cysteine to glucagon-like peptide-1(GLP-1)conjugates GLP-1 to albumin in serum and prolongs GLP-1 action in vivo[J]. Regul Pept, 2010, 164(2): 83–89. |
| [29] | 金明飞. 口服胰高血糖素样肽-1的筛选和应用研究[D]. 上海:华南师范大学, 2008. |
| [30] | Yasuda H, Tada Y, Hayashi Y, et al. Expression of the small peptide GLP-1 in transgenic plants[J]. Transgenic Research, 2005, 14: 677–684. |
| [31] | Yasuda H, Hayashi Y, Jomori T, et al. The correlation between expression and localization of a foreign gene product in rice endosperm[J]. Plant Cell Physiol, 2006, 47(6): 756–763. |
| [32] | Brandsma M, Wang X, Diao H, et al. A proficient approach to the production of therapeutic Glucagon-Like Peptide-1(GLP-1)in transgenic plants[J]. The Open Biotechnology Journal, 2009, 3: 57–66. |