2. 湖北工业大学绿色轻工材料湖北省重点实验室,武汉 430068
2. Hubei Provincial Key Laboratory of GreenMaterials for Light Industry,Hubei University of Technology,Wuhan 430068
肝脏是人体的重要器官,它是人体的物质代谢中心,负责人体的代谢、排毒、循环调节身体的功能。然而肝脏疾病对人体危害极大甚至导致死亡,威胁着人类的身体健康,肝组织工程支架材料已经成为了医学与科学领域的一个重要研究。肝组织工程是一门新兴学科,其核心是使肝细胞与生物载体材料形成三维体外活体组织,以病损组织重建或永久替代[1]。根据来源不同,可将原材料分为天然高分子材料和人工合成高分子材料[2, 3]。
木素碳水化合物(lignin-carbonhydrate complex,简称LCC)是由木素和聚糖通过共价键形成的不均一高分子,是良好的生物材料[4, 5]。李金玲等[6]发现,LCC具有良好的动物细胞相容性,所含聚糖部分具有细胞识别能力,能与细胞上的糖受体发生吸附[7]。然而,动物细胞对木素与多糖的亲和性不同,天然LCC具有一定局限性,若能够使用木素脱氢聚合物(dehydogenation polymer,简称DHP)及其衍生物与聚糖进行聚合,将能够灵活的满足不同细胞需求。
1960年,Ferudenberg等[8]对木质素的合成进行了研究,使用松伯醇合成一种叫做脱氢聚合物的人工合成木素,它的结构与天然木质素的结构十分相似。1995年,Terashima等[9]将甘露糖和果胶视为碳水化合物与木质素进行复合,以松伯醇葡萄糖苷作为木质素的前驱化合物在过氧化物酶体系下合成了DHP与多糖的复合体,这种复合体的结构与磨木木质素结构相似。 Seo等[10]利用木材聚半乳糖葡萄糖甘露糖侧链上的半乳糖单元,使肝细胞能够在基质上良好的粘附并形成肝细胞聚集体。肝细胞是一种依赖贴壁性的细胞,其表面存在去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)[11],又称为半乳糖受体,主要表达与肝细胞表面,可以与半乳糖产生特异性作用。采用DHP与D-半乳糖复合制备多孔生物水凝胶[12]载体,可以模仿天然LCC在细胞培养中的应用,其具有一定的溶胀率[13],可以提高载体的比表面积并使载体孔隙增大,有利于营养物质的传输和代谢物质的清理,肝细胞在孔内生长也能受到保护,更接近于正常形态。良好的生物相容性及三维结构,使体外培养时细胞形态和培养环境更加接近体内状态[14, 15],代谢活性比单层培养细胞有所提高[16, 17]。
本研究利用人工合成的DHP与D-半乳糖为原材料,通过与缩水甘油醚的交联形成DHP-半乳糖复合体,制备具有网状结构的多孔生物载体水凝胶。利用红外光谱分析仪、核磁共振波谱仪和孔隙率测定仪测定载体化学结构及多孔性能,并对体外培养中肝细胞代谢活性进行检测,旨在解决天然LCC制备生物载体中糖的种类与含量不可控的问题。
1 材料与方法 1.1 材料醋酸钠、醋酸、过氧化物酶、乙醇、二甲基亚砜、磷酸盐缓冲液、聚乙二醇缩水甘油醚;白蛋白试剂盒、葡萄糖试剂盒,南京建成生物研究所;胎牛血清,杭州四季青公司;RPMI-1640培养基,赛默飞世尔生物化学制品有限公司;胰蛋白酶消化液,谷歌生物;人体肝细胞L-02,武汉原生原代生物医药科技有限公司。
FT-IR型红外光谱仪Thermofisher Nicolet 6700型;冷冻干燥机Labconco 195型;扫描电子显微镜JSM-5610LV,日本电子株式会社;紫外可见分光光度计Shimadizu UV-2550型;全自动比表面和孔隙度分析仪BELSORP-MiniⅡ型。
1.2 方法 1.2.1 DHP多孔生物载体材料的制备 1.2.1.1 人工合成DHP将松柏醇-β-D葡萄糖苷溶解在醋酸钠/醋酸缓冲溶液(pH4.6)中,在无菌条件下将含有辣根过氧化物酶、葡萄糖氧化酶和β-葡萄糖苷酶的混合溶液加入三口瓶中,使用恒流泵将松柏醇-β-D葡萄糖苷溶液滴加到含酶的缓冲溶液中,三口瓶始终保持无菌状态在恒温水浴锅(30℃)中,并持续经过活性炭和棉花净化通入空气,当松柏醇-β-D葡萄糖苷溶液滴加完后,等待反应1 d后,继续加入酶的混合溶液,继续反应7 d。反应结束后将溶液离心分离,保留固体物质,使用蒸馏水清洗固体物质5次以上保证将残留的酶、水溶性的LCC以及未参加反应的起始物清洗干净,冷冻干燥后得到粗产物,向粗产物中加入二氯乙烷/乙醇(2/1,V/V)溶液,室温下搅拌4 h后离心分离,收集溶解部分在40℃下旋转蒸发,将所得的固体残留物放入减压真空干燥箱中干燥2 d得到DHP。
1.2.1.2 DHP-半乳糖复合体及多孔生物载体制备将50 mg DHP与100 μL NaOH(3.3 mol/L)放入小试管中,利用磁转子进行混合搅拌4 h后,向试管中添加100 μL聚乙二醇缩水甘油醚,含糖载体需再加入占总组分1%的D-半乳糖,搅拌均匀后封口,放入50℃水浴锅中反应24 h后接枝共聚成为DHP-半乳糖复合体,并得到成型的水凝胶材料,其具有一定强度。使用蒸馏水对水凝胶进行浸泡,每12 h更换一次蒸馏水,直至蒸馏水澄清且pH7,可将水凝胶材料取出。放入冷冻干燥机脱水24 h后取出,两种多孔生物载体制备完成。将载体于-20℃条件下进行保存,以供后续实验使用。
1.2.2 生物载体的化学结构表征 1.2.2.1 比表面积和孔隙度分析采用BELSORP-MiniⅡ型全自动比表面积和孔隙度分析仪对多孔生物载体的比表面积和孔结构进行分析,将载体样品于2502吸附与脱附,测定样品在不同P/P0下N2的凝聚量,得到样品的吸脱附曲线与孔径分布曲线,从而得出样品的比表面积,并通过电镜图观测多孔生物载体的孔隙度。
1.2.2.2 红外光谱分析取2 mg多孔生物载体材料样品与300 mg的无水KBr混合,研磨均匀后,取少量倒入压片模具中压片,采用Thermofisher Nicolet公司6700型红外光谱仪用透过法测定FT-IR光谱图。
1.2.2.3 多孔生物载体的糖分析取多孔生物载体样品50 mg,移入小试管中,加入72%硫酸500 μL,搅拌均匀后在常温下水解60 min,将水解液移至250 mL灭菌瓶中,加入洗涤水及蒸馏水14 mL,将酸稀释至质量分数为4%。将灭菌瓶移入高压灭菌锅中,在1213调节pH值至7,使用0.22 μm微孔滤膜过滤,使用HPLC对过滤后的液体进行测试。HPLC分离条件:色谱柱Aminex HPX-87P 300 mm×7.8 mm;柱温85℃;蒸馏水流动相;流速0.6 mL/min;最大压力10.3 MPa,检测器为差示折光检测器;进样量20 μL。
1.2.2.4 固体13 C NMR分析采用Bruker公司的AVANGE DRX-500超导核磁共振波谱仪,在100.6 MHz下对多孔生物载体进行13 C连续扫描,得到样品的固体13 C NMR谱图。实验条件:温度300 K,氘带POM(聚甲醛)转子(转速6.0 kHz),3 ms接触时间,0.05 s接受时间,脉冲宽度为12.8 μs,脉冲迟滞3 s。每个样品扫描越3 000次以提高信噪比。
1.2.2.5 扫描电子显微镜(SEM)分析将体外培养后的多孔生物载体收集,使用锇酸后固定技术,使附着在载体表面的肝细胞产生良好的的反差,继续使用梯度乙醇(50%,60%,70%,80%,90%,100%)脱水,真空干燥后将固定好的多孔生物载体材料置于硅片上,真空喷溅金离子,用扫描电子显微镜观察多孔生物载体材料的表面形态结构。
1.2.3 生物载体材料在人体细胞体外培养中的应用 1.2.3.1 人体肝细胞L-02的培养各取含糖与不含糖多孔生物载体15 mg在电热烘箱中1702,100%湿度的CO2培养箱中培养。每24 h更换一次培养液,并用倒置相差显微镜观察每天的细胞形态和细胞在生物载体表面的粘附情况。
1.2.3.2 细胞计数在人肝细胞L-02培养的第1-6天,在超净工作台上,每天分别取出实验组与对照组的代谢液,之后用2 mL的磷酸盐缓冲液(PBS)冲洗孔洞2次,用2 mL 0.25%的胰蛋白酶消化液消化8 min,弃去消化液,加入1 mL的RPMI-1640(含20%的新生胎牛血清)培养基终止消化,并将细胞从孔壁上吹打下来制备成细胞悬液。取200 μL细胞悬液,加入等量的0.4%台盼蓝溶液染色,使两者混合均匀,然后吸取适量混合液于细胞计数板上,在倒置显微镜下数出四大格中被染色的细胞的数量,按公式计算出细胞总数。
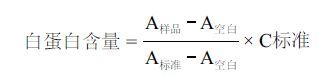
1.2.3.3 代谢活性的检测利用溴甲酚绿法测定白蛋白含量。取10 μL蒸馏水、白蛋白标准样(34.8 g/L)和实验过程中每天收集的细胞代谢液,分别加入小试管中,每个试管中都滴加2.5 mL溴甲酚绿溶液,室温下混匀反应10 min。 利用双蒸水在628 nm下将紫外分光光度计调零后,对以上试管进行测定得到各试管的吸光度A空白、A标准和A样品,白蛋白含量计算公式:
采用葡萄糖氧化酶-过氧化物酶法测定葡萄糖含量。取标准葡萄糖(5.55 mmol/L)和实验过程中每天收集的细胞代谢液,分别加入小试管中,之后每支试管中加入含葡萄糖氧化酶(10 U/mL)、过氧化物酶(1 U/mL)磷酸缓冲溶液(pH7)、苯酚(10.6 mmol/L)和4-氨基安替比林(70 mmol/L)的混合溶液1 mL,混匀后在37标准、A样品,葡萄糖含量计算公式:
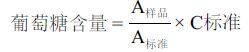
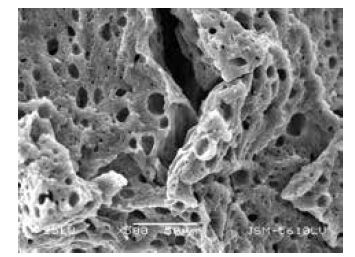
通过测定所得含糖生物载体的比表面积为6.013 m2/g,从图 1中可测量出含糖生物载体的平均孔径20 μm,孔隙率为60%,内部孔隙相互连通,有利于营养物质的扩散及代谢物质的排出。
|
| 图 1 DHP-半乳糖复合体的表面形态 |
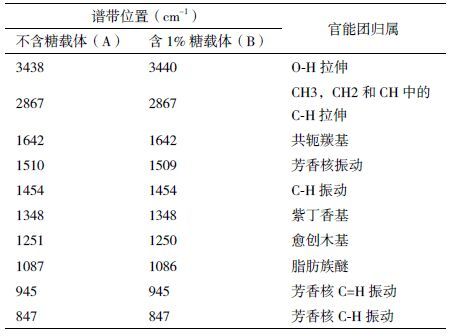
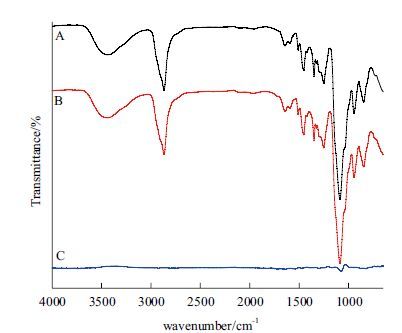
以DHP为原材料的多孔生物载体的红外光谱如图 2、表 1所示。从图 2可看出3438 cm-1处羟基峰、1087 cm-1处的C-O-C和醇基C-O的振动峰,表明其中存在糖结构,图 2-B中加入1%的D-半乳糖,从差谱图 2-C可观察到这两处峰强有所加强。图 2-A与图 2-B都具有来自木质素芳香核的1 510.01 cm-1和1 420.79 cm-1的吸收峰,表明两种材料都具有木质素结构。图 2-B材料不仅具有刚性疏水的木质素结构,还有柔性亲水的糖结构,使其具备生物载体的基本要求。
|
| 图 2 多孔生物载体的FT-IR 光谱图 A :不含糖载体FT-IR 光谱图;B :含糖载体FT-IR 光谱图;C :差谱(B-A) |
根据不同糖的标准回归曲线,使用高压液相色谱法测定多孔生物载体中的糖含量。测试结果显示,加入1%组分D-半乳糖的多孔生物材料中含有0.95%的D-半乳糖和部分葡萄糖,说明合成含糖多孔生物载体时,D-半乳糖基本按照预期所加含量与原材料进行结合,说明可以控制生物载体内的糖含量,得到最适宜的质量分数以保证多孔生物材料具有良好的生物相容性。
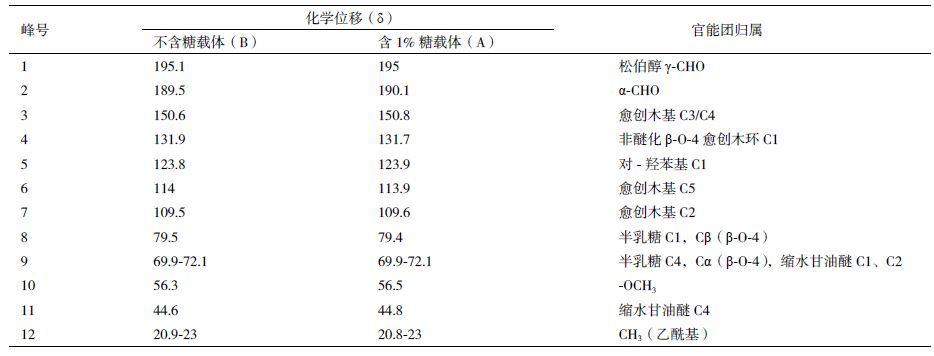
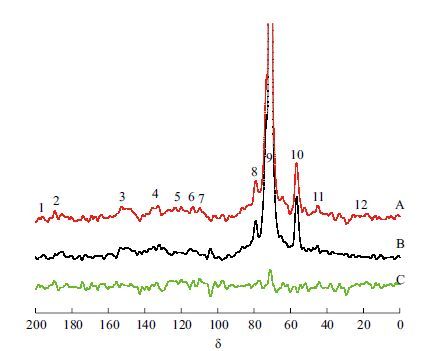
2.1.4 固体13CNMR谱图 在脂肪族碳原子区(δ0-110),δ79.5来自半乳糖与DHP以苯甲醚键连接结构的α-C与β-C(NO.8),δ69.9-72.1来自半乳糖与DHP以酯键连接结构的α-C。从差谱图中观察到δ79.5、δ69.9-72.1处有一定波动,表明图 3样品A中DHP与半乳糖发生连接,形成水凝胶生物载体。各材料共振信号的基团归属见表 2。
|
| 图 3 多孔生物载体的13C NMR 谱图 A :含糖载体13C NMR 谱图;B :不含糖载体 13C NMR 谱图;C :差谱(A-B) |
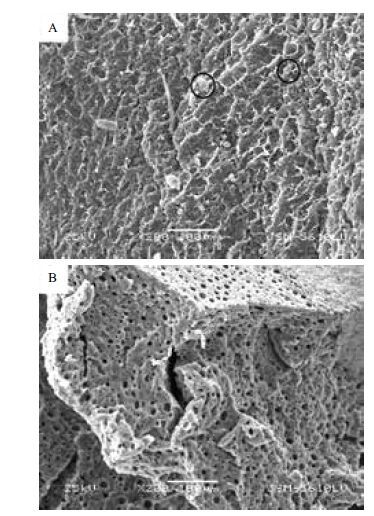
从图 4中可以观察到,两种生物载体表面的孔洞相互交错,都具有一定强度,且孔洞数量较多,提高比表面积,细胞能在孔内生长,使营养物质和代谢物质扩散畅通,提升了肝细胞生长的三维空间和营养输送。图 4-A标记处能够看到有肝细胞附着在其上,图 4-B中载体上无肝细胞附着。表明含糖多孔载体具有良好生物相容性,可以提供人体肝细胞适宜生长环境。
|
| 图 4 人工合成DHP 多孔生物载体的扫描电镜图 A :含糖生物载体表面形态;B :不含糖生物载体表面形态 |
将人体肝细胞L-02接种在制作好的多孔生物载体上,对细胞进行静态观察。每天将细胞培养孔板取出,置于倒置显微镜下观察肝细胞的生长情况与形态。图 5所示为含半乳糖的多孔生物载体培养人肝细胞时的培养图,从图 5中可以观察到随着天数增加,细胞生长情况越来越好,细胞数增多,并且能观察到细胞黏附在多孔生物载体周围进行生长且形态良好。图 6所示为不含糖的多孔生物载体细胞培养图,图 6中细胞前期有部分增加,但总体细胞数不多,第5、6天时细胞呈现减少趋势。由此证明含半乳糖的载体具有良好的生物相容性。
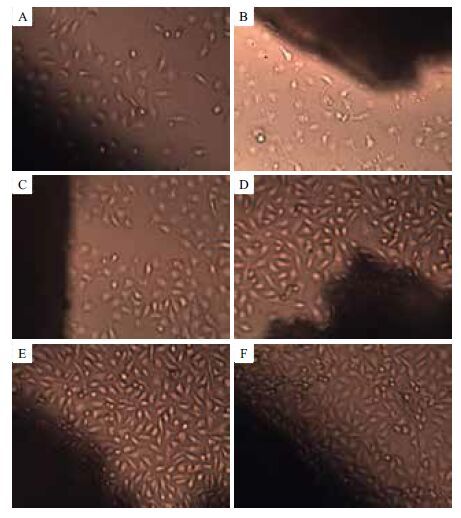
|
| 图 5 人体肝细胞L-02 在含糖多孔生物载体上的生长情况 A :第1 天;B :第2 天;C :第3 天;D :第4 天;E :第5 天;F :第6 天 |

|
| 图 6 人体肝细胞L-02 在不含半乳糖多孔生物载体上的生长情况 A :第1 天;B :第2 天;C :第3 天;D :第4 天;E :第5 天;F :第6 天 |
在倒置生物相差显微镜下使用细胞计数板,对培养的人体肝细胞L-02的第1-6天进行细胞计数,计数结果如图 7所示。从图 7中可看出,制作的不含半乳糖的DHP多孔生物载体所培养的人体肝细胞生长情况比不上空白样(Blank)。而加入D-半乳糖组分占1%的DHP多孔生物载体与空白对照组所培养的肝细胞生长良好,第1-5天细胞保持增长状态,第5天的生长速率最大,细胞总数到达最大值。DHP含糖载体的细胞培养数总体高于空白对照组,表明加入一定D-半乳糖的DHP多孔生物载体具有良好的生物相容性。
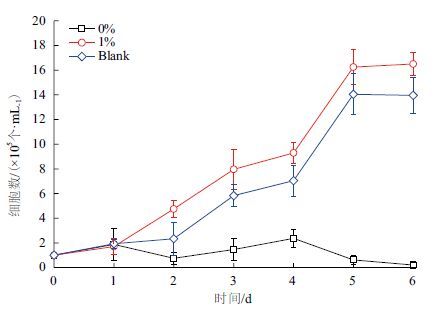
|
| 图 7 人肝细胞生长曲线 |
肝细胞的代谢活性的两项重要指标白蛋白分泌与葡萄糖代谢如图 8所示。从图 8可清晰看出,加入1%D-半乳糖的复合体材料在体外培养的6 d中,肝细胞L-02代谢活性始终保持较好状态,好于空白对照组与不加D-半乳糖的多孔生物载体,表明其具有良好的生物相容性,有利于对肝细胞的培养。
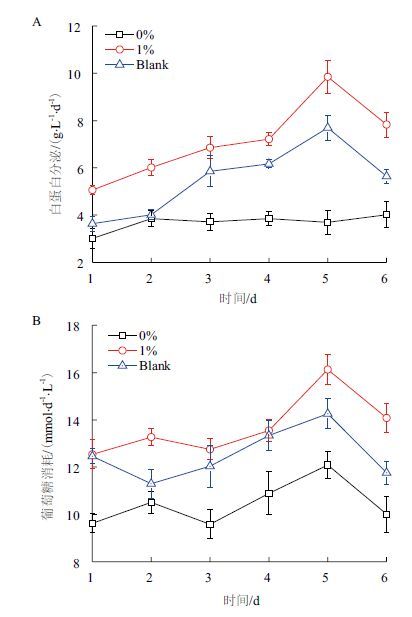
|
| 图 8 肝细胞代谢活性 >A :白蛋白分泌;B :葡萄糖代谢 |
天然LCC可以作为良好的生物载体材料,尤其是从银杏等木材提取的LCC由于含有适量的半乳糖聚合物[6],能为人肝细胞的半乳糖受体(galactose receptor)所感知到[18],从而促进体外培养过程中人肝细胞在LCC基生物载体上的黏附、生长、繁殖、分化,因此LCC基生物载体具有良好的生物相容性。但因天然LCC中半乳糖的含量根据植物纤维材料的种类而变化,选择具有最适合人肝细胞的半乳糖含量的植物纤维原料受到较大的限制。本研究为了解决此问题,使用DHP与D-半乳糖进行聚合,能够灵活地调节LCC基多孔生物水凝胶载体中D-半乳糖的含量。从生物载体的差示光谱的分析结果(图 2)可知,含1%糖载体在1 086 cm-1处的C-O-C弯曲振动信号明显增强,表明DHP上成功地接枝了D-半乳糖。从差示谱图(图 3)上发现79.4 ppm处的信号(No.8)和69.9-72.1 ppm处的信号(No.9)分别来自半乳糖结构单元中的C1和C4,进一步阐明了本研究合成的DHP-半乳糖复合体中半乳糖结构单元的存在。 通过水凝胶的方法制备医用多孔生物载体,比表面积为达到6.013 m2/g,适合人肝细胞的培养。因此,无论是生物载体化学组分还是多孔性及表面形态方面,以DHP与D-半乳糖的接枝共聚产物作为原料可以制备性能良好的多孔生物载体。
在体外培养中与肝细胞进行共培养,模拟天然LCC在细胞培养中的应用。对所制备的含糖与不含糖DHP生物载体进行电镜观察,两者都具有良好的三维多孔结构,由于使用了含半乳糖的生物载体,使肝细胞能够更好的附着在含糖载体表面进行生长,分析体外培养中肝细胞的生长情况及代谢活性,细胞计数结果得出采用含半乳糖与不含糖的载体时细胞数最大值分别为16.5×105/mL、2.375×105/mL,表明D-半乳糖的加入可以有效提高载体诱导人肝细胞的增殖的能力。使用以DHP-半乳糖复合体为原料制备的生物载体进行培养时,白蛋白分泌和葡萄糖代谢值最大值分别为:9.85 g/(d·L)、16.134 mmol/(d·L),远高于不含半乳糖的载体。以上结果表明DHP复合体材料结构适合细胞生长,具有良好的生物相容性。
本研究创新的使用了DHP与聚糖进行接枝共聚制备生物载体,此方法的优点在于可以对聚糖的种类及含量进行控制,更加灵活的满足各种细胞的需求。但缺点在于人工合成DHP-聚糖复合体的分子量较低,使得后期载体的制备步骤较为繁琐,周期较长,并且聚糖的最佳含量也需要反复试验,才能得到具有良好性质的生物载体。本研究尚未得出对于肝细胞D-半乳糖的最佳含量。在今后的研究中,将继续探索DHP多孔生物载体的不同制备方法,以实现快速、高效的载体制备,并针对不同细胞的需求,对所添加聚糖的种类及含量进行研究,使DHP多孔生物载体能够更好的投入到组织工程的应用中。
4 结论使用人工合成DHP制作的水凝胶多孔生物载体,具有良好的三维结构,平均孔径为20 μm,比表面积为6.013 m2/g。
利用DHP与D-半乳糖合成的接枝共聚产物制作的水凝胶多孔生物载体,比没有加入D-半乳糖的载体具有更好的生物相容性,细胞计数结果得出含半乳糖与不含糖细胞数最大值分别为:16.5×105/mL、2.375×105/mL,表明D-半乳糖的加入可以有效提高载体的生物相容性。
将水凝胶多孔生物载体用于人肝细胞的体外培养,肝细胞能够附着在其表面且生长良好,根据代谢活性结果,含半乳糖与不含糖的白蛋白分泌最大值分别为:9.85 g/(d·L)、4.01 g/(d·L),葡萄糖代谢最大值分别为:16.134 mmol/(d·L)、6.095 mmol/(d·L),肝细胞同时具有较高的代谢活性,以上表明用DHP-半乳糖接枝共聚产物制作的载体具有良好的生物相容性。
| [1] | Michalopoulos GK, DeFrances M. Liver Regeneration[J]. Science, 1997, 276(5309): 60–66. |
| [2] | 杨立群, 张黎明. 天然生物医用高分子材料的研究进展[J]. 中国医疗器械信息, 2009, (5): 21–27. |
| [3] | 龙仕和, 李明生, 靳冬武, 等. 天然高分子细胞培养基质的研究 进展[J]. 高分子通报, 2015, (2): 40–46. |
| [4] | Sakagami H, Hashimoto K, Suzuki F, et al. Molecular requirements of lignin-carbohydrate complexes for expression of unique biological activities[J]. Phytochemistry, 2005, 66(17): 2108–2120. |
| [5] | Lewis NG, Yamamoto E. Lignin : occurrence, biogenesis and Biodegradation[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1990, 41(1): 455–496. |
| [6] | 李金玲, 王鹏, 等. 银杏LCC 制备多孔生物载体及在人体肝细 胞培养中的应用[J]. 林产化学与工业, 2014, (06): 81–87. |
| [7] | 包志明, 潘继伦, 吴晨, 等. 半乳糖修饰大孔壳聚糖支架的制备 及表征[J]. 功能材料, 2004, (35): 2454–2456. |
| [8] | Freudenberg K. Lignin : Its constitution and formation from p-Hydroxycinnamyl alcohols : lignin is duplicated by dehydrogenation of these alcohols ;intermediates explain formation and structure[J]. Science, 1965, 148(3670): 595–600. |
| [9] | Terashima N, Atalla RH, Ralph SA, et al. New preparations of lignin polymer models under conditions that approximate cell wall lignification[J]. Holzforschung, 1996, (50): 521–527. |
| [10] | Seo SJ, Park IK, et al. Xyloglucan as a synthetic extracellular matrix for hepatocyte attachment[J]. Journal of Biomaterials Science, Polymer Edition, 2004, 15(11): 1375–1387. |
| [11] | Braun JR, Willnow TE, Ishibashi S, et al. The major subunit of the asialoglycoprotein receptor is expressed on the hepatocellular surface in mice lacking the minor receptor Subunit[J]. Journal of Biological Chemistry, 1996, 271(35): 21160–21166. |
| [12] | Sharon G, Burdick JA, Ferreira LS, et al. Hyaluronic acid hydrogel for controlled self-renewal and differentiation of human embryonic stem cells[J]. Proceedings of the National Academy of Sciences, 2007, 104(27): 11298–11303. |
| [13] | Li X, Pan X, Li X. Hydrogels Based on hemicellulose and lignin from lignocellulose biorefinery : a mini-review[J]. Journal of Biobased Materials and Bioenergy, 2010, 4(4): 289–297. |
| [14] | Matsuura T. Bioreactors for 3-dimensional high-density culture of human cells[J]. Human Cell, 2006, 19(1): 11–16. |
| [15] | Unger J, Catapano GN, Schroers A, et al. Comparative analysis of metabolism of medium- and plasma perfused primary pig hepatocytes cultured around a 3-D membrane network[J]. International Journal of Artificial Organs, 2000, 23(2): 104–110. |
| [16] | Mizumoto H, Hayakami M, Nakazawa K, et al. Formation of cylindrical multicellular aggregate(cylindroid)and expression of liver specific functions of primary rat hepatocytes[J]. Cytotechnology, 1999, 31(1-2): 69–75. |
| [17] | Wu FJ, Friend JR, Hsiao CC, et al. Efficient assembly of rat hepatocyte spheroids for tissue engineering applications[J]. Biotechnology and Bioengineering, 1996, 50(4): 404–415. |
| [18] | Aqvist J, Mowbray SL. Sugar recognition by a glucose/galactose receptor[J]. Journal of Biological Chemistry, 1995, 270(17): 9978–9981. |