2. 中国科学院大学,北京 100049;
3. 广 州市海怡康生物科技公司,广州 510301
2. University of Chinese Academy of Sciences,Beijing 100049;
3. Guangzhou Haiyikang Bio-tech Company,Guangzhou 510301
当前微藻作为淡水或者海洋水体中一种宝贵的生物资源,具有极为丰富的应用价值,受到国内外学者的广泛研究[1]。一方面微藻细胞内富含脂质,因而可将其提取而转化为生物柴油[2];另一方面,由于也富含各类生物活性物质,如蛋白质、生物多糖、不饱和脂肪酸等,在保健食品、医药健康、美容养颜方面显示出了巨大的开发利用前景[3]。近年来,国内外科研单位对优质的微藻已有多方面的研究和应用开发,如小球藻(Chlorella)[4]、绿球藻(Chlorococcum)[5]、栅藻(Scenedesmus)[6]等富油微藻因细胞内脂质含量丰富而具有生产油脂和生物柴油的潜力;螺旋藻(spirulina)[7]因富含蛋白质而在保健品行业中实现大规模培养开发;而拟微绿球藻(Nannochloropsis)[8]富含二十碳五烯酸(eicosapentaenoic acid,EPA)也受到了国内外研究人员的重视。因此在发展微藻相关产业的过程中,需确定藻种的特性,并根据市场需求,才可实现微藻的高值化开发。
Nannochloris sp.为绿藻门(Chlorophyta)、绿藻纲(Chlorophyceae)、绿球藻目(Chlorococcales)、胶球藻科(Coccomyxaceae)[9]。藻细胞壁薄,呈球形或卵圆形,细胞个体微小,直径 2-4 μm,含有一个卵圆形或杯状的叶绿体,一个细胞核及几个线粒体,无淀粉核或淀粉粒。研究表明,该属微藻在生物柴油[16]、微藻饵料[10]、环境保护[11]、生物医药[12]等方面具有不同程度的进展,因而对其研究备受国内外研究人员的关注。目前,国内对该属的研究较少,尚未见从生物活性物质资源的角度出发,对从我国海域分离纯化的Nannochloris sp.进行综合性的评估的研究报道。
然而,由于Nannochloropsis sp.(囊胞藻界、异鞭藻门、真眼点藻纲)拉丁属名与Nannochloris sp.相近,而且从形态学上观察,二者大小形状相似。当前国内所发表的文章中经常性的将这两个属的藻种弄混,许多研究将Nannochloris sp.与Nannochloropsis sp. 在中文的表达上均通称为微绿球藻。Nannochloris sp.在国内应表示为微绿球藻,而Nannochloropsis sp. 一般表示为微拟球藻或拟微绿球藻。一般情况下,Nannochloris sp.不含或者含有较少的长链不饱和脂肪酸,而Nannochloropsis sp.富含EPA。另外,可以通过分子鉴定直接鉴别两种微藻。
本研究对从南海海域筛选分离纯化的8株Nannochloris sp.微藻,展开生长及生化特性的评价,重点关注其细胞内所含的包括油脂、蛋白质、多糖、脂肪酸等各类生物活性物质,旨在筛选易培养、生长快、生物活性物质产量丰富的藻株,为该属微藻高值化综合性开发利用奠定物种资源和应用基础。
1 材料与方法 1.1 材料 1.1.1 藻种本实验藻种是从中国南海北部、东部、广西北海、东沙群岛近岸等水域水体中筛选分离纯化而来的藻株,并以经过18S rDNA测序,初步确定其分类地位,8株微藻均为Nannochloris sp.,藻种保存于中国科学院南海海洋研究所微藻课题组藻种库。
1.1.2 培养条件采用连续光照培养,培养体系为300 mL,并且每株藻分为3个平行同时培养,培养周期为12 d,光照强度为(100±5)μmol· m-2·s-1。培养基采用f /2 培养液,盐度控制(25±1)‰,使用前1212控制培养基的pH在7.8-8.8之间,并且每天定时摇晃培养体系6次。
f/2培养基成分为:0.5 g/L NaHCO3,0.1 g/L Na-NO3,0.01 g/L NaHPO4·2H2O,4.36 mg/L Na2EDTA,3.16 mg/L FeCl3.6H2O,0.01 mg/L CuSO4·5H2O,0.023 mg/L ZnSO4·7H2O,0.012 mg/L CoCl2·6H2O,0.18 mg/L MnCl·4H2O,0.07 mg/L Na2MoO4·2H2O。采用南海海域上层海水配制培养基。
1.2 方法 1.2.1 生长测定在微藻的培养周期内,每日使用光学显微镜镜检,观察微藻形态和生长状况,确保藻株正常生长其保持单种状态。隔天取藻液进行A750、pH及微藻干重(Dry Weight,DW)测定。
微藻干重测定[13]:取5-20 mL藻液,用烘干并已称重的混合纤维滤膜(Φ50 mm,0.45 μm)抽滤,重复用0.5 mol/L碳酸氢氨溶液冲洗藻细胞3次,再将带有藻细胞的滤膜置于烘箱中70℃烘干,直至恒重。从烘箱取出后放于干燥器中冷却后称重,通过计算滤膜过滤前后质量的差值得到藻细胞干重,单位为mg/L。每个处理组各平行3次。
比生长速率计算公式: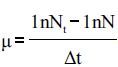
式中:μ为比生长速率(d-1);Nt为培养t天的A750;N为起始的A750;△t表示培养时间间隔。
1.2.2 总脂提取和测定采用改进的索氏提取法提取脂质并测定含量[14]。称取50 mg左右的干藻粉于研钵中,加入适量液氮后快速研磨,重复操作3次,转移至带有磁力转子的10 mL 塑料离心管中;加入2 mL 二甲基亚砜(DMSO)-甲醇(12O为1∶1的比例,加入去离子水,并于3 000 r/min离心1 min加速分层,吸取有机层至离心管中,使用氮吹仪吹干;最后用少量乙醚再溶转移至已称重的1.5 mL离心管中,使用氮吹仪吹干至恒重并称量。样品均重复试验3次。
1.2.3 总蛋白质的测定采用凯氏定氮法测定总蛋白含量。 对微藻样品进行消化处理,将有机氮转化为氨,通过盐酸滴定的方法,检测氨的含量,最后通过计算,以蛋白质的F值为6.25,得到样品蛋白质含量。样品均重复试验3次。
1.2.4 多糖的测定采用苯酚硫酸法测定多糖含量。称取20 mg左右的干藻粉进行快速研磨后放置在10 mL螺口玻璃离心管,并加入5 mL丙酮溶液进行脱色处理30 min,离心除去丙酮并晾干。往脱色藻粉中加入3 mL 0.5 mol/L硫酸并摇匀,与98℃水浴中搅拌2 h,5 000 r/min离心5 min后取上清于50 mL容量瓶中,用去离子水清洗藻渣并离心收集于容量瓶中,用水定容至50 mL混匀,取0.2 mL并加去离子水补至2 mL,后加入新配的6%苯酚溶液1 mL及浓硫酸5 mL,摇匀冷却至室温,放置20 min后于490 nm波长下测光密度,并根据葡萄糖标准曲线测得微藻多糖的含量。样品均重复试验3次。
1.2.5 脂肪酸提取和测定称取25 mg冻干藻粉,放置在10 mL螺口玻璃离心管中,再放置一小磁力棒,加入2 mL 2% H2SO4无水甲醇∶甲苯(9∶1 V/V),充满氮气后,再将玻璃离心管放置于80℃的水浴加热搅拌1.5 h,取出搅拌转子,按顺序分别加入1 mL的去离子水和1 mL正己烷,震荡后,3 000 r/min离心10 min,将上层有机相转移到另一小玻璃瓶,氮气吹干,再加入1 mL正己烷密封,加入无水硫酸钠干燥,并用孔径为0.22 μm的滤膜过滤,最后利用气相色谱质谱联用( Gas chromatography and mass select-detector,GC-MS)进行脂肪酸测定[15]。
1.2.6 数据统计和分析采用SPSS 13.0统计软件进行统计分析,数值变量资料以均数±标准差(x±s)表示,采用方差分析和t检验。检验水平α=0.05,P<0.05差异有统计学意义。使用Origin 8.1处理数据,并制作图表。
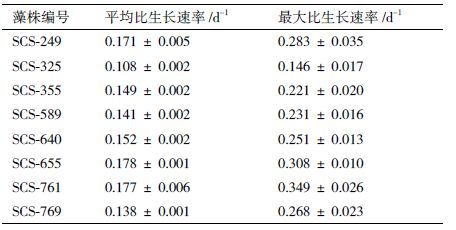
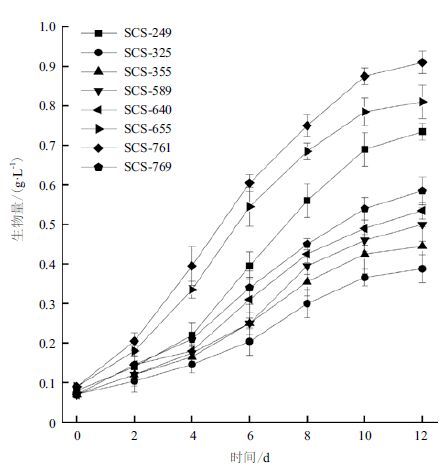
2 结果 2.1 8株微藻的生长特性在12 d的培养周期内,8株微藻的生长状态存在明显的差异,平均比生长速率为0.108-0.178 d-1。如图 1生长曲线所示,各株藻经过前2 d延滞期后进入指数生长期,并于培养4-6 d后达到最大生长速率,8株藻中,以SCS-655,SCS-761,SCS-769三株藻的生长速度较快,其最大比生长速率分别为0.283 ± 0.035 d-1、0.308 ± 0.010 d-1、0.349 ± 0.026 d-1。
|
| 图 1 8 株微藻的生长曲线 |
在培养期的最后一天,各个培养体系达到最大生物量,其干重结果如图 2所示,8株Nannochloris sp.微藻的最大干重生物量介于0.39-0.91 g/L,最高的为767号藻株,其生物量已超过0.9 g/L,而最低的SCS-325藻株仅为0.39 ± 0.04 g/L。
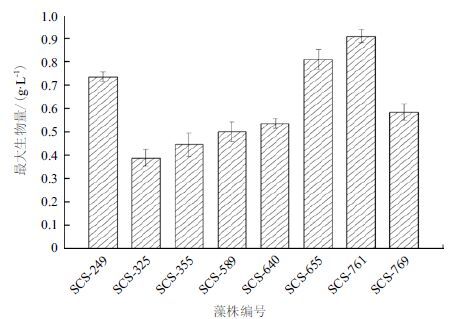
|
| 图 2 8 株微藻的最大生物量(第12 天干重) |
结合图 3所示结果,比较8株微藻的油脂含量和油脂产率,可以发现8株微藻的油脂含量及油脂产率差别较大,其中SCS-655藻株的油脂含量最高,为(32.93±1.05)%,而SCS-640藻株含量相对最低,为(18.34±1.02)%。本研究评估的8株Nannochl-oris微藻藻株中,油脂含量大于25% 的有3株,分别为SCS-249、SCS-589、SCS-655藻株。为了进一步评估微藻进行油脂和生物柴油开发的潜力,除了生物量或油脂含量等指标外,还引入油脂产率作为8株藻的评估指标。比较图 3中数据可以看出,SCS-249、SCS-655、SCS-761相对于其它微藻,油脂产率较高,超过15 mg/(L·d),其中 SCS-655藻株的油脂产率高达22.23 ± 0.71 mg/(L·d)。

|
| 图 3 8 株微藻的油脂含量与油脂产率 |
对培养12 d后的8株微藻的蛋白质含量进行提取测定(图 4),发现8株藻的蛋白质含量较高,其中,SCS-249、SCS-325、SCS-355、SCS-640、SCS-769藻株蛋白质含量超过30%,其中含量最高的是SCS-640藻株,蛋白质含量达(36.70±2.20)%。而含量最低的SCS-655藻株也达到(27.60±1.30)%。
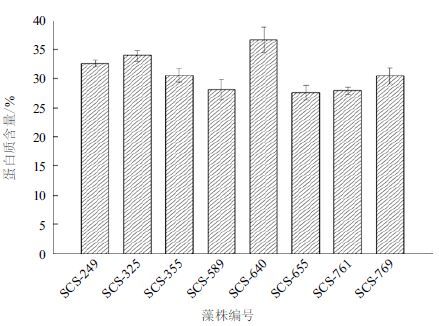
|
| 图 4 8 株微藻的蛋白质含量 |
图 5所示为各株藻的多糖含量,各株藻的多糖含量差异较大,含量介于(19.23-29.34)%之间,其中,最高的为SCS-769藻株,为(29.34±2.01)%,而最低的SCS-655藻株(19.23±0.65)%,前者高于后者52.57%。

|
| 图 5 8 株微藻的多糖含量 |
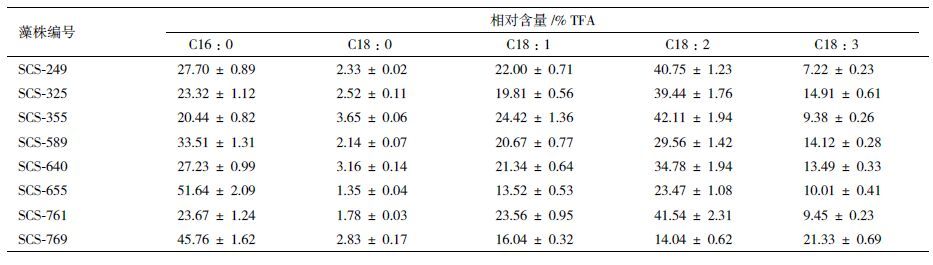
对8株微藻进行脂肪酸组成分析,结果为各类脂肪酸占总脂肪酸的百分比比较,如表 2所示,8株微藻的脂肪酸组成相似,组成结构较为简单,不存在C20及以上的长链脂肪酸。各株藻的饱和脂肪酸主要为C16∶0,并存在少量的C18∶0。不饱和脂肪酸均为C18系脂肪酸,而各株藻的多不饱和脂肪酸含量分别为47.97%(SCS-249),54.35%(SCS-325),51.49%(SCS-355),43.68%(SCS-589),48.27%(SCS-640),33.48%(SCS-655),50.99%(SCS-761),35.37%(SCS-769)。不饱和脂肪酸以亚油酸居多,其中SCS-249、SCS-355、SCS-761藻株亚油酸含量超过40%,分别为(40.75±1.23)%、(42.11±1.94)%、(41.54±2.31)%。
Nannochloris sp.作为海洋单细胞微藻重要的一属,在工业开发、饲料应用、医疗保健等方面均有重要的发展潜力和应用价值。有研究发现[11],Nannochloris sp.提取完油脂后的生物质可以作为生物吸附剂除去铬金属离子,这也表明该属微藻在治理重金属污染方面有重要作用。而在饲料应用方面,研究发现[10]将Nannochloris sp.作为水产饵料时,可以提高鱼虾的存活率和产率。另有研究[16]将微藻Nannochloris sp.的培养与厌氧消化协同作用,维持微藻生物量和沼气生产,实现光合作用所损失的碳的回收以及从厌氧消化中同化有机副产品,从而使C转化效率提高6.3%。而最新的一项研究[12]发现Nannochloris sp.在生物医学上具有特殊的功能作用。在光照条件下,可以与人视网膜色素上皮细胞、成纤维细胞、角质形成细胞、海拉细胞自发形成共生体,实现了人体细胞机能的增强。
通过从环境中直接筛选分离纯化藻株,是获得生物活性物质含量丰富,应用价值高,发展潜力大的微藻资源的一种便捷方式。本研究对从南海海域水体中筛选分离的8株Nannochloris sp.微藻进行生长及生理生化特性评估而对该属微藻的综合评价。经过12 d周期的培养,8株藻的最大生物量为0.39-0.91 g/L(图 2),这个结果与相关研究报道的Nannochloris sp.微藻在不同培养条件下的生长速率接近[17, 18],说明本研究中从南海筛选的Nannochloris sp.藻株具备良好的生长特性。
微藻细胞中,脂质、蛋白质、多糖是占干重最多的3种主要生化物质,这3类物质占微藻干重的80%左右,而不同的藻株三者的组成不同。据相关文献报道[17, 19],一般情况下Nannochloris sp.细胞内油脂含量介于15%-25%,而利用甘油兼养的条件下,达到27.55%[20]。而本研究其中,油脂含量大于25% 的有3株,其中SCS-655藻株油脂含量超过30%且油脂产率高达22.23 ± 0.71 mg/( L·d),这说明所筛选的藻株具有油脂和生物柴油的应用潜力。其次,8株微藻多糖含量为19.23%-29.34%(图 5),SCS-769藻株含量最高,为(29.34±2.01)%,研究表明通过培养基磷浓度的变化可以实现微藻脂质和多糖之间的转化[21]。而8株微藻中蛋白质含量超过30%的有5株,蛋白质含量最高的SCS-640藻株达(36.70±2.20)%,Nannochloris sp. 的蛋白质含量显著高于研究报道的其他属(Amphidinium carterae,Dunaliella tertiolecta,Hillea sp.,Isochrysis galbana,Skeletonema costatum)微藻[22]。以这3类物质为基础进行微藻工业开发,在生物能源、微藻饵料、单细胞蛋白等方面均有巨大的应用潜力。这表明Nannochloris sp.微藻富含较高的生物活性物质资源,值得对该属微藻进行更多的研究和应用发掘。
另外,对微藻的脂肪酸测定结果(表 2)发现,8株微藻脂肪酸构成简单,而且均不存在C20及以上的长链脂肪酸,这与国外相关研究存在差异,Bae等[23]研究中所选的Nannochloris sp.藻株EPA和DHA总量占总脂肪酸的6.28%。而8株藻中饱和脂肪酸主要以C16∶0存在,不饱和脂肪酸中,以亚油酸(C16∶3)的比例较高,SCS-249、SCS-355、SCS-761藻株亚油酸含量超过40%,亚油酸是人体的必需脂肪酸,在降低血液胆固醇等方面有重要作用,具有巨大的营养价值,因此亚油酸可以作为Nannochloris sp.的高值化加工产品进行开发。
4 结论本研究测量并分析了8株Nannochloris sp.微藻的生长速度、油脂、蛋白质、多糖含量及脂肪酸的组成等多个指标,对8株微藻进行生物活性物质资源评估。结果显示,8株Nannochloris sp.微藻含有丰富的蛋白质、油脂、多糖、亚油酸等多种生物活性物质资源,其中SCS-249、SCS-655、SCS-761藻株生长速度较快、多种生物活性物质的产率较高,具有良好的应用开发前景。
| [1] | Spolaore P, Joannis-Cassan C, Duran E, Isambert A. Commercial applications of microalgae[J]. J Biosci Bioeng, 2006, 101(2): 87–96. |
| [2] | Gong Y, Jiang M. Biodiesel production with microalgae as feedstock :from strains to biodiesel[J]. Biotechnol Lett, 2011, 33(7): 1269–1284. |
| [3] | Borowitzka MA. High-value products from microalgae—their development and commercialisation[J]. Journal of Applied Phycology, 2013, 25(3): 743–756. |
| [4] | Hadiyanto HMM. Azimatun Nur, Hartanto GD[J]. Int Journal of Renewable Energy Development, 2012, (2): 45–59. |
| [5] | Karemore A, Pal R, Sen R. Strategic enhancement of algal biomass and lipid in Chlorococcum infusionum as bioenergy feedstock[J]. Algal Research, 2013, 2(2): 113–121. |
| [6] | Makarevičienė V, Andrulevičiūtė V, Skorupskaitč V, Kasperovi?ien? J. Cultivation of microalgae Chlorella sp[J]. Environmental Research, 2011, 3(57): 21–27. |
| [7] | Govindaraju K, Basha SK, Kumar VG, Singaravelu G. Silver, gold and bimetallic nanoparticles production using single-cell protein(Spirulina platensis)Geitler[J]. Journal of Materials Science, 2008, 43(15): 5115–5122. |
| [8] | Recht L, Zarka A, Boussiba S. Patterns of carbohydrate and fatty acid changes under nitrogen starvation in the microalgae Haematococcus pluvialis and Nannochloropsis sp[J]. Appl Microbiol Biotechnol, 2012, 94(6): 1495–1503. |
| [9] | Guiry MD, Guiry GM. AlgaeBase. Worldwide electronic publication, National University of Ireland, Galway[Electronic resource]. http://www. algaebase. org, 2013. |
| [10] | Witt U, Koske PH, Kuhlmann D, et al. Production of Nannochloris spec[J]. Aquaculture, 1981, 23: 171–181. |
| [11] | Kim EJ, Park S, Hong HJ, et al. Biosorption of chromium(C(r III)/Cr (VI))on the residual microalga Nannochloris oculata after lipid extraction for biodiesel production[J]. Bioresour Technol, 2011, 102(24): 11155–11160. |
| [12] | Black CK, Mihai DM, Washington I. The photosynthetic eukaryote Nannochloris eukaryotum as an intracellular machine to control and expand functionality of human cells[J]. Nano Lett, 2014, 14(5): 2720–2725. |
| [13] | Zhu CJ, Lee YKL, Determination of biomass dry weight of marine microalgae[J]. Journal of Applied Phycology, 1997,(9):189-194[J]. Journal of Applied Phycology, 1997, (9): 189–194. |
| [14] | Yang F, Xiang W, Sun X, et al. A novel lipid extraction method from wet microalga Picochlorum sp[J]. Marine Drugs, 2014, 12(3): 1258–1270. |
| [15] | 何瑞, 徐宁, 段舜山. 九种海洋微藻总脂含量及脂肪酸组成分 析[J]. 生态科学, 2014, 33(1): 93–98. |
| [16] | Vasseur C, Bougaran G, Garnier M, et al. Carbon conversion efficiency and population dynamics of a marine algae-bacteria consortium growing on simplified synthetic digestate :first step in a bioprocess coupling algal production and anaerobic digestion[J]. Bioresour Technol, 2012, 119: 79–87. |
| [17] | Park SJ, Choi YE, Kim EJ, et al. Serial optimization of biomass production using microalga Nannochloris oculata and corresponding lipid biosynthesis[J]. Bioprocess Biosyst Eng, 2012, (35): 3–9. |
| [18] | Yesica IFA, Luis AOC, Ignacio APL, et al. Growth of Chlorella vulgaris and Nannochloris oculata in effluents of Tilapia farming for the production of fatty acids with potential in biofuels[J]. African Journal of Biotechnology, 2015, 14(20): 1710–1717. |
| [19] | Levine RB, Sierra COS, Hockstad R, et al. The use of hydrothermal carbonization to recycle nutrients in algal biofuel production[J]. Environmental Progress & Sustainable Energy, 2013, 32(4): 962–975. |
| [20] | Andruleviciute V, Makareviciene V, Skorupskaite V, Gumbyte M. Biomass and oil content of Chlorella sp[J]. Journal of Applied Phycology, 2013, 26(1): 83–90. |
| [21] | Liang K, Zhang Q, Gu M, Cong W. Effect of phosphorus on lipid accumulation in freshwater microalga Chlorella sp[J]. Journal of Applied Phycology, 2012, 25(1): 311–318. |
| [22] | Barbarino E, Louren?o SO. An evaluation of methods for extraction and quantification of protein from marine macro- and microalgae[J]. Journal of Applied Phycology, 2005, 17(5): 447–460. |
| [23] | Bae JH, Hur SB. Selection of Suitable Species of Chlorella, Nannochloris, and Nannochloropsis in High- and Low-Temperature Seasons for Mass Culture of the Rotifer Brachionus plicatilis[J]. Fisheries and aquatic sciences, 2011, 14(4): 323–332. |