2. 南方医科大学生物治疗研究所,广州 510515
2. Institute of Biotherapy of Southern Medical University,Guangzhou 510515
糖尿病是一种全身性慢性疾病,病因复杂,并发症多,治愈率低,成为国际医学的一大难题,被世界卫生组织称为不死的癌症。胰岛素是治疗糖尿病最基础、最有效的药物,也是FDA批准的第一个用于人类的基因重组药物。目前,胰岛素作为重组蛋白产品,主要有两条途径获得。一条途径是在大肠杆菌中表达胰岛素前体的包涵体,通过溶解和复性等过程获得胰岛素;另外一条途径是通过酵母表达系统,分泌表达可溶性的胰岛素前体进入培养液[1]。
毕赤酵母(Pichia pastoris)表达系统许多优点,例如,可对表达的蛋白进行翻译后加工与修饰、具有强的可控的醇氧化酶基因强启动子、表达载体是整合在染色体上、糖基化程度低使其所分泌的糖蛋白的免疫原性较低利于临床应用等。目前,在毕赤酵母中已有许多基因成功的实现了高效表达,如破伤风毒素基因在毕赤酵母中表达后,其产量达12 g/L[2];而来源于人的人血清蛋白基因经表达后,其产量达10 g/L[3]。然而仍有些蛋白的表达水平较低,甚至表达出来没有活性。因此,我们还需进一步研究提高外源蛋白在其体内的表达。
近年来,也有很多学者研究利用毕赤酵母来分泌表达胰岛素的基因,然而由于该基因自身的一些特点,多数研究表达胰岛素的量均较低。现在已有一些研究通过优化表达核的启动子、拷贝数、对宿主菌进行改良、优化培养条件等方法来提高胰岛素的表达量[4]。尽管这些方法可以在一定程度上提高其表达量,但是现有的文献报到,其表达量较低。早在1996年,Kjeldsen等[5, 6]在酿酒酵母中表达完整的人胰岛素原cDNA基因时,发现胰岛素原蛋白大部分累积在胞内而不能分泌到胞外,而将编码胰岛素原cDNA分子中的β链中的第30位氨基酸去除,并接上短的C肽链,且与酿酒酵母的α交配因子前导肽相融合,则可以有效的提高单链胰岛素原的分泌表达量。在此基础上,Kjeldsen等[7, 8]也在毕赤酵母中成功的表达胰岛素原基因,且在前导肽与外源蛋白之间引入一段间隔肽——EEAEAEAEPK,这样在前导肽的引导下,表达的胰岛素原可以正确的折叠,形成正确的二硫键以及提高其分泌表达量。刘海峰等[9]利用毕赤酵母表达人胰岛素原基因时,在胰岛素原基因的N末端引入同样的一段间隔肽——EEAEAEAEPK,发现虽然其可以提高目的蛋白的表达量,但间隔肽中多个酶切位点造成胰岛素原蛋白N末端的不均一性。利用间隔肽还可促进其它的基因如S-腺苷甲硫氨酸合成酶基因[10]和植酸酶基因[11]等在毕赤酵母中的分泌表达。
胰岛素工程菌的表达量一直是困扰胰岛素制备的一个难题,本研究结合前人研究的基础,重新设计胰岛素酵母表达的方式。采用pPICZαA载体,在分泌信号肽和胰岛素原之间引入一段间隔肽,构建载体转化酵母受体菌GS115,利用zeocin抗性筛选高拷贝重组子,表达验证来获得高表达胰岛素的酵母工程菌种。
1 材料与方法 1.1 材料 1.1.1 菌株与载体大肠杆菌(Escherichia coli)TOP10 感受态细胞购自天根生化科技(北京)有限公司,毕赤酵母菌株GS115由本实验室保存;大肠杆菌-毕赤酵母穿梭质粒载体pPICZα-A由本实验室保存。
1.1.2 试剂T4 DNA连接酶、限制性内切酶(Xho Ⅰ和NotⅠ)、PfuDNA聚合酶、dNTP及DNA Maker(DL2000)均购自大连TaKaRa公司;博来霉素(Zeocin)购自Invitrogen公司,胰蛋白胨(Trypsin)和酵母提取物(Yeast extract),英国Oxoid公司;质粒抽提试剂盒和胶回收试剂盒购自美国Omega公司其他化学试剂均为国产分析纯,购自北京化学试剂公司。
1.1.3 培养基(1)LB培养基:1.0%胰蛋白胨,0.5%酵母提取物,1.0% NaCl,调节pH值至7.0(固体培养基含1.5%琼脂)。(2)YPG培养基:2.0%胰蛋白胨,1%酵母提取物,2%甘油(固体培养基含1.5%琼脂)。(3)完全培养基YPD:2.0%胰蛋白胨,1%酵母提取物,2%葡萄糖。(4)诱导表达培养基BMGY:2.0%胰蛋白胨,1%酵母提取物,1.34%YNB,2%甘油,10 mmol/L磷酸钾(pH6.0)、生物素4×10-5 %(无菌过滤加入)。(5)诱导表达培养基BMMY:2.0%胰蛋白胨,1%酵母提取物,1.34%YNB,0.5%甲醇,10 mmol/L磷酸钾(pH6.0)、生物素4×10-5 %(无菌过滤加入)。
1.2 方法 1.2.1 胰岛素原的cDNA序列的合成及酵母表达重组载体的构建在参阅文献以及前期相关研究的基础之上,充分考虑到目的蛋白的分泌表达、酶切、纯化回收等各个环节,确定其引导肽的序列为EEAEAEAKR,根据Codon Usage database(http://www.kazusa.or.jp/codon/)P. Pastoris密码子使用偏好性数据,设计甘精胰岛素原类似物核苷酸序列,在序列后面设计两个TAA终止密码子序列,并在序列5'端和3'端分别设计Xho I(CTCGAG)和Not I(GCGGCCGC)限制性酶切位点。具体序列为”CTCGAGAAGAGAGAAGAAGCTGAAGCTGAAGCTAAGAGATTCGTCAACCAGCACTTGTGCGGTTCTCACTTGGTTGAGGCCTTGTACTTGGTCTGTGGTGAGCGTGGTTTCTTCTACACCCCAAAGACCAGACGTGGTATCGTTGAGCAGTGTTGCACCTCCATCTGCTCCTTGTACCAGTTGGAGAACTACTGTGGTTAATAAGCGGCCGC”。
委托生金维智生物科技有限公司对本公司设计完整的cDNA序列进行全基因合成,并将上述全基因合成的cDNA插入PUC57质粒,构建重组质粒PUC- Pro-INS。用限制性内切酶Xho I和Not I酶切,利用质粒胶回收试剂盒回收目的基因片段并保存。然后将目的基因连入表达载体pPICZα-A。
1.2.2 重组酵母菌株的转化和诱导表达 1.2.2.1 毕赤酵母感受态细胞的制备挑取毕赤酵母GS115单菌落接种到装有5 mL YPD培养基的50 mL三角瓶中,30600=1.2-2.0收菌。 将50 mL菌液移入离心管,4℃,1 600×g离心5 min,无菌彻底去掉上清。 用10 mL 1mol/L D-Sorbitol悬浮菌体,4℃,1 600×g离心5 min,无菌去掉上清。用10 mL1mol/L D-Sorbitol悬浮菌体,4℃,1 600×g离心5 min,反复5次。用1 000 μL 1 mol/L D-Sorbitol悬浮菌体,冰水浴备用。
1.2.2.2 毕赤酵母的电转化取80 μL酵母感受态细胞菌液至预冷的0.2 cm电转杯中,加入线性化的质粒20 μL浓缩质粒混匀,置冰上5 min(或-20℃放置1 min)。将电转杯放入电转仪中电转(电压2.0 kV,电击时间5 ms)。立即加入1 mL预冷无菌 1 mol/L的D-Sorbitol,静止60 min。取200 μL菌液涂布MD板,平放30℃烘箱20-60 min,再倒放培养3-5 d。
1.2.2.3 筛选毕赤酵母多拷贝重组子用无菌牙签随机挑取在YPG-Zeocin平板上生长较快的微量毕赤酵母重组子到含不同Zeocin浓度(300 μg/mL、600 μg/mL)的固体平板上,同一重组子在不同Zeocin浓度的固体平板上编相同的号码。根据整合的外源基因的拷贝数与Zeocin抗性大小之间的计量依赖关系,可推断仅在低浓度Zeocin平板上长出来的细胞为低拷贝重组子,在高浓度Zeocin平板上长出来的细胞为高拷贝重组子。恒温箱设置为30℃,静置培养3-5 d。每日检查不同Zeocin浓度平板出现的菌落。
1.2.2.4 毕赤酵母重组子的诱导表达摇瓶筛选分别在含100 μg/mL、300 μg/mL、600 μg/mL Zeocin的YPD平板上挑取不同拷贝数的重组子菌落,接种于100 mL BMGY培养液的1 000 mL摇瓶中,30600为2-6时,无菌条件下更换等体积的BMMY培养液进行诱导,28℃继续培养120 h,每隔24 h补加终浓度为0.5%的甲醇。诱导结束离心后,上清液用三氯乙酸(Trichloroacetic acid,TCA)沉淀。配制试剂液50%的TCA加入0.2%的去氧胆酸钠,取25%的试剂液与75%的培养基离心上清液(体积比)混合均匀,在冰块上放置30 min。离心(4℃,20 000×g,20 min),倒去上清液,用10%的TCA悬浮,离心(条件同上)。倒去上清液,用冷丙酮(-20℃)再悬浮,离心(条件同上)。用吹风机吹干沉淀,用SDS buffer溶解浓缩进行电泳或HPLC检测。
2 结果 2.1 酵母阳性转化子的筛选将转化有胰岛素表达核的重组毕赤酵母,分别点在含100 μg/mL、300 μg/mL、600 μg/mL Zeocin的YPD平板上进行培养,来筛选整合有高拷贝表达核的重组子,平板结果见图 1。从图 1可以明显发现,有些酵母的基因组中可能整合了多个拷贝的基因表达核,可能会高效表达胰岛素的基因。

|
| 图 1 转化子抗性平板筛选的结果 A :300 μg/mL Zeocin 筛选平板;B :600 μg/mL Zeocin 筛选平板 |
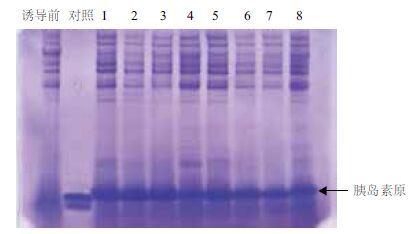
挑选整合有高拷贝的8株转化子,进行摇瓶诱导表达培养,并检测其表达胰岛素的量,蛋白质电泳结果见图 2。从图 2中可以发现胰岛素可以被高效诱导分泌表达到胞外,重组蛋白的表达水平最高可以达到到300 mg/L,占分泌总蛋白的40%左右。文献报道[12]没有加前导肽的毕赤酵母转化子中,胰岛素获得的最高分泌表达量仅为32 mg/L。在胰导素前体的N端加上前导肽后,可以提高其表达量约为10倍。
|
| 图 2 蛋白质电泳结果 1-8 :高拷贝重组子 |
将表达的胰岛素前体从SDS-PAGE电泳中切下后进行色谱纯化,从色谱图(图 3)中可以发现该蛋白出峰的保留时间约为14.9 min,纯度为100%。将获得的重组胰岛素前体进行质谱测定其分子量为7.08 kD,与其理论分子量7.08 kD基本一致,该结果初步表明表达的重组蛋白质为胰岛素前体。在此基础上,对目标条带进行一级质谱检测(图 4),选取信号强度较好的两个肽段进行二级质谱,并搜索Mascot 数据库,分析表明检测的蛋白质为胰岛素前体中的蛋白质片段,从而证明胰岛素原在毕赤酵母中成功实现表达。

|
| 图 3 回收样品HPLC 色谱图 |

|
| 图 4 质谱检测结果 |
利用基因重组技术在体外大量制备活性多肽是目前生物制品研究的热点之一。对于许多分子较小的多肽,如果用常规方法构建单拷贝基因的重组质粒,则目的基因在细胞中的表达量很低,无法体现基因工程产量高的优势,其原因是表达产物的分子太小,在细胞中不稳定,容易被宿主蛋白酶降解。因此,建立一套适合小分子肽表达的体系,以实现小分子多肽在体外的高效表达极为重要。
毕赤酵母作为目前应用最成功的一种外源基因真核表达系统,可以高效分泌表达外源基因,然而许多基因由于基因自身的性质,很难在该表达系统中得到高效表达,其中胰岛素就是其中的一个例子。有研究通过提高胰岛素基因表达核的拷贝数,优化发酵条件、启动子等方法可以提高其分泌表达量,但是其表达量依然很低。本研究发现在其N端融合一种前导肽,可以提高其分泌表达量,也再次表明,蛋白质N端的序列和其在毕赤酵母中的分泌表达密切相关。但到目前为止,仍还不清楚为什么这段前导肽能大幅度提高胰岛素前体表达量的原因。另外关于其应用的普遍性也需要进一步的研究。
优化发酵条件,提高酵母的产量,实现目的多肽的高表达。用发酵罐高密度培养能大量提高表达量。这是因为在发酵罐中,溶解氧水平、通气量、PH搅拌速度、营养补给等方面更容易得到优化,有机体能高密度生长,也可获得目标产物更高效的表达。分泌表达可稳定表达产物,减少蛋白水解酶作用。对已经筛选出来的菌株,通过优化发酵条件可进一步提高分泌表达量。
4 结论本研究构建了pPICZα-A-Pro-INS重组载体;将表达载体转化毕赤酵母GSll5,利用Zeocin抗生素筛选高抗重组菌株;重组子甲醇诱导表达筛选获得高表达菌种,基本上与其Zeocin浓度呈正相关,蛋白的表达水平最高可达300 mg/L,占分泌总蛋白的40%左右;获得的重组胰岛素前体分子量为7.08 kD,与其理论分子量一致。
| [1] | Baeshen NA, Baeshen MN, Sheikh A, et al. Cell factories for insulin production[J]. Microb Cell Fact, 2014, 13: 141. |
| [2] | Clare JJ, Rayment FB, Ballantine SP, et al. High-level expressionof tetanus toxin fragment C in Pichia pastoris strains containing multiple tandem integrations of the gene[J]. Biotechnology(N Y), 1991, 9: 455–460. |
| [3] | 崔蕴霞, 明文玉, 银巍, 等. 人重组白蛋白基因在巴斯德毕赤 酵母中的高效表达[J]. 微生物学报, 2001, 41(2): 244–247. |
| [4] | 马银鹏, 王玉文, 党阿丽, 等. 毕赤酵母表达系统研究进展[J]. 黑龙江科学, 2013, 9: 27–31. |
| [5] | Kjeldsen T, Brandt J, Andersen AS, et al. A removable spacer peptide in an alpha-factor-leader/insulin precursor fusion protein improves processing and concomitant yield of the insulin precursor in Saccharomyces cerevisiae[J]. Gene, 1996, 170: 107–112. |
| [6] | Kjeldsen T, Hach M, Balschmidt P, et al. Prepro-leaders lacking N-linked glycosylation for secretory expression in the yeast Saccharomyces cerevisiae[J]. Protein Expr Purif, 1998, 14: 309–316. |
| [7] | Kjeldsen T, Pettersson AF, Hach M. Secretory expression and characterization of insulin in Pichia pastoris[J]. Biotechnol Appl Biochem, 1999, 29(Pt 1): 79–86. |
| [8] | Kjeldsen T. Yeast secretory expression of insulin precursors[J]. Appl Microbiol Biotechnol, 2000, 54: 277–286. |
| [9] | 刘海峰, 周祥山, 庞甲佩, 等. 毕赤酵母表达人胰岛素前体的 纯化和N 末端不均一性分析[J]. 华东理工大学学报:自然 科学版, 2013, 39(5): 565–571. |
| [10] | 秦秀林, 钱江潮, 储炬. 利用间隔肽促进S- 腺苷甲硫氨酸合 成酶在毕赤酵母中的分泌表达[J]. 生物技术通报, 2013, (6): 140–146. |
| [11] | 熊爱生, 彭日荷, 李贤, 等. 信号肽序列对毕赤酵母表达外源 蛋白质的影响[J]. 生物化学与生物物理学报, 2003, 35(2): 154–160. |
| [12] | 何尧声. 重组人胰岛素在毕赤酵母中的分泌表达[D]. 海口: 海南大学, 2008. |



