蛋白质翻译后修饰(post translation modification,PTM)是目前蛋白研究中比较受欢迎的一个重要研究方向,其中磷酸化修饰在生物体中是一种最普遍最重要的调控方式,几乎调节着生命活动的整个过程,包括细胞的增殖、凋亡和分化、信号转导、基因表达、细胞周期以及其他生命活动过程[1-3]。据统计,哺乳动物细胞内有1/3以上的蛋白质被磷酸化修饰[4]。真核生物中磷酸化主要发生在丝氨酸、苏氨酸和酪氨酸等残基,其比例大概为1 800∶200∶1[5]。大多数磷酸化的蛋白质有一个以上的磷酸化位点,并且生物体内磷酸化修饰是一个动态过程,同一种蛋白在不同的时间和空间时刻发生着磷酸化与去磷酸化的交替活动。因此,生物体内磷酸化修饰的蛋白质的鉴定和定量分析对更好的了解许多生命活动的发生发展有重要的意义[6]。
同源异型框基因广泛存在于真核生物中,其结构中含有一个高度保守的同源异型盒,编码一段含有60个氨基酸残基的蛋白结构域,称为同源异型结构域。作为一类重要的转录调控因子,在胚胎发育中对组织和器官的形成具有重要的调控作用。核磁共振及晶体学的研究表明,同源异型结构域可形成螺旋—转折—螺旋结构,它可与DNA特异性结合。同源异型结构蛋白(homeodomain protein)作为转录因子通过与靶基因调控序列相结合来调控靶基因的转录。有些同源异型结构域蛋白之间具有协同作用,其不同组合方式可影响其活性[7]。
Msx1作为哺乳动物中典型的同源异型框基因在胚胎发育过程的多种组织和器官中表达,包括四肢、颅面的衍生物、神经管和乳腺等[8-11],对早期胚胎发育起到重要的调控作用。Msx1基因敲除小鼠显示颅面发育缺陷,包括腭裂、牙齿畸形、颅骨和鼻骨发育缺陷[12],以及间脑发育缺陷[13]。Msx1基因的过量表达同样会导致细胞分化的缺陷,Msx1转基因小鼠出现乳腺增生[14]。Msx1基因突变则造成人类牙齿和骨骼等发育异常以及人类遗传相关疾病(出生缺陷)如唇/腭裂、Witkop综合症以及缺牙症[15]。发育过程中Msx1作为转录因子通过调控其靶标基因来介导上皮细胞和间质细胞之间的信号传导,负向调控细胞分化[16-19]。Msx1只在未分化的前体细胞中表达,抑制前体细胞的终端分化[19, 20]。前期研究表明,在肢体发育中Msx1的抑制性靶标基因主要分布在细胞核核周,而活化性靶标基因则均匀分布在细胞核内。在胚胎发育中Msx1和PRC2复合物(Ezh2复合物)在肢体(limb bud)和神经管(neural tube)高表达,但是Msx1只富集在肢体细胞核核周并招募PRC2复合物到细胞核核周[21],重新分布组蛋白标记物H3K27me3到细胞核核周,最终发挥转录抑制作用[21]。同时还发现,Msx1招募甲基化转移酶G9a到其靶标基因并产生抑制性标记H3K9me2,抑制肌肉细胞分化[22]。经研究发现,Msx1和一系列转录因子如Ezh2、G9a、PIAS1等形成蛋白复合物,发挥生物学作用[19, 21, 22]。
Msx1的翻译后修饰可能对Msx1在发育中的生物功能起着重要的调控作用。本研究以同源异性框蛋白Msx1的翻译后修饰为切入点,利用生物信息学和生物质谱学对其进行分析,发现两个新的磷酸化修饰位点,为进一步研究Msx1的生物学功能以及磷酸化修饰的动态调控在细胞分化过程中的作用奠定了良好的基础。
1 材料与方法 1.1 材料 1.1.1 试剂高保真聚合酶,T4连接酶,Xho I、BamH I限制性内切酶,dNTP等(TaKaRa),甲醇、无水乙醇、氯化钠等生化试剂(国药),10 cm培养皿、6孔细胞培养板购自上海WHB公司,DMEM培养基,胎牛血清(FBS)、胰酶/EDTA、Opti-MEM、Lipofectamine2000购自Life公司。序列级胰蛋白酶(trypsin)购于德国Boehringer Mannheim GmbH公司,乙腈为美国Fisher Scientific公司产品,三氟乙酸(TAF)为Merk公司产品。所用水为Mili-Q水。
1.1.2 质粒和细胞系pcDNA3-Flag-Msx1,pLERS-IRES-GFP-Flag-Msx1[17 ,18],pcDNA3表达质粒用来做瞬时转染,pLERS-IRES-GFP用来生产逆转录病毒。C2C12细胞和PhE细胞来源于ATCC。
1.1.3 引物Msx1(S152A)-F:5'-TGG ATG CAG AGT CCC CGC TTC GCC CCG CCC CCA GCC AGA CGG CTG-3';Msx1(S152A)-R:5'-CAG CCG TCT GGC TGG GGG CGG GGC GAA GCG GGG ACT CTG CAT CCA-3';Msx1(S160A)-F:5'-CCG CCC CCA GCC AGA CGG CTG GCT CCC CCA GCA TGC ACC CTA CGC-3';Msx1(S160A)-R:5'-GCG TAG GGT GCA TGC TGG GGG AGC CAG CCG TCT GGC TGG GGG CGG-3'。
1.2 方法 1.2.1 突变体质粒的构建以pcDNA3-Flag-Msx1质粒为模板,用Primer Premier 5软件进行引物设计,PCR扩增F-Flag-Msx1(S152A)和R-Flag-Msx1(S152A)片段;F-Flag-Msx1(S160A)和R-Flag-Msx1(S152A)片段。引物由苏州金唯智公司合成,序列如上。PCR的参数设置为:98℃,预变性30 s;98℃变性10 s,58℃退火15 s,72℃延伸1 min,35个循环;72℃延伸5 min。胶回收F端PCR产物;同样程序进行PCR,胶回收R端PCR产物;以F端和R端PCR产物为模板,SP6和T7为引物进行PCR,最后胶回收PCR产物,用BamH I和Xho I分别酶切PCR扩增产物和pcDNA3载体。回收DNA片段,并用T4连接酶16℃连接过夜。连接产物转化大肠杆菌DH5α,在氨苄青霉素(终浓度50 μg/mL)的LB平板中培养过夜后,挑选菌落抽提质粒进行酶切和测序鉴定。
1.2.2 细胞培养C2C12细胞在DMEM培养基(含10% FBS)中,372细胞培养箱中培养,细胞生长接近75%时,0.05%胰酶消化,吹散并加新鲜培养基传代。
1.2.3 构建Msx1过表达的C2C12细胞(1)按照15%-25%密度接种PhE 细胞于10 cm细胞培养板中,培养过夜。(2)将12 μg质粒DNA稀释于0.8 mL Opti-MEM中,混匀,室温放置5 min;另将30 μL Lipofectamine2000稀释于0.8 mL Opti-MEM中,混匀,室温放置5 min。(3)将Lipofectamine2000稀释液滴入DNA 稀释液中,混匀,室温放置20-30 min。(4)吸去PhE 细胞的培养液,补入6.4 mL Opti-MEM。(5)将Lipofectamine2000与DNA 混合液轻柔混匀,缓慢逐滴加入PhE 细胞上,轻柔晃匀。(6)372细胞培养箱培养4-6 h,将转染后细胞上清吸弃,1×PBS洗一遍,补入10 mL 新鲜DMEM(含10%胎牛血清)。(7)372培养24 h,检测转染效率。换成含有puromycin的DMEM进行筛选2 d。(8)第3天,吸去PhE 细胞的培养液,并用1×PBS洗一遍,补入10 mL 新鲜DMEM(含10%胎牛血清)。同时按照5%-10%细胞密度接种C2C12细胞于10 cm 细胞培养板中,培养过夜。(9)第4天,用荧光显微镜观察细胞,荧光效率几乎达到100%,将PhE中的病毒用0.45 μm的滤头过滤到50 mL离心管中,加入2 mL新鲜DMEM,并加入 12 μL Polybrane(8 mg/mL),终浓度为8 μg/mL,混合均匀。吸掉C2C12细胞的培养基,将上述混合好的病毒液缓缓加入C2C12细胞中。(10)372培养24 h,观察感染效率,并重复前一天操作过程。(11)372培养,等细胞长到90%左右收集细胞用于后期实验。
1.2.4 免疫沉淀用预冷的PBS洗涤细胞两次,最后一次吸干PBS,加入适量含蛋白酶抑制剂的细胞裂解缓冲液(1×RIPA buffer,Protease inhibitor cocktail),冰上裂解30 min,细胞裂解液于4℃,最大转速离心10 min后取上清;取少量裂解液以备Western blot分析。分别取2 mL protein A 琼脂糖珠和2 mL Flag Bead(Sigma A-2220),用适量裂解缓冲液洗3 次,每次800×g离心3 min;将预处理过的40 μL protein A琼脂糖珠(Sigma)加入到剩余裂解液中,4℃缓慢摇晃1 h,在4℃ 以800×g 速度离心3 min,将上清转移到新的EP管中,加入60 μL预处理过的Flag Bead(Sigma A-2220),4℃缓慢摇晃孵育4 h。免疫沉淀反应后,在4℃ 以800×g 速度离心3 min,将琼脂糖珠离心至管底,将上清小心吸去,琼脂糖珠用1 mL裂解缓冲液洗3-4次;最后根据蛋白浓度加入相应体积的2×SDS 上样缓冲液,沸水煮5 min;SDS-PAGE,Western blotting。
1.2.5 质谱将位于33 kD处的蛋白染色条带切下,在脱色缓冲液(25 mmol/L NH4HCO3,50%(V/V)乙腈)中脱色直至蓝色消失将脱色后的凝胶条带在2%(W/V)二硫苏糖醇溶液中还原30 min,再加到2.5%(W/V)碘乙酰胺溶液中反应60 min,使游离的巯基全部烷基化将胶条用乙腈脱水后,加入新配制的测序级的胰蛋白酶的50 mmol/L NH4HCO3溶液,在374HCO3溶液从胶条中反复抽提3次合并3次抽提液,并与初始的上清液混合,即得到蛋白的酶解多肽混合物,冻干后20℃保存。所有干燥的多肽样品均溶解在缓冲液A(0.1%甲酸99%水+1%乙腈+0.1%甲酸)中,再经C18反相毛细管色谱柱(100 mm×0.17 mm)分离以0.1%甲酸和乙腈为流动相进行梯度洗脱,洗脱梯度为5%-40%缓冲液B(B:99%乙腈+1%水+0.1%甲酸),洗脱时间为180 min,流速为0.25 μL/min,经毛细管反相色谱洗脱出的多肽应用LTQ Orbitrap质谱分析,质核比检测范围为400-2 000 amu应用数据依赖方式进行二级质谱扫描,每个全扫描后进行5个二级扫描,碰撞能量为35%,动态排除时间为2 min。
1.2.6 磷酸化抗体的制备将合成的单磷酸化多肽1(C-QSPRFpSPPPAR-NH2)、非磷酸化多肽1(C-QSPRFSPPPAR-NH2)、单磷酸化多肽2(C-PARRLpSPPAC-NH2)、非磷酸化多肽2(C-PARRLSPPAC-NH2)分别注射兔子,并且分别使用单磷酸化多肽及非磷酸化多肽制备亲和纯化柱,对磷酸化特异性抗体进行纯化,制备针对两个位点的特异性抗体。
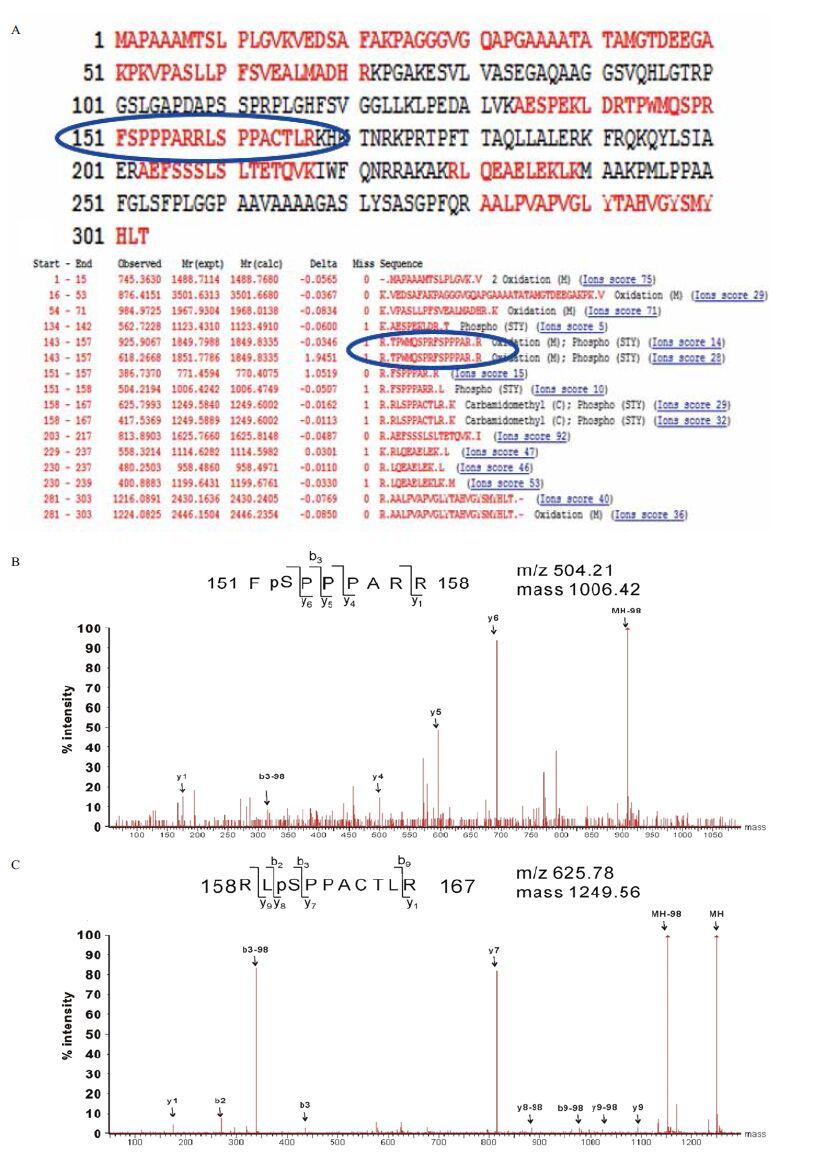
2 结果 2.1 Msx1磷酸化位点的生物信息学预测鉴于同源异型框蛋白Msx1在生物体发生和发展中起着至关重要的作用,因此Msx1的翻译后修饰尤其是磷酸化修饰必然能够影响其功能的发挥。首先利用磷酸化位点预测软件对Msx1的蛋白序列(图 1-A)进行预测分析,发现其有21个潜在的磷酸化位点,其中有15个丝氨酸,5个苏氨酸和1个酪氨酸分别被磷酸化,如图 1-C所示。图 1-B 中显示的两个磷酸化位点处于Msx1的同源结构域中。对上述潜在的磷酸化位点进行序列分析,发现丝氨酸和苏氨酸磷酸化位点前后6个氨基酸残基是有区别的,但是都具有一定的保守性,该结果说明这两种磷酸化位点的激酶识别位点是不同的。蛋白质翻译后修饰大多数都是由酶介导催化,预测结果表明是由不同的激酶对这两个位点磷酸化的发生进行了催化,分别是cdc2和ATM、PKA和IKK。

|
| 图 1 Msx1中磷酸化位点的预测 A:Msx1的蛋白序列;B:152位和160位丝氨酸的预测结果;C:Msx1中丝氨酸、苏氨酸和酪氨酸磷酸化位点的比例和保守氨基酸残基 |
为了证实Msx1蛋白在小鼠C2C12细胞中的磷酸化状态和预测结果是吻合的,首先在C2C12细胞中过表达含有Flag标签的Msx1质粒,裂解C2C12细胞,用SDS-PAGE进行检测,取其中一块凝胶33 kD处IP胶块用来做质谱鉴定,另一块利用Western blot的方法和Flag抗体进行检测,如图 2所示。

|
| 图 2 免疫共沉淀Msx1蛋白的SDS-PAGE检测结果 |
质谱鉴定结果如图 3所示,图 3-A中红色肽段为质谱鉴定出来的Msx1肽段,蓝色圈里的是含有丝氨酸152位和丝氨酸160位的磷酸化肽段位置。质谱数据中有两处荷质比变化明显的峰,分别包含在肽段FpSPPPARR和RLpSPPACTLR中,如图 3-B和3-C的二级波谱图所示,这两处变化正是由于丝氨酸152和丝氨酸160位的磷酸基团引起的。
|
| 图 3 Msx1中磷酸化位点的质谱鉴定 A:红色代表Msx1中磷酸化修饰肽段,蓝色圈代表152位和160位所在肽段;B和C:152位磷酸化位点的二级质谱图 |
为了进一步证实这两个磷酸化位点的存在,合成单磷酸化多肽1(C-QSPRFpSPPPAR-NH2)、非磷酸化多肽1(C-QSPRFSPPPAR-NH2)、单磷酸化多肽2(C-PARRLpSPPAC-NH2)、非磷酸化多肽2(C-PARRLSPPAC-NH2)分别注射兔子,制备针对两个位点的特异性抗体,采用Western blot方法,利用特异性抗体检测了第152位和第160位丝氨酸的磷酸化状态,结果(图 4)同样证实Msx1在这两个位点是磷酸化的,并且这两个位点突变成丙氨酸后则不能被磷酸化。

|
| 图 4 利用 Western blot 验证特异性抗体的活性 |
人和小鼠高覆盖率的基因组已被测序,而且同源异型框基因还是一类高度保守的基因家族,为了证实这两个磷酸化位点在二者之间是否有高度的保守性,利用NCBI将蛋白序列进行比对,结果(图 5)表明两个磷酸化位点具有高度保守性。此外,利用生物信息学分析了人的蛋白序列,结果显示这两个位点也是磷酸化的。

|
| 图 5 人和小鼠的Msx1蛋白序列比对结果图 红色代表人和小鼠Msx1蛋白中不一样的氨基酸;蓝色代表Msx1的转录抑制区域;绿色代表同源异型结构域;浅紫色代表Msx1的C末端;黑色框代表152位和160位丝氨酸 |
蛋白质磷酸化修饰是生物体内一类十分重要的翻译后修饰,快速鉴定出蛋白磷酸化修饰位点成为研究磷酸化修饰的关键之处,本研究首先利用预测软件对Msx1磷酸化位点进行预测,只需要直接输入蛋白的氨基酸序列便可以进行磷酸化位点预测,方便快捷,避免繁琐的实验操作,为磷酸化位点的确定提供了一定的参考依据。但是预测软件只是根据蛋白的一级结构进行预测,而生物体内蛋白质的结构复杂多样,因此Msx1磷酸化的确定,还必须通过充分的实验来验证。本实验过程中,除了Msx1,细胞裂解液中还含有其他蛋白成分,质谱分析对磷酸化肽段纯度要求较高,然而免疫共沉淀能够使蛋白富集,从而可以得到相对纯化的Msx1,这有利于对Msx1的质谱鉴定。通过质谱对Msx1进行分析鉴定,发现蛋白中有潜在的磷酸化修饰肽段,蛋白质谱学的快速发展,能够在短时间内对潜在肽段进行二级质谱分析,结果和软件预测是吻合的。
生物体内蛋白磷酸化修饰是一个动态调控过程,不同生存环境都可能会影响蛋白的修饰状态。磷酸化肽段非常不稳定,容易发生脱磷酸化,因此在实验处理过程中除了加入磷酸酶抑制剂外还要注意操作环境的温度。从免疫共沉淀技术到质谱鉴定,从专一的生物化学反应再到特异性验证等一系列实验,证实了Msx1的磷酸化修饰状态,发现了丝氨酸152位和丝氨酸160位两个新的磷酸化位点。文中的特异性抗体,利用152位和160位单磷酸化和非磷酸化的肽段注射兔子,并且分别使用单磷酸化多肽及非磷酸化多肽制备亲和纯化柱,对磷酸化特异性抗体进行纯化,最后得到了特异性更高的抗体。特异性抗体的制备和验证更是为后期实验的研究提供重要依据,可以直接利用特异性抗体检测蛋白中磷酸化位点,进一步研究生物体内磷酸化修饰的动态调控模式。Msx1磷酸化位点的实验验证,提供了现代生物学研究中又一个富有启示性的案例。
本研究以同源异型框蛋白Msx1为代表研究蛋白磷酸化修饰,优势在于Msx1基因片段较小,操作方便。运用生物信息学与质谱技术联合的方法对蛋白翻译后修饰进行预测和鉴定分析,方便快捷,可以通过预测软件对其他同源异型框蛋白进行预测,进一步利用特异性抗体加以验证,为下一步研究Msx1磷酸化修饰对其生物学功能的影响以及其他同源框蛋白的生物功能奠定了扎实的生物基础。
本研究对人和小鼠的Msx1蛋白进行比对,二者的蛋白序列具有高度保守性,特异性抗体所用的肽段在人和小鼠中是相同的,因此可以直接用来检测人的MSX1磷酸化状态。但是不同物种中Msx1的磷酸化修饰是否完全相同,需要进一步验证。蛋白的翻译后修饰大部分是由激酶介导,不同的酶可催化同一个底物,同一个酶也可催化不同的底物。预测结果同时提供了不同的潜在磷酸激酶,后期实验可以通过体外磷酸激酶分析验证,通过对细胞内的激酶敲除,利用特异性的磷酸化抗体进行检测。酶对底物的催化反应可以是间接也可以是直接结合进行催化,Msx1是否直接被酶催化,需要对Msx1的空间结构做进一步分析。
4 结论本研究首先运用生物信息学对同源异型框蛋白Msx1进行了预测,发现了21个潜在的磷酸化位点,进而在C2C12细胞中过量表达Msx1蛋白,并利用免疫共沉淀技术以及质谱分析技术对磷酸化位点进行鉴定,发现了两个新的磷酸化位点,分别为丝氨酸152位和丝氨酸160位,预测结果和实验结果具有一致性。这两个位点的发现为研究Msx1磷酸化修饰以及其他翻译后修饰提供了重要的参考。同源异型框基因又是一类高度保守的基因,实验结果同时验证了这两个磷酸化位点在人和小鼠中都是高度保守的,从而利用生物信息学软件对人的MSX1的磷酸化修饰位点进行预测,可以为研究MSX1在调控人类健康以及人类重大疾病相关的复杂生命过程中精确的分子作用提供参考依据。
| [1] | Thingholm TE, Jensen ON, Larsen MR. Analytical strategies for Phosphoproteomics[J]. Proteomics, 2009, 9(6): 1451–1468. |
| [2] | Duan JJ, Lozada AF, Gou CY, et al. Nicotine recruits glutamate receptors to postsynaptic sites[J]. Mol Cell Neurosci, 2015, 68: 340–349. |
| [3] | Linke D, Koudelka T, Becker A, Tholey A. Identification and relative quantification of phosphopeptides by a combination of multi-protease digestion and isobaric labeling[J]. Rapid Commun Mass Spectrom, 2015, 29(10): 919–926. |
| [4] | Blazek M, Santisteban TS, Zengerle R, et al. Analysis of fast protein phosphorylation kinetics in single cells on a microfluidic chip[J]. Lab Chip, 2014, 15(3): 726–734. |
| [5] | Luo R, Zhou C, Lin J, Yang D, et al. Identification of in vivo protein phosphorylation sites in human pathogen Schistosoma japonicum by a phosphoproteomic approach[J]. Proteomics, 2012, 75: 868–877. |
| [6] | Zhang B, Liu JY. Mass spectrometric identification of in vivo phosphorylation sites of differentially expressed proteins in elongating cotton fiber cells[J]. PLoS One, 2013, 8: e58758. |
| [7] | Lelli KM, Noro B, Mann RS. Variable motif utilization in homeotic selector(Hox)-cofactor complex formation controls specificity[J]. Proc Natl Acad Sci USA, 2011, 108(52): 21122–21127. |
| [8] | Dai J, Mou Z, Shen S, et al. Bioinformatic analysis of Msx1 and Msx2 involved in craniofacial development[J]. J Craniofac Surg, 2014, 25(1): 129–134. |
| [9] | Zhang W, Qu HC, Zhang Y. Association of MSX1 and TGF-β1 genetic polymorphisms with hypodontia:meta-analysis[J]. Genet Mol Res, 2014, 13(4): 10007–10016. |
| [10] | Nassif A, Senussi I, Meary F, et al. Msx1 role in craniofacial bone morphogenesis[J]. Bone, 2014, 66: 96–104. |
| [11] | Reddy NA, Adusumilli G, Devanna R, et al. MSX1 gene variant - its presence in tooth absence - a case control genetic study[J]. J Int Oral Health, 2013, 5(5): 20–26. |
| [12] | Mundstock CA, Bortolini MC, Salzano FM, et al. MSX1 and PAX9 investigation in monozygotic twins with variable expression of tooth agenesis[J]. Twin Res Hum Genet, 2013, 16(6): 1112–1116. |
| [13] | Souza LT1, Kowalski TW, Collares MV, et al. MSX1 gene and nonsyndromic oral clefts in a Southern Brazilian population[J]. Braz J Med Biol Res, 2013, 46(7): 555–558. |
| [14] | Yilmaz A, Engeler R, Constantinescu S, et al. Ectopic expression of Msx2 in mammalian myotubes recapitulates aspects of amphibian muscle dedifferentiation[J]. Stem Cell Res, 2015, 15(3): 542–553. |
| [15] | Seo YJ, Park JW, Kim YH, et al. Associations between the risk of tooth agenesis and single-nucleotide polymorphisms of MSX1 and PAX9 genes in nonsyndromic cleft patients[J]. Angle Orthod, 2013, 83(6): 1036–1042. |
| [16] | Kim NY, Kim YH, Park JW, et al. Association between MSX1 SNPs and nonsyndromic cleft lip with or without cleft palate in the Korean population[J]. J Korean Med Sci, 2013, 28(4): 522–526. |
| [17] | Xie H, Cherrington BD, Meadows JD, et al. Msx1 homeodomain protein represses the αGSU and GnRH receptor genes during gonadotrope development[J]. Mol Endocrinol, 2013, 27(3): 422–436. |
| [18] | Rafighdoost H, Hashemi M, Narouei A, et al. Association between CDH1 and MSX1 gene polymorphisms and the risk of nonsyndromic cleft lip and/or cleft palate in a southeast Iranian population[J]. Cleft Palate Craniofac J, 2013, 50(5): e98–e104. |
| [19] | Wang J, Abate-Shen C. Transcriptional repression by the Msx1 homeoprotein is associated with global redistribution of the H3K27me3 repressive mark to the nuclear periphery[J]. Nucleus, 2012, 3(2): 155–161. |
| [20] | Song YJ, Lee H. PIAS1 negatively regulates ubiquitination of Msx1 homeoprotein independent of its SUMO ligase activity[J]. Mol Cells, 2011, 32(3): 221–226. |
| [21] |
Wang J, Kumar RM, Biggs VJ, et al. The Msx1 homeoprotein recruits Polycomb to the nuclear periphery during development [J]. Dev Cell, 2011, 21(3): 575–588. |
| [22] | Wang JQ, Abate-Shen C. The msx1 homeoprotein recruits G9a methyltransferase to repressed target genes in myoblast cells[J]. PLoS One, 2012, 7(5): e37647. |




