我国设施蔬菜产业发展迅速,由于其适宜的温湿度及连作等众多原因,病虫害发病日益严重,杀虫剂的使用也在逐年增加,土壤环境中农药残留严重。其中毒死蜱就是其中一种广谱杀虫且应用广泛的有机磷杀虫剂,在土壤中的半公众安全的威胁[2]。利用生物或生物产品来降解污染物的生物修复方法具有无毒、无残留、无二次污染等优点,是消除和解毒高浓度的农药残留的一种安全、有效、廉价的方法[3]。目前报道的能降解毒死蜱的降解菌来源主要是被农药污染的土壤或农药厂污泥[4],种类主要是细菌,如假单胞菌(Pseudomonas sp.)、邻单胞菌(Plesiomonas sp.)、芽孢杆菌(Bacillus sp.)、节杆菌(Arthrobacter sp.)、产碱杆菌(Alcaligenes sp.)、哈夫尼菌(Hafnia sp.)、沙雷氏菌(Serratia sp.)、鞘脂单胞菌(Sphingomonas sp.)、罗尔斯通菌(Ralstonia sp.)、克雷伯氏菌(Klebsiella sp.)、普罗维登斯菌(Providencia sp.)等[4]。部分真菌也可以降解有机磷农药,如曲霉(Aspergillus sp.)、轮枝孢(Verticillium sp.)、镰孢菌(Fusarium sp.)[5-7],也有关于木霉菌(Trichoderma sp.)的报道[6]。
木霉是土壤微生物的优势种群,一直作为生防菌被广泛研究和应用,近来的研究表明木霉在土壤和水源污染(如农药等有机物污染或重金属污染)修复方面表现巨大的应用潜力[6]。本研究从长期施药的韭菜温室土壤里分离能降解毒死蜱的木霉,并对其降解特性进行初步研究,旨在为土壤中农药残留的污染修复提供借鉴参考。
1 材料与方法 1.1 材料毒死蜱标准品(≥99.5%),北京上立方联合化工技术研究院提供。毒死蜱原药(≥95%),山东天成生物技术有限公司提供。其他试剂均为分析纯。
1.2 方法 1.2.1 木霉分离及鉴定土样采自山东多年种植韭菜的日光温室(韭蛆发病严重,毒死蜱和其他多种有机磷农药频繁,大量施用)。通过两种途径获得木霉菌株。方法A(富集培养[8]):将1.0 g土样接种到含有50 mL 无机盐液体培养基(MSM:K2HPO4 1.50 g,KH2PO4 0.50 g,MgSO4·7H2O 0.50 g,(NH4)2SO4 0.50 g,FeSO4·7H2O 0.002 g,CaCl2 0.04 g,NaC l0.5 g,H2O 1 000 mL,pH7.0。灭菌后加入50 mg/L 毒死蜱原药作为唯一碳氮源)的250 mL三角瓶里,140 r/min,25℃培养7 d;取1 mL 培养物转接入含有100 mg/L 毒死蜱原药的同样条件的无机盐培养基里,同上条件培养;并依次提高毒死蜱浓度至150 mg/L、200 mg/L。最后,将培养物稀释、涂板至MSM固体培养基上,25℃培养2-3 d,挑取类似木霉菌株,纯化,去同,保存。
方法B:直接将土样用无菌水稀释,涂在含有100 mg/L 毒死蜱原药的MSM固体培养基上,25℃培养2-3 d,挑取类似木霉菌株,纯化,去同,保存。
结合形态学特征和ITS rDNA序列对木霉进行初步鉴定[9]。
1.2.2 木霉对毒死蜱降解能力的初步测定按100 mg/L的浓度含量将毒死蜱加入到灭菌后的装有50 mL无机盐液体培养基(MSM)的250 mL三角瓶中,分别接种各菌株木霉孢子悬液(1.0×108 CFU/mL)1 mL,以不接木霉孢子悬液的处理为对照。每处理重复3次,置于30℃ 140 r/min 培养5 d,每隔1 d全取样1次,并利用GC-ECD法检测毒死蜱残留量[10, 11]。并选择降解活性最高的木霉菌株进行降解特性研究。
1.2.3 添加碳源对木霉降解毒死蜱活性的影响将0.05 g 葡萄糖加入到含有50 mL 无机盐液体培养基(灭菌后加入100 mg/L毒死蜱)的250 mL三角瓶中。接种1 mL待测菌株的孢子悬液(1.0×108 CFU/mL),置于30℃ 140 r/min 培养5 d,隔1 d全取样1次,检测毒死蜱残留量,以不加葡萄糖的处理为对照。
1.2.4 接种浓度对木霉降解毒死蜱的影响3种不同浓度的的木霉孢子悬液(1.0×107 CFU/mL,1.0×108 CFU/mL和1.0×109 CFU/mL)分别接种到上述含有毒死蜱的无机盐液体培养基中。未接种木霉的处理作为对照。培养条件及检测方法同上。
1.2.5 底物浓度对木霉降解毒死蜱的影响不同浓度的毒死蜱(50 mg/L,100 mg/L,150 mg/L,200 mg/L,250 mg/L和 300 mg/L)加入到MSM液体培养基中,接种1 mL 同一木霉孢子悬液(1.0×108CFU/mL)。同上条件下培养,并取样检测木霉含量。以未接木霉的处理为对照。
1.2.6 pH对木霉降解毒死蜱的影响将无机盐液体培养基分设pH5、pH6、pH7、pH8、pH9等5个不同梯度,灭菌后加入100 mg/L毒死蜱,再接种1 mL待测木霉孢子悬液(1.0×108 CFU/mL),连续培养5 d,同上全取样,检测毒死蜱残留量。
1.2.7 盆栽条件下木霉对毒死蜱的降解效果2014年6月在单位东区温室内进行盆栽试验。土壤取自寿光市孙家集镇西候村日光温室,实验用塑料瓶(18 cm×15 cm×15 cm),每盆装土壤1 kg。处理分设两组,A组121℃湿热灭菌2 h,B组不灭菌,按100 mg/kg的量添加毒死蜱,混拌均匀并吸附24 h。A、B组设各2个处理:(1)加1.0×106 CFU/mL)木霉TC5孢子悬液;(2)加1.0×108 CFU/mL)木霉TC5孢子悬液;以不加菌剂的为对照,每处理3次重复,每盆种番茄种类5粒(出苗后统一留下3棵),木霉孢子悬液以完全浸透盆内土壤为准。温室内自然条件下培养2周,采用GC-ECD的方法,取土样测定毒死蜱残留量[11]。
2 结果 2.1 毒死蜱降解木霉的分离及鉴定通过两种分离途径,共分离6个不同的木霉菌株。其中,通过富集培养的方式,最终分离4个木霉菌株,编号TC1-TC4;而直接通过稀释平板法,分离得到另外2个木霉菌株,编号TC5和TC6。结果表明,长期使用有机磷农药的土壤中,降解毒死蜱的木霉菌资源丰富;且不同的分离方法,获得不同的木霉菌株,也显示各木霉菌在土壤中具有不同的种群密度以及竞争优势。结合形态学特征和ITS rDNA序列对木霉进行初步鉴定,TC1-TC6分别属于哈茨木霉(T. harzianum)、绿色木霉(T. viride)、康宁木霉(T. koningii)、拟康宁木霉(T. koningiopsis)、长枝木霉(T. longibrachiatum)和短密木霉(T. brev-icompactum)。
2.2 木霉对毒死蜱的降解能力测定在摇瓶培养的条件下,测定木霉对毒死蜱的降解能力。结果如图 1所示,各木霉菌株对毒死蜱的降解曲线大致相同。木霉在接种后24 h内即开始发挥降解作用,没有观察到Karpouzas和Anwar等[1]描述的滞后期,表明木霉在较低生长量时就能表现明显的降解活性,降解效率更高。24 h后,各菌株的降解活性迅速提高,此时观察摇瓶中木霉生物量也迅速增多。3 d后,随着毒死蜱浓度的降低,木霉对其降解活性也放慢。5 d后,各处理毒死蜱的含量分别降为7.50±1.67 mg/L、10.90±2.50 mg/L、9.00±2.30 mg/L、11.93±3.15mg/L、2.00±1.50mg/L和8.55±2.58 mg/L,降解率均在87%以上;菌株间差别不大,其中TC5菌株(长枝木霉)降解活性最高,对毒死蜱的降解率达到97.93%。
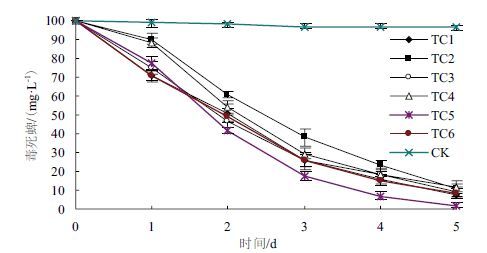
|
| 图 1 木霉对毒死蜱的降解作用 |
接种木霉TC5菌株 24 h后,添加1.0 g/L葡萄糖,毒死蜱降为71.67±4.48 mg/L,降解率为26.85%,高于未添解速率趋于平缓,而未加碳源的处理降解速率加速,3 d后也开始降低,趋势与添加碳源的处理相同。5 d后,添加碳源,毒死蜱降为1.85±1.19 mg/L,略低于未加碳源3.8±1.86 mg/L的残留量,降解率分别为98.05%和96%,差异不明显。表明添加碳源,主要通过快速提高木霉的生长,从而提高对毒死蜱的降解率,最终对毒死蜱的降解效率差异不明显。
2.4 接种浓度对木霉降解毒死蜱的影响接种不同浓度的木霉孢子悬液,对木霉TC5菌株降解毒死蜱的能力影响明显。如图 3所示,加大接种浓度,能加快的降解速率在2 d后,随着木霉生物量的增加,也逐渐提高,并开始高于高接种浓度的处理,此时高接种浓度的降解率随着毒死蜱底物浓度的降低而逐渐放缓。这与通过添加碳源提高木霉生长量,从而提高降解毒死蜱的速度原理基本一致。
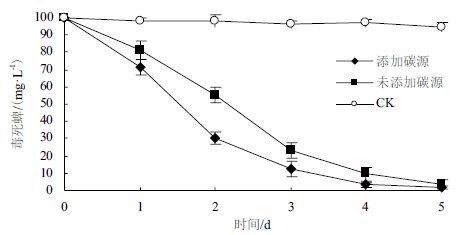
|
| 图 2 外加碳源对木霉降解毒死蜱活性的影响 |
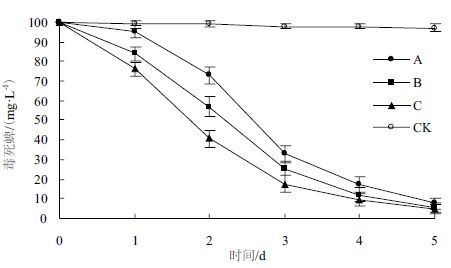
|
| 图 3 接种浓度对木霉降解毒死蜱的影响 A:1.0×107CFU/mL;B:1.0×108CFU/mL;C:1.0×109CFU/mL |
木霉TC5对不同毒死蜱浓度的降解效果如图 4所示,具有明显的差异。对高浓度的毒死蜱底物,降解效率也相应升高。在50、100、150、200、250和 300 mg/L不同底物浓度条件下,降解后的毒死蜱残留分别为12.93±1.79 mg/L、4.42±0.91 mg/L、5.45±0.80 mg/L、3.63±1.50 mg/L、5.43±1.23 mg/L和3.30±0.36 mg/L,降解率分别为72.77%、95.44%、96.23%、98.14%、97.79%和98.86%。由此表明,在低浓度范围内,随着毒死蜱底物浓度的升高,降解率也有显著提高。在高浓度(200 mg/L、250 mg/L和300 mg/L)条件下,处理间差异不显著。
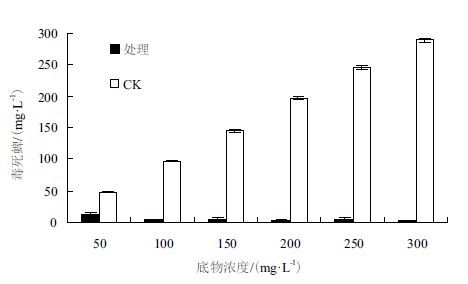
|
| 图 4 底物浓度对木霉降解毒死蜱的影响 |
研究木霉TC5在pH 5、pH 6、pH 7、pH 8、pH 9五个不同梯度条件对毒死蜱的降解效果,结果如图 5所示。在5个不同pH梯度条件下,接种木霉5 d后,毒死蜱残留分别降至40.00±1.73 mg/L、23.33±1.85 mg/L、4.03±1.38 mg/L、11.67±1.02 mg/L、16.67±1.15 mg/L,降解率分别为55.98%、74.93%、95.85%、85.02%、70.17%。在中性条件下,木霉对毒死蜱具有最高的降解活性;在酸性条件下,毒死蜱相对稳定,随着pH5降低,降解活性也降低;而在碱性条件下毒死蜱不稳定,随着pH升高降解活性也显著降低,这与肠杆菌(Enterobactor sp.)或芽孢杆菌(B. pumilus)等细菌的降解特性显著不同[1, 12],即在高pH条件表现较高的降解活性。保护地土壤一般偏酸性,因此毒死蜱在其中稳定性好,在应用生物菌剂处理时,可考虑提高土壤的pH,以利于发挥生物菌的活性。
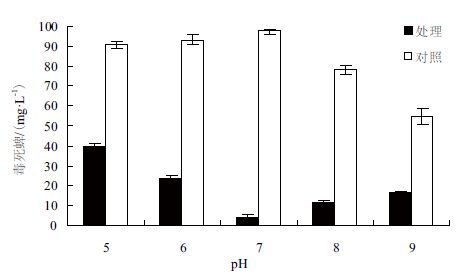
|
| 图 5 pH对木霉降解毒死蜱活性的影响 |
在灭菌土和未灭菌土壤中,木霉TC5对毒死蜱的降解差异显著(图 6)。在灭菌土中,木霉对毒死蜱保持较高的降解率,培养2周后,使用低剂量的木霉菌的处理(A1)和高剂量的木霉处理(A2)毒死蜱残留降为4.07±0.95 mg/L和2.77±1.12 mg/L,降解率分别达95.8%、97.15%,处理间差异不显著;而在未灭菌土壤(B组)中,低剂量和高剂量木霉菌处理的毒死蜱残留分别为27.83±3.73 mg/L和14.60±2.58 mg/L,降解效率显著低于灭菌土壤中的处理;两个剂量的处理间降解效率有明显差异,降解率分别为69.91%和84.22%。该结果表明受土壤中其他微生物影响,木霉对毒死蜱的降解作用明显受到影响,且低剂量的木霉受影响更大。
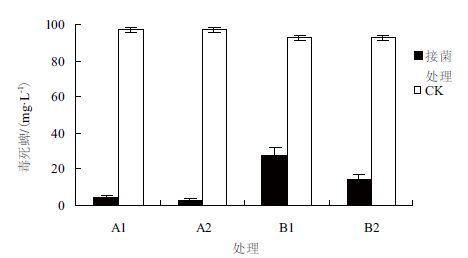
|
| 图 6 土壤中木霉对毒死蜱的降解 |
从被农药污染的土壤或农药厂污泥中分离毒死蜱降解菌,往往获得1株或2株降解菌,且多是细菌[4]。本研究从保护地土壤中分离能降解毒死蜱的真菌,获得6个不同木霉菌株,表明该环境中降解木霉资源丰富。用富集培养和直接稀释平板法等不同的分离方式,分别获得不同的木霉菌株,表明能降解毒死蜱的木霉有不同的竞争能力,在土壤中有不同的种群密度,在菌株分离过程中,应综合考虑不同的分离筛选方式。筛选的木霉对毒死蜱具有较强的降解能力,在无外加营养元素、低接种剂量或者针对较高浓度的毒死蜱,均能保持较高的降解能力。盆栽条件下,木霉对毒死蜱的降解活性与在摇瓶纯培养条件下的降解活性差别明显,表明木霉等活体微生物在土壤中易受其他微生物种类的影响而有所下降。
本实验结果表明木霉是一类很有应用开发潜力的降解菌资源,但在盆栽自然土壤条件下,菌体生长易受其他微生物抑制,而导致对毒死蜱的降解效率降低。因此在实际应用过程中,可以通过适当外加营养,提高接种剂量,调整土壤pH等措施,提高木霉的竞争能力和对毒死蜱的降解活性;同时不断筛选在土壤中有更好适应性和竞争能力的菌株,以提高木霉的竞争性和对毒死蜱降解活性的稳定性,才有可能研发有实际应用潜力的降解菌剂。
我国设施蔬菜发展迅速,但病虫害危害也越来越重、农药残留污染等已经成为影响蔬菜产业主产去健康发展的突出问题,农药残留微生物治理及生物防治技术是必不可少的解决途径。当前,已报道的降解毒死蜱等有机磷农药的微生物,主要分离自毒死蜱污染土壤、水体底泥及污水处理厂出口污泥,种类多数是细菌[4],功能较单一,在农业生产上还没有得到有效应用。由于木霉种类众多,通常也会表现较强的生防活性,如分离的6个木霉菌株对立枯丝核菌(Rhizoctonia solani)、终极腐霉(Pythium ultimum)、腐皮镰刀菌(Fusarium solani)、大丽轮枝菌(Verticillium dahliae)、尖孢镰刀菌(F. oxysporum)及灰霉菌(Botrytis cinerea)等具有多样化的生防作用机理[13],因此联合对土传植物病害生防活性的筛选,可以挖掘多功能木霉菌资源,研究开发兼具土壤污染修复和生防等功能的多功能生物修复菌剂。
4 结论从长期施药的设施菜地土壤中分离能降解毒死蜱的木霉菌,共获得6株不同种类的木霉菌,对毒死蜱具有高效的降解活性,经鉴定分别为哈茨木霉(T. harzianum)、绿色木霉(T. viride)、康宁木霉(T. koningii)、拟康宁木霉(T. koningiopsis)、长枝木霉(T. longibrachiatum)和短密木霉(T. brevicompactum)。测定木霉TC5菌株在不同条件下的降解特性,结果在摇瓶条件下适当外加营养(碳源),提高接种剂量,调整pH至中性或碱性条件等,均有利于提高木霉对毒死蜱的降解活性;而在盆栽土壤环境中,木霉在自然土中对毒死蜱的降解活性明显低于灭菌土处理,但仍表现较高的降解能力,显示出较强实际应用开发潜力。
| [1] | Anwar S, Liaquat F, Khan QM, et al. Biodegradation of chlorpyrifos and its hydrolysis product 3, 5, 6-trichloro-2-pyridinol by Bacillus pumilus strain C2A1[J]. Journal of Hazardous Materials, 2009, 168: 400–405. |
| [2] | Yu L, Fang H, Wang X, et al. Characterization of a fungal strain capable of degrading chlorpyrifos and its use in detoxification of the insecticide on vegetables[J]. Biodegradation, 2006, 17: 487–494. |
| [3] | Yang L, Zhao Y, Zhang B, et al. Isoation and characterization of a chlorpyrifos and 3, 5, 6-trichloro-2-pyridinol degrading bacterium[J]. FEMS Microbiology Letters, 2005, 251: 67–73. |
| [4] | 武春媛, 陈楠, 李勤奋, 等. 毒死蜱降解菌及其降解机理研究进展[J]. 热带作物学报, 2011, 32(10): 1989–1994. |
| [5] | Ezzi MI, Lynch JM. Biodegradation of cyanide by Trichoderma spp. and Fusarium spp[J]. Enzyme Microb Technol, 2005, 36: 849–854. |
| [6] | Tripathi P, Singh PC, Mishra A, et al. Trichoderma:a potential bioremediator for environmental clean up[J]. Clean Techn Environ Policy, 2013, 15: 541–550. |
| [7] | Xu G, Li Y, Zheng W, et al. Mineralization of chlorpyrifos by co-culture of Serratia and Trichosporon spp[J]. Biotechnol Lett, 2007, 29: 1469–1473. |
| [8] | Venkateswarlu K, Siddarame Gowda TK, Sethunathan N. Persistence and biodegradation of carbofuran in flooded soils[J]. Journal of Agricultural and Food Chemistry, 1977, 25(3): 533–536. |
| [9] | Zhang C, Druzhinina IS, Tong X, et al. Trichoderma biodiversity in China:evidence for a North to South distribution of species in East Asia[J]. FEMS Microbiol Letts, 2005, 25(3): 251–257. |
| [10] | Lan W, Cong J, Jiang H, et al. Expression and characterization of carboxylesterase E4 gene from peachpotato aphid(Myzus persicae)for degradation of carbaryl and malathion[J]. Biotechnol Lett, 2005, 27: 1141–1146. |
| [11] | 石利利, 林玉锁, 徐亦钢, 等. 高尔夫球场土壤和水中毒死蜱农药残留的测定[J]. 农业生态环境, 2000, 16(3): 35–38. |
| [12] | Singh BK, Walker A, Morgan JAW, et al. Biodegradation of chlor-pyrifos by Enterobacter strain B-14 and its use in bioremediation of contaminated soils[J]. Appl Environ Microbiol, 2004, 70: 4855–4863. |
| [13] | 张广志, 杨合同, 张新建, 等. 毒死蜱降解木霉菌对几种重要植物病原真菌的生防活性[J]. 菌物学报, 2014, 33(6): 1292–1301. |




