应用有益微生物防治植物病害因其环保、安全、无副作用等优点,已成为植物病害防治的重要手段,芽孢杆菌培养周期短,易发酵获得而日益成为生防菌的优势菌源[1]。已报到的生防芽孢杆菌种类主要有枯草芽孢杆菌(Bacillus subtilis)、多黏类芽孢杆菌(Paenibacillus polymyxa)和蜡状芽孢杆菌(Bacillus cereus)等[2]。但不同菌株的定殖能力不同,具有较好的定殖能力是生防微生物发挥生防作用的重要条件之一,其定殖能力的强弱决定着生防作用的大小[3, 4]。本课题组从连云港海域海泥中分离得到的多黏类芽孢杆菌L1-9菌株及其发酵产物对黄瓜枯萎病菌(Fusarium oxysporum)等多种植物病原真菌的菌丝生长和孢子萌发具有强烈的抑制作用,对小麦根腐霉病和番茄早疫病的防病效果明显,而对大豆、小麦、黄瓜等作物的种子发芽、出苗和以及幼苗生长安全,表现出了良好的开发应用前景[5-7],但该菌株分离自海洋环境,能否在土壤中定殖是发挥生防效果的关键。
对环境中的目标生防菌进行定殖检测是检验其生防潜力的有效方法,其中抗生素标记法[8, 9]已成为研究生防菌在土壤和植物体内定殖规律的一种简便、经济的方法。该方法一般不会导致原始菌株重要特性的改变。杨洪凤等[10]、王静等[11]采用抗利福平标记法研究了内生解淀粉芽孢杆菌(Bacillus amyloliquefaciens)CC09菌株和短小芽孢杆菌(Ba-cillus pumilus)AR03在小麦叶部和烟草根部及根际土壤中的定殖规律;游春平等[12]使用利福平和青霉素双抗标记法证明拮抗细菌Bio-d5在香蕉土壤中有较好的定殖能力。有关来自于海洋的生防菌株的定殖规律尚未见报道。为了探讨来自海洋生防菌株在环境中的定殖规律及其生防效果,本研究通过盆栽试验测定海洋多粘类芽孢杆菌对黄瓜枯萎病的防病效果,采用双抗标记法明确来自海洋的生防多粘类芽孢杆菌L1-9菌株在黄瓜根及茎、叶内的定殖情况,旨在为研究海洋细菌L1-9菌株的生防作用机理和效果评价提供理论依据。
1 材料与方法 1.1 材料 1.1.1 供试菌种和培养基多黏类芽孢杆菌(P. polymyxa)L1-9由本实验室从连云港海域潮间带海泥中分离获得并保存。供试病原真菌黄瓜枯萎病菌(F. oxysporum)、禾谷镰刀菌(Fusarium graminearum)和小麦根腐病菌(Bipolaris sorokiniana)由中国农业科学院植物保护研究所提供,本实验室保藏。
1.1.2 L1-9菌株培养保藏和抗药性菌株的筛选培养基为海水配制的PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15-20 g,用海水定容至1 L;L1-9种子液和和发酵液的制备培养基为PD:马铃薯200 g,葡萄糖20 g,用海水定容至1 L;病原真菌活化及抑菌试验用培养基为淡水配制的PDA培养基;黄瓜枯萎病菌扩繁培养基为麦粒砂培养基:麦粒40 g,水60 mL,砂100 g,pH自然。
1.1.3 抗生素及其溶液的配制链霉素和利福平购自上海英潍捷基生物技术有限公司。称取链霉素适量,置于棕色试剂瓶中,在超净台无菌条件下加入适量无菌水溶解,用孔径为0.22 μm 的滤膜过滤,配制成200 mg/mL链霉素母液。同样称取一定量的利福平,于棕色试剂瓶中加入二甲基亚砜溶解,用孔径0.22 μm 的滤膜过滤,配制成50 mg/mL利福平母液,整个过程在黑暗条件下进行。将配好的链霉素、利福平溶液装入EP管中,避光4℃密封保存。
1.1.4 黄瓜种子及土壤黄瓜种子:津春四号,购自连云港市新浦区种子站佳园种子公司。土壤:取自连云港市花果山脚下新华村种植黄瓜土壤耕作层,过筛后备用。
1.2 方法 1.2.1 黄瓜枯萎病菌接种物的制备装有200 g麦粒砂培养基的250 mL三角瓶中接种培养4 d、直径5 mm的黄瓜枯萎病菌菌苔6块,28℃恒温培养5 d,粉碎按1∶1比例与无菌细砂混匀,即为黄瓜枯萎病菌接种物[13]。
1.2.2 海洋多黏类芽孢杆菌L1-9菌株抗链霉素和利福平标记将液体培养24 h的L1-9菌株稀释涂布在含有5 μg/mL链霉素的PDA培养基上,281-9菌株不能生长,筛选出抗最高浓度链霉素的L1-9菌株突变菌株。采用同样的方法,将筛选出的抗最高浓度链霉素的L1-9菌株依次接种在含高浓度链霉素,并同时加入不同浓度利福平的PDA培养基上,筛选出同时抗高浓度链霉素和高浓度利福平的L1-9双抗菌株,在双抗培养基传代培养10代,测定双抗菌株的抗菌作用传代稳定性。
平板对峙培养法测定L1-9菌株的双抗菌株对禾谷镰刀菌(F. graminearum)、小麦根腐菌(B. sorokiniana)及黄瓜枯萎菌(F. oxysporum)等植物病原真菌的抑制作用,并测定双抗菌株的抗性传代稳定性。
1.2.3 L1-9标记菌株发酵液的制备L1-9标记菌株在含链霉素和利福平的PDA斜面上培养24 h 后,用PD培养液洗下菌苔,制备浓度为5 ×108 CFU/mL 的菌悬液作为种子液,按8%的接种量接种到装有50 mL含链霉素和利福平的PD培养液的250 mL三角瓶中,在转速180 r/min,28℃下振荡培养24 h,制备成浓度为109 CFU/mL的菌悬液[13]。
1.2.4 标记菌株L1-9Str,rif在土壤和黄瓜根、茎、叶组织中的定殖及防病效果采用室内盆栽试验的方法,L1-9标记菌株和原始菌株发酵液分别与土壤混和,使土壤中L1-9标记菌株和原始菌株的含量为109 CFU/g,分别为处理1和处理2,以等量的L1-9标记菌株发酵培养基和PD培养基为对照1(CK1)和对照2(CK2),每个口径为10 cm的营养钵装土200 g,播种黄瓜种子5粒,采取上覆下垫方式接种黄瓜枯萎病菌接种物5 g,每个处理和对照播种50盆,播种当天开始,每隔3 d取黄瓜根际、外根际和根表土壤以及黄瓜根组织、茎、子叶和真叶组织,每次取黄瓜5株。采集根际土及根表土参考涂璇等人的方法[14]。
1.2.4.1 根际土将同一处理的黄瓜幼苗轻轻拔起,稍微抖动下,使根上大块土壤脱落,用无菌纸包裹,轻轻揉搓,使依附在根上的土壤落在无菌纸上,充分混匀后即为根际土。
1.2.4.2 根表土及根组织将取过根际土的黄瓜根系剪下,称质量为m1,后放入装有石英砂和99 mL无菌水的三角瓶中,在摇床上室温振荡30 min后取出根系,用吸水纸将其周围的水分吸干后,称得质量为m2,即为根系的质量。根表土的质量m=m1-m2。
采用含有链霉素和利福平的PDA平板对抗性菌株进行回收,分别测定各样品中L1-9标记菌株的菌落数。出苗1周后开始,每隔6 d调查黄瓜枯萎病的发病率,计算防病效果。
防病效果=(对照的发病率-处理的发病率)/对照的发病率*100%。
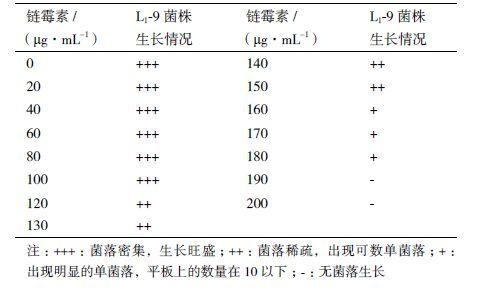
2 结果 2.1 L1-9菌株的抗性标记 2.1.1 抗链霉素菌株的筛选L1-9菌株在链霉素浓度为0-100 μg/mL的PDA平板上生长较好,菌落密集;浓度为120-150 μg/mL时,菌落较稀疏,出现了单菌落,浓度为160-180 μg/mL时,出现明显的单菌落,平板上的数量在10以下,链霉素浓度高于180 μg/mL时,L1-9菌株不能生长,结果见表 1。
将在浓度为160-190 μg/mL链霉素的平板上生长的L1-9菌株单菌落接种到含有高浓度链霉素的平板上连续培养,观察不同时间L1-9菌株的生长情况。实验结果表明在链霉素浓度为190 μg/mL时无菌落长出,浓度为180 μg/mL时,培养24 h和48 h无菌落长出,培养72 h有少量L1-9菌株菌落长出,菌落较小,生长较弱;在链霉素浓度为160和170 μg/mL的平板上,L1-9菌株在48 h长出较好菌落,连续观察菌落生长相对稳定。 因此,选择链霉素浓度为160 μg/mL作为L1-9菌株抗链霉素最佳浓度,用于进行抗利福平菌株的筛选。
2.1.2 抗链霉素L1-9菌株抗利福平的筛选 抗链霉素浓度为160 μg/mL的L1-9菌株在含有不同浓度利福平的平板上,随着利福平浓度增加长出的菌落数量明显减少,利福平浓度为10、15、20 μg/mL的平板上L1-9菌株生长良好,利福平浓度高于20 μg/mL时L1-9菌株不能生长。通过抗生素浓度梯度筛选得到的L1-9菌株双抗菌株命名为L1-9Str,rif,对链霉素和利福平的抗性浓度分别为160 μg/mL和20 μg/mL。
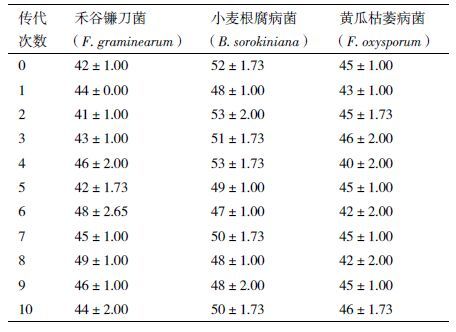
2.1.3 双抗菌株L1-9Str,rif的抗药、抑菌和传代稳定性L1-9Str,rif菌株在双抗培养基上连续转接传代10次,仍然生长良好,生长特性稳定,与原始菌株无差别;不同转接代数对供试的禾谷镰刀菌、小麦根腐病菌和黄瓜枯萎病菌具有较强抑制作用,抑菌带宽度无明显差异(表 2)。表明L1-9Str,rif菌株具有良好的遗传稳定性,可用于后续定殖研究。
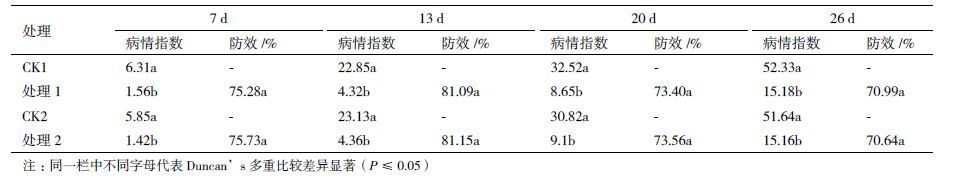
从表 3可以看出,标记菌株L1-9Str,rif和原始菌株L1-9在不同调查时期对黄瓜枯萎病均有较好的防病效果,防效均高于70 %,两菌株对黄瓜枯萎病的防病效果无明显差别。
用 L1-9原始菌株处理土壤的处理2以及相应的L1-9Str,rif菌株发酵培养基和PD培养基对照组(CK1和CK2)处理的土壤,在双抗平板上均未分离到L1-9菌株;用L1-9双抗菌株发酵液处理土壤的处理1,在黄瓜幼苗根系的各部位土壤中均分离到了L1-9菌株,说明L1-9菌株已被成功标记,且双抗菌株可用于海洋细菌L1-9菌株定殖规律研究。
从图 1可以看出,L1-9Str,rif菌株在根际、外根际和根表的定殖趋势不同。总体根表土壤中的菌量最高,可达1.76×109 CFU/g,其次是根际土壤,外根际土壤中的菌量较少。接种后0-7 d 的根际、外根际和根表土壤中L1-9Str,rif菌株的数量明显下降,但7 d后根表土壤的菌量开始增加,第10天菌量达到最高,为1.76×109 CFU/g,其后开始减少,第23天菌量较少;与根表相比,根际和外根际土壤中标记菌株的数量增加较为缓慢,从10 d后才有所增加,第13天菌落数才得到最高,分别为2.88×108 CFU/g和8.24×107 CFU/g,其后逐渐减少。

|
| 图 1 双抗菌株L1-9Str,rif在黄瓜土壤中的定殖规律 |
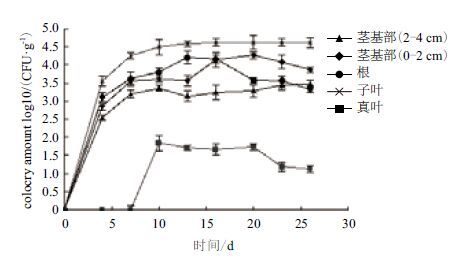
从图 2可知,从不同时期的黄瓜根、茎基部组织中均可以检测到L1-9Str,rif,在不同部位黄瓜组织中的定殖趋势类似。0-4 d不同部位组织的菌量较小,4 d后逐渐增加,至第13天、16天、20天根、子叶和茎(0-2 cm)中的菌量分别达到最高,分别为1.61×104 CFU/g,5.63×104 CFU/g,1.89×104 CFU/g,随后开始缓慢下降,随后趋于平稳。至第23天,L1-9Str,rif菌株在子叶中的含菌量仍然保持较高水平,说明L1-9Str,rif菌株在黄瓜组织中具有好的定殖能力。但L1-9Str,rif在不同组织中的菌量和达到高峰的时间明显不同。L1-9Str,rif在子叶中的菌量最高,其次是根和茎基部0-2 cm组织,在茎基部2-4 cm组织中较少,在真叶的含菌量最低。
|
| 图 2 不同时期黄瓜组织样品中L1-9菌株的分离结果 |
生防菌能在根围成功定殖是发挥生防作用的第一步,只有能够在土壤和植物根部中定殖的生防菌才能在实际生产中具有使用意义。生防菌的定殖能力与其自身遗传学特性和根部的分泌物相关,同时受植物和土著微生物种类及根际复杂的土壤环境等因素影响[15]。研究生防菌在植物根部的定殖能力,有助于认识生防细菌的作用机制,提高生防细菌的防治效果。
赵新海等[16]研究发现多黏类芽孢杆菌LICC 10427在黄瓜叶面和土壤中第5天达到最大定殖量,分别为2.3×106 CFU/g和1.6×107 CFU/g,在20-30 d抗性菌株的数量基本上趋于稳定,分别保持在0.9×106 CFU/g和0.9×107 CFU/g。海洋细菌L1-9菌株在根表土壤,根际土壤和外根际土壤中菌量最高分别为1.76×109 CFU/g,2.88×108 CFU/g和8.24×107 CFU/g明显多于LICC 10427菌株在土壤中的定殖量;而根、子叶和茎基部(0-2 cm)等黄瓜组织中的菌量最高分别为1.61×104 CFU/g,5.63×104 CFU/g和1.89×104 CFU/g比LICC 10427菌株在黄瓜叶面的定殖量小,定殖量不同可能与环境和拮抗菌自身因素有关。本研究结果显示至第26天时L1-9菌株在根部土壤中保持在相对稳定的水平,其中根表土壤中含菌量最高(仍可达2.41×107 CFU/g),在黄瓜组织样品中,子叶的含菌量最高(4.15×104 CFU/g),与LICC 10427菌株的定殖结果相一致,都在20 d后定殖量基本上趋于稳定。
黄瓜枯萎病是一种维管束病害,枯萎病菌从根部侵染黄瓜,然后沿维管束向上转移,因此该病害是一种比较难防治的病害。镰刀菌非致病株F047之所以具有较高的防效,其中一个重要原因就是该菌株可在植株内定殖,并且具有和枯萎病菌一样的生态位点,竞争枯萎病菌的营养和生态位点,从而抑制病原菌的扩展[17]。许多内生菌,如拮抗菌bio-d5、内生菌01-144和内生菌BPT-18不仅能在植物表面的附着位点扩展、繁殖,而且能在植物体内转移,并对特定部位有所偏好,表现出较强的亲和定殖能力,对维管束病害表现出良好的防治作用[18, 19]。
本研究中海洋细菌L1-9菌株不仅可以在黄瓜根部土壤中很好定殖,而且可以在黄瓜组织中定殖,并随着植株的生长从根向茎、叶转移,表明海洋细菌L1-9菌株具有较强的定殖能力和环境适应性。该菌株对黄瓜枯萎病防治效果也比较明显(可达70%)。关于海洋细菌L1-9菌株在田间环境条件下的适应性和对黄瓜枯萎病的防治效果尚需进一步明确。
4 结论海洋多黏类芽孢杆菌L1-9菌株能在黄瓜根部土壤及幼苗组织中定殖,在根部土壤中根表土壤含菌量最高,第7天达最大1.76×109 CFU/g,在其根、茎基部和子叶等幼苗组织中子叶的含菌量最高,第16天达最大为5.63×104 CFU/g;至第26天时在根部土壤中的含菌量仍保持在较高的水平,其中根表土壤中含菌量最高(2.41×107 CFU/g),在黄瓜组织样品中,子叶中的含菌量最高(4.15×104 CFU/g);对黄瓜枯萎病具有较高的防治效果,达70 %以上,是一株有潜力的黄瓜枯萎病生防菌株。
| [1] | 易龙, 张亚, 廖晓兰, 等. 蜡状芽孢杆菌次生代谢产物的研究进展[J]. 农药, 2013, 52(3): 162–164. |
| [2] | 叶晶晶, 曹宁宁, 吴建梅, 等. 生防芽孢杆菌的应用研究进展[J]. 西北农林科技大学学报, 2014, 42(8): 185–190. |
| [3] | Benizri E, Baudoin E, GuckerL A. Root colonization by inoculated plant growth-promoting rhizobacteria[J]. Biocontrol Science and Technology, 2001, 11(5): 557–574. |
| [4] | Alabouvette C, Olivain C, Steinberg C. Biological control of plant diseases:the European situation[J]. European Journal of Plant Pathology, 2006, 114(3): 329–341. |
| [5] | 马桂珍, 王淑芳, 暴增海, 等. 海洋细菌L1-9菌株对小麦的促生防病作用研究[J]. 中国生物防治学报, 2011, 27(2): 228–232. |
| [6] | 马桂珍, 付泓润, 王淑芳, 等. 海洋多黏类芽孢杆菌 L1-9 菌株发酵液抗菌谱及稳定性测定[J]. 海洋通报, 2013, 32(3): 316–320. |
| [7] | 马桂珍, 王淑芳, 暴增海, 等. 海洋多黏类芽孢杆菌L1-9菌株抗菌蛋白的分离纯化及其抗菌作用[J]. 食品科学, 2010, 31(17): 335–339. |
| [8] | Compant S, Clement C, Sessitsch A. Plant growth-promoting bacteria in the rhizo and endosphere of plants:their role, colonization, mechanisms involved and prospects for utilization[J]. Soil Biology and Biochemistry, 2010, 42: 669–678. |
| [9] | Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases:principles, mechanisms of action, and future prospects[J]. Applied and Environmental Miorobiology, 2005, 71(9): 4951–4959. |
| [10] | 杨洪凤, 薛雅蓉, 余向阳, 等. 内生解淀粉芽孢杆菌CC09菌株在小麦叶部的定殖能力及其防治自粉病效果研究[J]. 中国生物防治学报, 2014, 30(4): 481–488. |
| [11] | 王静, 常平, 孔凡玉, 等. 拮抗细菌AR03在烟草根部及根际土壤中的定殖与鉴定[J]. 中国烟草科学, 2010, 31(3): 45–48. |
| [12] | 游春平, 刘任, 肖爱萍, 等. 拮抗细菌Bio-d5在香蕉根部定殖能力的测定[J]. 华中农业大学学报, 2008, 27(3): 363–366. |
| [13] | 王希, 暴增海, 马桂珍, 等. 海洋多黏类芽孢杆菌L1-9菌株对黄瓜的促生作用和诱导抗性研究[J]. 北方园艺, 2014, (21): 133–137. |
| [14] | 涂璇, 薛泉宏, 张宁燕, 等. 辣椒疫病生防放线菌筛选及其对辣椒根系微生物区系的影响[J]. 西北农林科技大学学报:自然科学版, 2007, 35(6): 141–146. |
| [15] | 张炳欣, 张平, 陈晓斌. 影响引入微生物根部定殖的因素[J]. 应用生态学报, 2000, 11(6): 951–953. |
| [16] | 赵新海, 钟丽娟, 张庆华, 等. 多黏类芽孢杆菌在黄瓜叶面和土壤中定殖能力及其对土壤微生物的影响[J]. 世界农药, 2009, 31(5): 25–27. |
| [17] | 张琴芳, 代光辉, 顾振芳, 等. 非致病性镰刀菌Fusarium oxysporum 菌株FO47对番茄枯萎病的防治效果[J]. 上海交通大学学报:农业科学版, 2004, 22(1): 17–21. |
| [18] | 龙良鲲, 肖崇刚. 内生细菌01-144在番茄根茎内定殖的初步研究[J]. 微生物学通报, 2003, 30(5): 53–56. |
| [19] | 张铎, 陶秀娥, 梁艳, 等. 黄瓜枯萎病拮抗内生菌BPT-18的鉴定及抗菌物质的性质[J]. 农药, 2012, 51(6): 464–467. |