2. 华北理工大学理学院,唐山 063009
2. College of Science,North China University of Science and Technology,Tangshan 063009
随着生命科学的蓬勃发展,人们对生命科学的研究已逐步从宏观深入到微观,从群体走向了个体,甚至单细胞水平。传统植物细胞分析方法是将种子或者植物细胞培养在土壤或者琼脂平板上,然后观察植物的表型。这些方法简单、易于操作,但是也有一些弊端。首先,传统方法成本高、实验周期长、实验也很难定量化;其次,植物细胞在固体培养基上生长行为具有无规律性,以致很难从一个特定的方向观察植物;另外,传统研究方法的时间和空间分辨率低,也可能会导致在观察植物表型改变过程中的信息丢失;最后,植物在固体培养基上无序的生长行为也很难详细地分析植物的生长情况[1, 2]。
近年来,科学技术的发展给植物细胞的研究注入了新的动力,膜片钳[3]、激光辅助显微切割[4]、三维共培养[5]等技术都已经引入到植物细胞的研究中来。微流控芯片技术是一种能精确控制和操控微尺度流体的新颖微机电技术,具有体积小(纳升、皮升和飞升级别)、消耗低、装置小、高密度、大规模、高通量和多功能等特点[6, 7],与宏观尺度的实验装置相比,这一技术显著降低了样品的消耗量,增大了流体的比表面积,提高了反应效率,也降低了实验成本;同时通过微阀微泵等微细结构的精确控制,微流控芯片使生命科学研究在时间与空间分辨率上也有了很大提高[8]。尽管目前微流控芯片的研究大部分仍然集中在动物细胞[9, 10],但是微流控芯片在植物细胞研究中的应用也已日趋成熟,主要包括植物细胞的表现型研究和化学药物的刺激性等[11-13]。由于微流控芯片技术具有微米甚至纳米级的高分辨率,使得微流控芯片可以模仿植物细胞内的微环境,这不仅为植物细胞学的研究提供了新的视角和方法,而且具有许多传统植物细胞研究方法不可比拟的优势。本文概括了用于微流控芯片加工的材料和方法,总结了用于植物细胞研究的微流控芯片,重点介绍了近年来微流控芯片在植物细胞学研究中的应用,并对微流控芯片在植物细胞研究的前景进行了展望。
1 微流控芯片简介微流控芯片是一种以在微米尺度空间对流体进行操控为主要特征的科学技术,具有将化学和生物实验室的基本功能微缩到一个几平方厘米大小芯片上的能力,因此又称为芯片实验室。由于它在生物、化学、医学等领域的巨大潜力,已经发展成为一个生物、化学、医学、流体、电子、材料及机械等学科交叉的崭新研究领域[14-16]。
1.1 微流控芯片的加工材料微流控芯片经过10多年的快速发展,用于微流控芯片的加工材料已经从早期的硅和玻璃发展到今天的各种高分子聚合物,如聚二甲基硅氧烷(polydimethylsiloxane,PDMS)、聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)、聚碳酸酯(polycarbonate,PC)、聚苯乙烯(polystyrene,PS)、聚苯乙烯二乙醚(polypheylene ether,PPE)等。表 1列出了不同材料制备微流控芯片的一些优缺点,从表中可以看出,聚合物材料的光学性质好、易于加工且价格低廉,目前已经成为微流控芯片制备的主要材料[17]。其中PDMS又是目前聚合物中用的最多的一种,其具有如下优势:(1)能够透过250 nm以上的紫外与可见光,透气,耐用又廉价;(2)有一定的化学惰性,芯片微通道的表面可以进行多种修饰改造,能够可逆和重复变形而不发生永久性破坏;(3)能用模塑法高保真的复制微流控芯片,不仅可与自身可逆结合,还能与玻璃、硅、二氧化硅和氧化型多聚物可逆结合。因而PDMS被广泛应用到了植物微流控芯片的制作中。
在微流控芯片研究早期,至少有20种不同的方法被用于微流控芯片的制备,主要包括光刻、化学腐蚀、电化学腐蚀、离子束刻蚀、化学气相沉积、物理气相沉积和外延等。这些基于硅和玻璃类的微流控芯片制备工艺虽然相对成熟,但微流控芯片的成本却相对昂贵。近年来PDMS芯片被广泛应用,其制备过程主要分为两步:模具的制备和芯片的成型[17-19]。
1.2.1 模具的制备(1) 掩膜的设计与制作:掩膜的设计与制作是芯片制作过程中的关键工艺之一,其主要功能是实现对光的选择性透过和图形的精确复制。常规掩膜板的基材一般为熔融石英,这种材料对紫外光具有高的光学透射,而且具有较低的温度膨胀和低的内部缺陷,通常采用物理镀膜方法在基材上溅射一层铬,在铬层上面需要涂布一层抗反射涂层。(2) 曝光:曝光的主要目的是将掩膜上的微结构图形精确地转移到光胶层上,使得光刻胶的感光部位发生光化学反应。以负光刻胶SU-8为例,曝光时,因为光刻胶中的光引发剂——三苯基硫盐吸收光子发生光化学反应,生成一种强酸,在随后中烘过程中作为催化剂促进热交联反应的发生,形成致密的交联网络结构,从而不溶于显影液中。而未曝光的区域因为没有生成强酸,不发生交联反应而溶于显影液中[20]。(3) 芯片的刻蚀:刻蚀是利用光刻工艺处理后的光刻胶作为保护层,通过化学或者物理方法将被刻蚀物质除去,从而得到所期望图形的方法,根据刻蚀剂的状态不同,可以将刻蚀工艺分为湿法刻蚀与干法刻 蚀。(4) 模具的成型:模具成型还需要去胶、去铬、清洗和干燥等步骤。
1.2.2 PDMS芯片的成型首先是基片的制作,将PDMS基质与固化物按照质量1∶10的比例进行混合,用一次性勺子顺时针搅拌30 min,充分搅拌均匀,为了防止PDMS固化后气泡进入,通常对PDMS预聚合物脱气处理15 min左右。将处理好的PDMS预聚物浇注于模具中,控制反应温度为60℃,固化时间2 h,用手术刀将固化后的混合物沿着模板切割,可得PDMS基片,再用打孔器在PDMS上打孔。其次是盖片的制作,PDMS盖片在一培养皿中浇注而成,盖片按基片的尺寸剪裁、打孔,用作样品引入口和储液池。最后将基片和盖片对合就制成了PDMS芯片。

|
|
图 1 PDMS 微流控芯片制作示意图
|
近年来,微流控芯片已经逐渐引入到植物细胞的研究中,并发挥着独特的作用。通过归纳总结,本文将微流控芯片在植物细胞学中的应用主要分为六类:植物根的研究、花粉管的研究、污染物对植物毒性的研究、植物原生质体的研究、细胞壁的生物力学研究和其它研究。
2.1 用于植物细胞研究的微流控芯片随着微流控芯片技术的发展,越来越多的微流控芯片被应用到植物细胞的研究中,表 2展示了当前应用于植物细胞学研究中的主要微流控芯片,概括了其在植物细胞学中的应用,并与传统方法进行了比较。
根是植物重要的组成部分,一方面,它的作用是从环境中吸收水和养分[32, 33],因此根对脱水环境和物理化学刺激非常敏感;另一方面,根也存在高度的可塑性,能够采取一定的策略来应对外部环境变化[34]。研究植物生长的分子机制需要一个体外研究平台,在研究过程中为了提高实验结果的高效性,获取植物表型等相关信息,在这个过程中需要考虑一些重要的参数。例如,生长环境的稳定性、改变环境条件后实验的再现性和重复性等。研究根生长的分子机制还需要提供一个细胞水平分辨率的微环境,并且能够精确控制植物根生长的环境条件。传统的工具——灌流生物反应器[35]和96孔板[36]不具备高通量的特性并且不能精准控制环境变化。化学探针方法可以精确控制环境条件,但局限在静态的离子分析,并且由于限制了探针的位置,获取的图形分辨率低。植物根的微流控芯片(Rootchip)能够提供一个可控的微环境来研究根的生理机能,并且具备高通量的特性[37, 38]。Grossmann等和Okumoto[38, 39]设计了如图 2所示的植物根芯片用来研究植物根的生长情况,首先把拟南芥的种子生长在充满琼脂的锥形圆筒内,使根在重力作用下向下生长并通过塑料圆筒,当根生长到接口处时其生长方向从垂直转变为水平状态,然后通过镶嵌的树杈型分支结构到达观察室(观察室中的根是独立生长的),最后在芯片内实时观测根的生长情况。这个系统的独特之处主要表现在两个方面:一方面,可以实现培养基的瞬时灌注;另一方面,可以进行无损的代谢物检测。此芯片还可以用于研究根特定部位的吸收情况,如根毛细胞等。在设计上稍微改变后也可以应用到其他的植物种类。
微流控芯片技术与先进的生物感应器结合后,可以用来实时检测植物根内自由金属离子的浓度[40]。为了更好地阐述金属离子在植物体内的平衡信号,Clara等和Lanquar[41, 42]将根微流控芯片和荧光能量共振转移(fluorescence resonance energy transfer,FRET)结合用于分析了植物细胞内Zn2+的分布和动力学,其方法是将一系列FRET感应器放到生长在可视根微流控芯片内的植物细胞中,研究发现细胞质内的Zn2+浓度受外界Zn2+的供应影响且变化在pmol/L-nmol/L这样很小的范围内,他们利用此方法也发现了两个Zn2+吸收系统。继根芯片之后,Busch等[22]又发明了根阵列芯片,根阵列芯片是一种更高效的高通量微流控芯片,在根阵列芯片中可以同时研究64个拟南芥根在时间和空间上的基因表达情况。
植物的根与外部环境存在相互作用,要研究植物内部细胞如何应对外部的信号需要较高的时空分辨率,然而传统分析方法的空间分辨率仅局限于毫米水平[44]。另外,在根生长过程中根周围的固体培养基化学成分不能维持稳定且不能精确量化。微流控技术可以通过对正在延长根的特定位点给予不同化学处理,如氮、磷、盐和其他植物激素等,从而帮助我们更好地理解根的发育机制。此后,Meier等[45]又设计了用于特定位点处理的微流控芯片,如图 3所示,中间刺激物的流体直径在5-90 μm范围内可变。把生长中的拟南芥根放在微流控芯片内,只有特定的部位暴露于化学刺激中。通过改变3个层流溶液的组成和流速,能够运输不同的化学刺激并且准确控制根刺激部位的大小,从而提供高的空间分辨率。并且与传统的固体培养基方法相比,随着根的生长,根的刺激物浓度不会随着时间而发生改变。为了检验层流微流控芯片的效果,作者还将植物激素的衍生物2,4-二氯苯氧乙酸(2,4-D)和它的抑制物N-1-萘基酞氨酸(NPA)流经设定的拟南芥根部位,然后检测植物激素流经部位的绿色荧光蛋白表达水平。实验证明2,4-D提高了根形态的改变,如根毛的生长。这进一步说明了微流控芯片能够在植物的特点位点给予相应的刺激,具有较高的时空分辨率。
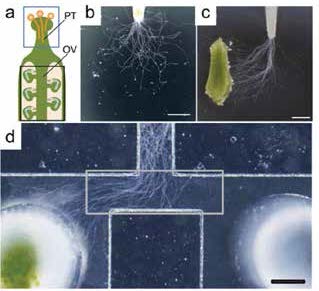
2.3 花粉管的研究植物的顶端生长细胞能保持旺盛的分裂能力,是植物生长的重要原因。花粉管是一个快速生长的顶端生长植物细胞[46],它在开花植物的生命循环中起着重要的作用。它同时也是对化学信号非常敏感的植物细胞模型,可以通过改变生长速度和延长方向来应对外界的刺激[47, 48]。现在普遍认为花粉管的生长活动由它的顶端控制,通过调控细胞内的运输和信号机制来维持它的极性生长[49-52]。花粉管生长在自然环境和类似的环境总呈现出对称生长(图 4-B),当花粉管暴露在不对称的刺激物时,刺激物可打破它的对称生长(图 4-C)。这些刺激可能是胚珠通过产生电信号或者化学信号用来吸引或者排斥花粉管[31, 53]。人们一直对改变花粉管生长方向的物质以及外部化学信号调控细胞内的生长机制很感兴趣。Arata等[27]设计出了一个T型的微流控芯片(图 4-D),拟南芥的花粉管在中间约500 μm的微流控通道内生长,在通道左下角的小室内放置未受精的胚珠,右下角的小室内进行空白对照,结果显示由于胚珠分泌了某种化学物质,拟南芥的花粉管向着未受精的胚珠方向不对称生长。同传统固体培养基上花粉管成辐射状生长相比,由于芯片通道的限制,花粉管只能向左或向右生长,因此能更直观地对花粉管的生长方向进行观察和检测。
虽然上面的实验能直观地证明引起花粉管不对称生长的物质是来自胚珠的,然而这种诱导物质的精准浓度是很难检测的。为了进一步研究花粉管生长方向的机制,我们需要明确诱导物的组成以及精确控制它的浓度。由于微流控通道内流体的雷诺数很小(Re<1),微通道内的流体仅能够通过分子扩散混合,因此微流控芯片可以提供稳定的层流[54]。通过调节流速和扩散系数,两条液体流之间的界面能够被调整到不同的细胞生长区域并提供准确的浓度。Agudelo等[23]就用此微流控芯片定量研究了Ca2+对花粉管的影响。
2.4 污染物对植物毒性的研究过去的几十年中,人们已经逐渐意识到研究环境污染物和有毒物质对植物的影响意义重大,然而精准判断具体污染物种类却依然是一个难题。一方面,不同种类的植物对同一污染物存在不同的半最大浓度效应(EC50);另一方面,植物通常生长在不同的混合污染物中,鉴定出具体某一种污染物对植物的影响依然是一个挑战。要解决这个难题在实验技术上需要大量独立实验和相当大体积的毒性试剂,因此,建立以环境污染物对植物影响为基础的高通量平台具有很广泛的前景。微流控芯片技术具备快速稳定改变培养基成分的能力和高通量的潜能,并且已经应用到了药物研发和细胞研究当中。
通过在微流控芯片内改变培养基成分,研究有毒物质对植物细胞和一些植物微小器官的影响已经在微流控芯片中得到验证。小球藻是大气中氧气的主要生产者之一,对生态系统非常重要。除藻剂和含重金属的化学物质等污染物能够改变藻类的数量,从而影响生态系统中氧气的供应量。为了检测有毒成分对小球藻的影响,Küersten等[55]把小球藻培养在了微流控芯片中,并通过350个流体分段做了除藻剂中CuCl2对藻类影响的剂量依赖型分析,通过微流控系统中的光度计测出CuCl2对小球藻的半最大浓度效应(EC50)。这种方法测得结果与通过微量滴定板获得的数据是一致的。
植物的根和花粉管是植物最敏感的部分,通常用于检测环境中污染物和不同污染物对植物的发育能力。微流控芯片能成功检测出在改变根生长微环境情况下根的生长情况[22, 37]。同时,花粉管实验也证明对花粉管有毒性的材料对动物也存在毒性。这暗示研究有毒物质对花粉管的影响在研究有毒物质对人类影响的过程中具有潜在意义[56]。
2.5 植物原生质体的研究原生质体由于去除了细胞壁,可以摄入细胞器、微粒体、病毒及一些大分子物质(如DNA等),这种摄入能力,有助于我们广泛研究遗传物质的导入和表达,而且也易于转化体和重组体在可控制的条件下的准确的操作及分析。因此,原生质体已经作为进行植物基因重组、离体基因遗传转化等操作较为理想的实验体系,成为分子水平和细胞水平上研究遗传信息动态的结合点,同时是研究植物生长调节、代谢及其它植物生理过程的有力材料。植物原生质体培养是指将分离纯化干净的植物原生质体接种于培养基中,在一定温度及光照等条件下,使原生质体重新形成细胞壁,并不断进行分裂生长,形成肉眼可见的细胞团或再生出植株的培养过程。原生质体再生不但是细胞融合的基本条件,也是基因导入、突变体筛选的前提。
微流控芯片也逐渐应用到植物细胞原生质体的培养和细胞融合等细胞生物学研究领域。与传统的组织培养相比,微流控芯片内培养植物原生质体具有很多优势。首先,传统植物细胞的培养需要消耗大量的培养基和较大的细胞储存空间,而微流控芯片技术能够精准控制培养基的流动且需要较少的细胞数量,使细胞和细胞因子维持在一个可控的水平[57, 58];其次,微流控芯片与分析装置结合后能够更好地观察和阐释某些细胞生物学过程[59, 60]。Ju等[61]利用微流控芯片成功地培养了烟草的原生质体。武恒(Wu)等[29]设计了如图 5所示的一个由5个五边形微室结构组成的微流控芯片,在这个芯片上进行烟草叶肉原生质体及小白菜无菌苗原生质体的培养,实验显示,在芯片内培养的烟草叶肉原生质体,无论在启动分裂还是形成细胞团,都要比传统培养方法下生长的速度要快近一天左右。同时在这个芯片上也实现了培养基的最优化和原生质体生长动力学的实时观测,而且化学介导的烟草叶肉细胞原生质体融合也得到实现。
在植物中,不同物种之间的原生质体融合能够更好地研究基因修饰和植物育种。融合首先是在两个植物细胞的原生质体上产生两个小孔,然后在表面张力的作用下融合成一个细胞。在体外众多的细胞融合技术当中,因为电融合有一个安全的融合过程,已经被广泛应用到各种类型的细胞融合中[62]。传统的电融合由于缺少操纵单个细胞的控制系统,所以需要大量的细胞。而集成的微流控芯片能够可控的在单细胞水平进行电融合操作,因此需要的细胞大大减少,已经成功应用到5种不同的植物物种的细胞电融合中,包括拟南芥、烟草、滨海前胡、珊瑚菜和油菜[30]。
细胞壁是植物细胞外一层主要由多糖组成的结构,对植物的发育和生长非常重要。研究模式植物细胞的生长需要定量研究细胞壁的机械性质。由于单个细胞尺寸微小,直接测量细胞壁的机械学特性目前仍然是一种挑战[45]。传统的方法是通过拉力实验和压力探针法进行检测[63-65],这些方法对细胞具有侵袭性并且是在假定细胞壁机械性能分布一致下测得的。然而细胞膜最脆弱的部分可能会控制整体的细胞行为,所以这些方法是间接且不稳定的测量方法。随着显微压痕和电子力学显微镜在植物细胞研究领域的应用,使得在亚细胞分辨率水平鉴定细胞壁的机械性质取得成功[66]。然而,这种方法是基于测量材料的等向性和均匀性的假设,采用的是特定位点的压缩和渗透,继而测得杨氏横量。因此这些方法也不能很好说明整个细胞壁的拉伸性能等重要特性。在测量细胞壁拉伸强度过程中,个体微小的细胞需要承受拉伸和弯曲这样技术上的挑战[67]。
最近,Nezhad等[68]设计了一个叫做Bending-Lab-On-a-chip(BLOC)(图 6)的微流控芯片并且应用到植物细胞的弯曲实验中,测量了细胞壁的杨氏横量。他们首先将花粉粒的悬浮液放入芯片中,使花粉管沿着微小的生长通道延长,当花粉管长到底部的时候就暴露在弯曲的负载中,然后通过测量花粉管的偏离情况,再利用一个数学模型就可以进行计算,从而获得细胞壁的杨氏横量。通过这种方法测量的结果和通过压力探针等方法测得是一致的,但是这个技术直接地测量了细胞壁的弹性系数,能够更全方位地测量细胞壁机械性能且特定位点细胞壁的机械性能是各向异性的,因此在测量细胞壁整体的机械性能上具有优势。
微流控芯片在植物细胞学领域的应用是广泛的,除了上述的应用外,也应用到了其他的植物细胞生物学的研究当中。例如,用微流控芯片研究植物细胞是否存在方向记忆性[28],其方法是将花粉管培育在一个螺旋状的微流控通道内,研究发现只有当花粉管触碰到微流控通道内壁时才会改变其生长方向,这意味着如果没有微通道内壁花粉管会沿着原来的方向持续生长。当花粉管生长到螺旋外暴漏在一个宽敞空间的时候,花粉管将保持它原来的生长方向不变并且和最初花粉粒萌发的方向无关,此“方向记忆”芯片能够提供亚细胞水平的微环境,而传统的方法不具备这样的能力。微流控芯片也应用到了植物根和芽的表型[69]、检测植物细胞缺陷的研究[70]、植物和细菌的相互作用[71]等研究中。但是微流控芯片在植物细胞学中的应用远不止于此,随着研究的深入和科学的发展,微流控芯片技术一定能发挥更大的作用。
3 展望微流控芯片在植物细胞学的研究中显著地提高了实验的效率和结果分辨率,在特定位点处理植物细胞、植物细胞壁动力学研究、植物原生质体的培养和融合让我们更深一步地理解了一些生物学问题。虽然相对于传统的研究手段已经取得了很大进步,但是在植物细胞学的研究当中依然存在着许多问题亟待我们去解决。例如:(1)根的共区域化研究、突变体的筛选、自然环境下的变异和应用不同的细胞壁染料高通量研究植物的生长特点;(2)在药物或者毒性的条件下定量研究植物细胞壁的机械性质;(3)植物细胞的入侵生活方式等。这些挑战还需要利用一些更有效的方法来研究。
尽管近几年微流控芯片技术已经越来越多地应用到了植物细胞学的研究当中,但与芯片在动物细胞中的研究相比仍然具有很大的差距,因此微流控芯片在植物细胞学中的应用还有很大的发展空间,这就需要我们研究出一些更新的微流控平台。总之作为一种高度集成化、微型化以及智能化的生化分析平台,微流控芯片将对人类的生活产生极其广泛、深远的影响,甚至可能会给生命科学领域和生化分析领域带来一场革命。
| [1] | 赵东杰. 植物细胞电信号高空间分辨率信息获取及分析方法研究[D] . 北京:中国农业大学, 2014. |
| [2] | 翟新. 物理方法破裂植物细胞壁的力学模型研究[D]. 无锡:江南大学, 2013. |
| [3] | 罗洁. 基于逆问题的膜片钳新技术研究[D]. 武汉:华中科技大学, 2012. |
| [4] | 王晓玲. 激光辅助显微切割技术分离植物细胞研究进展[J]. 现代农业科技, 2008, (11): 99. |
| [5] | 赵毅, 刘刚, 蔡绍皙, 等. 基于微流控芯片构建的肿瘤细胞三维共培养模型[J]. 科学通报, 2014, (28): 2868–2876. |
| [6] | 林炳承, 秦建华. 图解微流控芯片实验室[M]. 北京: 科学出版社, 2008. |
| [7] | Jayamohan H, Smith YR, Hansen LC, et al. Anodized titania nanotube array microfluidic device for photocatalytic application:experiment and simulation[J]. Applied Catalysis B:Environmental, 2015, 174: 167–175. |
| [8] | Yao X, Zhang Y, Du L, et al. Review of the applications of microreactors[J]. Renewable and Sustainable Energy Reviews, 2015, 47: 519–539. |
| [9] | Martel JM, Smith KC, Dlamini M, et al. Continuous flow microfluidic bioparticle concentrator[J]. Sci Rep, 2015, 5: 11300. |
| [10] | Lin C, Ballinger KR, Khetani SR. The application of engineered liver tissues for novel drug discovery[J]. Expert Opinion on Drug Discovery, 2015, 10(5): 519–540. |
| [11] | Lucchetta EM, Lee JH, Fu LA, et al. Dynamics of Drosophila embryonic patterning network perturbed in space and time using microfluidics[J]. Nature, 2005, 434(7037): 1134–1138. |
| [12] | Samara C, Rohde CB, Gilleland CL, et al. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration[J]. Proceedings of the National Academy of Sciences, 2010, 107(43): 18342–18347. |
| [13] | Gilleland CL, Rohde CB, Zeng F, et al. Microfluidic immobilization of physiologically active Caenorhabditis elegans[J]. Nature Protocols, 2010, 5(12): 1888–1902. |
| [14] | 王虎, 魏俊峰, 郑国侠. 微流控芯片在水环境污染分析中的应用[J]. 应用生态学报, 2014, 25(4): 1231–1238. |
| [15] | 王立凯, 冯喜增. 微流控芯片技术在生命科学研究中的应用[J]. 化学进展, 2005, 17(3): 482–498. |
| [16] | 赵亮, 申洁, 周宏伟, 等. 集成微流控芯片[J]. 科学通报, 2011, 56(23): 1855–1870. |
| [17] | 夏飞. PDMS 微流控芯片的制备工艺研究[D]. 南京:南京理工大学, 2010. |
| [18] | 高菊逸. 简易型微流控芯片的研制及其在临床诊断中的应用[D]. 南昌:南昌大学, 2014. |
| [19] | 殷学锋, 沈宏. 制造玻璃微流控芯片的简易加工技术[J]. 分析化学, 2003, 31(1): 116–119. |
| [20] | 吕春华. 基于 SU-8 负光胶的微流控芯片加工技术的研究[D]. 杭州:浙江大学, 2007. |
| [21] | Grossmann G, Guo WJ, Ehrhardt DW, et al. The RootChip:an integrated microfluidic chip for plant science[J]. Plant Cell, 2011, 23(12): 4234–4240. |
| [22] | Busch W, Moore BT, Martsberger B, et al. A microfluidic device and computational platform for high-throughput live imaging of gene expression[J]. Nature Methods, 2012, 9(11): 1101–1106. |
| [23] | Agudelo CG, Sanati Nezhad A, Ghanbari M, et al. TipChip:a modular, MEMS based platform for experimentation and phenotyping of tip-growing cells[J]. The Plant Journal, 2013, 73(6): 1057–1068. |
| [24] | Nezhad AS, Ghanbari M, Agudelo CG, et al. Optimization of flow assisted entrapment of pollen grains in a microfluidic platform for tip growth analysis[J]. Biomedical Microdevices, 2014, 16(1): 23–33. |
| [25] | Horade M, Yanagisawa N, Mizuta Y, et al. Growth assay of individual pollen tubes arrayed by microchannel device[J]. Microelectronic Engineering, 2014, 118: 25–28. |
| [26] | Nezhad AS, Packirisamy M, Bhat R, et al. In vitro study of oscillatory growth dynamics of Camellia pollen tubes in microfluidic environment[J]. Biomedical Engineering, IEEE Transactions on, 2013, 60(11): 3185–3193. |
| [27] | Arata H, Higashiyama T. Poly(dimethylsiloxane)-based microdevices for studying plant reproduction[J]. Biochemical Society Transactions, 2014, 42: 320–324. |
| [28] | Held M, Edwards C, Nicolau DV. Probing the growth dynamics of Neurospora crassa with microfluidic structures[J]. Fungal Biology, 2011, 115(6): 493–505. |
| [29] | Wu H, Liu WM, Tu Q, et al. Culture and chemical-induced fusion of tobacco mesophyll protoplasts in a microfluidic device[J]. Microfluidics and Nanofluidics, 2011, 10(4): 867–876. |
| [30] | Ju J, Ko JM, Cha HC, et al. An electrofusion chip with a cell delivery system driven by surface tension[J]. Journal of Micromechanics and Microengineering, 2009, 19(1): 015004. |
| [31] | Yetisen A, Jiang L, Cooper J, et al. A microsystem-based assay for studying pollen tube guidance in plant reproduction[J]. Journal of Micromechanics and Microengineering, 2011, 21(5): 054018. |
| [32] | Casimiro I, Beeckman T, Graham N, et al. Dissecting Arabidopsis lateral root development[J]. Trends in Plant Science, 2003, 8(4): 165–171. |
| [33] | Malamy J. Intrinsic and environmental response pathways that regulate root system architecture[J]. Plant, Cell & Environment, 2005, 28(1): 67–77. |
| [34] | Walter A, Silk WK, Schurr U. Environmental effects on spatial and temporal patterns of leaf and root growth[J]. Annual Review of Plant Biology, 2009, 60: 279–304. |
| [35] | Chaudhuri B, Hörmann F, Frommer WB. Dynamic imaging of glucose flux impedance using FRET sensors in wild-type Arabidopsis plants[J]. Journal of Experimental Botany, 2011, 62(7): 2411–2417. |
| [36] | Bassel GW, Fung P, Chow TF, et al. Elucidating the germination transcriptional program using small molecules[J]. Plant Physiology, 2008, 147(1): 143–155. |
| [37] | Grossmann G, Guo WJ, Ehrhardt DW, et al. The RootChip:an integrated microfluidic chip for plant science[J]. The Plant Cell Online, 2011, 23(12): 4234–4240. |
| [38] | Grossmann G, Meier M, Cartwright HN, et al. Time-lapse fluorescence imaging of Arabidopsis root growth with rapid manipulation of the root environment using the RootChip[J]. Journal of Visualized Experiments, 2012, (65): e4290. |
| [39] | Okumoto S. Imaging approach for monitoring cellular metabolites and ions using genetically encoded biosensors[J]. Current Opinion in Biotechnology, 2010, 21(1): 45–54. |
| [40] | Lanquar V, Lelièvre F, Bolte S, et al. Mobilization of vacuolar iron by AtNRAMP3 and AtNRAMP4 is essential for seed germination on low iron[J]. The EMBO Journal, 2005, 24(23): 4041–4051. |
| [41] | Clara B, Jennifer CE, Viviane L, et al. In vivo biochemistry:quantifying ion and metabolite levels in individual cells or cultures of yeast[J]. Biochemical Journal, 2011, 438(1): 1–10. |
| [42] | Lanquar V, Grossmann G, Vinkenborg JL, et al. Dynamic imaging of cytosolic zinc in Arabidopsis roots combining FRET sensors and RootChip technology[J]. New Phytologist, 2014, 202(1): 198–208. |
| [43] | Nezhad AS. Microfluidic platforms for plant cells studies[J]. Lab on a Chip, 2014, 14(17): 3262–3274. |
| [44] | Zhang H, Forde BG. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture[J]. Science, 1998, 279(5349): 407–409. |
| [45] | Meier M, Lucchetta EM, Ismagilov RF. Chemical stimulation of the Arabidopsis thaliana root using multi-laminar flow on a microfluidic chip[J]. Lab on a Chip, 2010, 10(16): 2147–2153. |
| [46] | Escobar-Restrepo JM, Huck N, Kessler S, et al. The FERONIA receptor-like kinase mediates male-female interactions during pollen tube reception[J]. Science, 2007, 317(5838): 656–660. |
| [47] | Cheung AY, Wu HM. Structural and signaling networks for the polar cell growth machinery in pollen tubes[J]. Annu Rev Plant Biol, 2008, 59: 547–572. |
| [48] | Bou Daher F, Geitmann A. Actin is involved in pollen tube tropism through redefining the spatial targeting of secretory vesicles[J]. Traffic, 2011, 12(11): 1537–1551. |
| [49] | Chebli Y, Geitmann A. Mechanical principles governing pollen tube growth[J]. Functional Plant Science and Biotechnology, 2007, 1(2): 232–245. |
| [50] | Geitmann A, Ortega JK. Mechanics and modeling of plant cell growth[J]. Trends in Plant Science, 2009, 14(9): 467–478. |
| [51] | Hepler PK, Vidali L, Cheung AY. Polarized cell growth in higher plants[J]. Annual Review of Cell and Developmental Biology, 2001, 17(1): 159–187. |
| [52] | Kost B. Spatial control of Rho(Rac-Rop)signaling in tip-growing plant cells[J]. Trends in Cell Biology, 2008, 18(3): 119–127. |
| [53] | Bove J, Vaillancourt B, Kroeger J, et al. Magnitude and direction of vesicle dynamics in growing pollen tubes using spatiotemporal image correlation spectroscopy and fluorescence recovery after photobleaching[J]. Plant Physiology, 2008, 147(4): 1646–1658. |
| [54] | Knight JB, Vishwanath A, Brody JP, et al. Hydrodynamic focusing on a silicon chip:mixing nanoliters in microseconds[J]. Physical Review Letters, 1998, 80(17): 3863–3866. |
| [55] | Kürsten D, Cao J, Funfak A, et al. Cultivation of Chlorella vulgaris in microfluid segments and microtoxicological determination of their sensitivity against CuCl2 in the nanoliter range[J]. Engineering in Life Sciences, 2011, 11(6): 580–587. |
| [56] | Barile F, Dierickx P, Kristen U. In vitro cytotoxicity testing for prediction of acute human toxicity[J]. Cell biology and toxicology, 1994, 10(3): 155–162. |
| [57] | Lee CC, Sui G, Elizarov A, et al. Multistep synthesis of a radiolabeled imaging probe using integrated microfluidics[J]. Science, 2005, 310(5755): 1793–1796. |
| [58] | Ma B, Zhang G, Qin J, et al. Characterization of drug metabolites and cytotoxicity assay simultaneously using an integrated microfluidic device[J]. Lab on a Chip, 2009, 9(2): 232–238. |
| [59] | Kirkness EF. Targeted sequencing with microfluidics[J]. Nature Biotechnology, 2009, 27(11): 998–999. |
| [60] | Park ES, Brown AC, Difeo MA, et al. Continuously perfused, non-cross-contaminating microfluidic chamber array for studying cellular responses to orthogonal combinations of matrix and soluble signals[J]. Lab on a Chip, 2010, 10(5): 571–580. |
| [61] | Ju JI, Ko JM, Kim SH, et al. Soft material-based microculture system having air permeable cover sheet for the protoplast culture of Nicotiana tabacum[J]. Bioprocess and Biosystems Engineering, 2006, 29(3): 163–168. |
| [62] | Negrutiu I, De Brouwer D, Watts J, et al. Fusion of plant protoplasts:a study using auxotrophic mutants of Nicotiana plumbaginifolia, Viviani[J]. Theoretical and Applied Genetics, 1986, 72(2): 279–286. |
| [63] | Tomos AD, Leigh RA. The pressure probe:a versatile tool in plant cell physiology[J]. Annual Review of Plant Biology, 1999, 50(1): 447–472. |
| [64] | Wang L, Hukin D, Pritchard J, et al. Comparison of plant cell turgor pressure measurement by pressure probe and micromanipulation[J]. Biotechnology Letters, 2006, 28(15): 1147–1150. |
| [65] | Cosgrove DJ. Wall extensibility:its nature, measurement and relationship to plant cell growth[J]. New Phytologist, 1993, 124(1): 1–23. |
| [66] | Routier-Kierzkowska AL, Weber A, Kochova P, et al. Cellular force microscopy for in vivo measurements of plant tissue mechanics[J]. Plant Physiology, 2012, 158(4): 1514–1522. |
| [67] | Wei C, Lintilhac LS, Lintilhac PM. Loss of stability, pH, and the anisotropic extensibility of Chara cell walls[J]. Planta, 2006, 223(5): 1058–1067. |
| [68] | Nezhad AS, Naghavi M, Packirisamy M, et al. Quantification of the Young's modulus of the primary plant cell wall using Bending-Lab-On-Chip(BLOC)[J]. Lab on a Chip, 2013, 13(13): 2599–2608. |
| [69] | Jiang H, Xu Z, Aluru MR, et al. Plant chip for high-throughput phenotyping of Arabidopsis[J]. Lab on a Chip, 2014, 14(7): 1281–1293. |
| [70] | Uthayakumaran S, Zhao F, Sivri D, et al. Defect identification in wheat grain by micro-fluidic electrophoresis:sulfur deficiency and bug damage[J]. Cereal Chemistry, 2007, 84(4): 301–303. |
| [71] | Zhang B, Luo Y, Pearlstein AJ, et al. Fabrication of biomimetically patterned surfaces and their application to probing plant-bacteria interactions[J]. Acs Applied Materials & Interfaces, 2014, 6(15): 12467–12478. |