1-脱氧野尻霉素(1-Deoxynojirimycin,DNJ)通过抑制α-糖苷酶活力和小肠刷状缘对葡萄糖的吸收来改善糖尿病状况[1, 2]。进而改善餐后高血糖和胰岛素敏感[2]。DNJ是一种小分子生物碱,其结构和葡萄糖十分相似,是葡萄糖分子六元环上面的氧原子被氮原子取代,且1号碳原子连接的氧原子被脱去而成。从桑树的根部和叶子提取到[3],一些芽孢杆菌和链霉菌也可以产生DNJ[2, 4, 5],Kim 等[6]2011年报道从Chungkookjang(快速发酵豆酱,韩国的一种传统食品)分离出产强的α-糖苷酶抑制剂菌株B. subtilis B2,后者的结构分析表明,它和在植物中提取到的DNJ结构一样[7, 8]。由于DNJ的抑制糖苷酶活力的作用,其在治疗糖尿病[9],同时在艾滋病感染[10]和心血管疾病[11]方面有潜在作用和应用前景。然而,受其来源限制,桑叶中DNJ含量低且提取工艺复杂,而化学合成方法不很成熟且无法大规模生产[12],因此,应用微生物发酵来生产DNJ就显得更加经济有效。
如前所述,一些芽孢杆菌和链霉菌可以产生DNJ。然而这些细菌是从石油中分离到的,要想把它们应用到食品工业十分困难。Zhu等[13]报道了首次从发酵食品即豆渣分离到的枯草芽孢杆菌B. subtilis B2可以产生DNJ。用B. subtilis B2发酵的豆渣可能被用来生产食物来源的DNJ产品,可作为功能食品供糖尿病患者食用。然而,在冻干的发酵培养基中DNJ的含量仅为0.7 mg/g,和桑叶中的DNJ含量相当[14]。
目前,DNJ的检测方法有对硝基苯-β-D-吡喃半乳糖苷法(PNPG)、反向高效液相色谱法(RP-HPLC)等。本实验室应用了一种新的方法,在有铜离子存在下,仲胺与二硫化碳反应,生成有颜色的二烷基二硫代氨基酸铜[15, 16]。DNJ与二硫化碳的反应式如下:
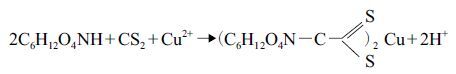
生产的黄色铜络合物可用有机溶剂萃取后,进行光度测定。
紫外线诱变用于微生物育种的诱变处理有着悠久的历史[17]。因此本研究采用简单的紫外线诱变手段来选育产DNJ的高产菌株。
1 材料与方法 1.1 材料 1.1.1 仪器压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂),超净台(苏州净化设备有限公司),细菌培养箱(上海博彩生物科技有限公司),摇床(上海博彩生物科技有限公司),低温冷冻离心浓缩仪(上海和杰科技有限公司),通风橱(Hamilton Scientific),荧光多功能酶标仪Spectrum M5(Molecular Devices)。
1.1.2 实验材料1-脱氧野尻霉素(上海世峰生物科技有限公司),二硫化碳、无水乙醇、吡啶、七水硫酸铜(试剂均为分析纯),LB培养基(Sigma)。Bacillus subtilis var. niger-231(以下简称B-231)为本室筛选并保藏的产DNJ突变株[18]。
1.2 方法 1.2.1 DNJ标准品的测定方法用移液器吸取试液100 μL至1.5 mL EP管中,加入二硫化碳200 μL,无水乙醇200 μL,吡啶20 μL和对应量的硫酸铜溶液,充分振荡后静置分层,取上层有色液于另一干净的1.5 mL EP管中,吸取100 μL至96孔板中,每份试样做3个重复,在440 nm波长下测定吸光度。取去离子水100 μL 至1.5 mL EP管中,按上述操作设定空白对照。
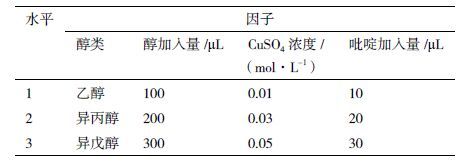
1.2.2 测定DNJ标准品的最佳条件探索实验试剂的种类、用量对检测结果都会对实验结果产生诸多影响,因此本实验选择了不同的醇类(乙醇、异丙醇、异戊醇)和不同用量、不同的CuSO4浓度、吡啶不同加入量,以检测这些条件对反应结果的影响。为减少实验次数及确定各因子对实验的影响程度我们设计了正交试验,按照四因素三水平设计实验(表 1)。
挑取在LB固体培养基上培养2 d的单克隆B-231接种到盛有50 mL液体LB培养基的250 mL的三角烧瓶中,37℃、150 r/min培养60 h,在6 500 r/min 4℃下离心3 min,弃上清,沉淀用0.9%生理盐水洗涤3次,最后用生理盐水制成约106 CFU/mL的菌悬液原液。将原液用生理盐水按10-6、10-5和10-4三个稀释度稀释,每个稀释度取5 mL菌悬液于直径为9 cm培养皿中,置15 W紫外灯30 cm处分别照射1 min、2 min、3 min、5 min、8 min。设未经紫外照射的菌液为对照组,各取0.1 mL菌液均匀涂布在LB平板上。
1.2.4 细菌发酵及发酵液的预处理将LB平板上经过紫外诱变处理和对照组生长良好的单菌落用接种环转接至含有100 mL LB液体培养基的三角烧瓶中,在30℃,150 r/min条件下培养60 h。取细菌发酵液1 mL,10 000 r/min离心3 min,保留上清液。取上清800 μL至1.5 mL EP管中,用低温冷冻离心浓缩仪浓缩冻干,5 h后加200 μL去离子水溶解制备成细菌发酵浓缩液,备用。
1.2.5 突变DNJ高产菌株筛选用移液器吸取浓缩菌液100 μL至1.5 mL EP管中,按1.2.1方法,每份试样做3个重复,测定细菌发酵浓缩液中DNJ的含量。同时设定LB液体培养基为空白对照。筛选出DNJ高产突变菌株。
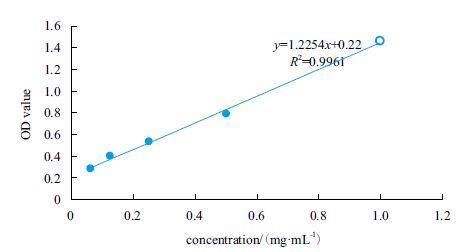
2 结果 2.1 标准曲线绘制取5 mg/mL 1-脱氧野尻霉素1 mL,以去离子水稀释成0.0625 mg/mL,0.125 mg/mL,0.25 mg/mL,0.5 mg/mL,1.0 mg/mL的1-脱氧野尻霉素溶液,制作标准曲线。结果(图 1)显示,在一定范围内,DNJ浓度与OD值之间呈较好的线性关系,符合直线回归方程:y = 1.2254x + 0.22,R2 = 0.9961。
|
| 图 1 DNJ标准曲线 |
取0.16 mg/mL 1-脱氧野尻霉素溶液平行测定5次,结果如图 2 所示,DNJ溶液在440 nm处有强的吸收峰,对应的吸光度OD值分别为:0.459 6,0.486 1,0.475 2,0.475 1和0.430 7,5次测定DNJ溶液吸光度的平均值为0.345 5,计算出5次测定的偏差分别是:-0.0057,0.020 8,0.009 9,0.009 8和-0.034 6。平均偏差d =0.016 2。

|
| 图 2 平行测定DNJ溶液在440 nm处吸收峰 |
对浓度为0.031 2 mg/mL和0.015 6 mg/mL的1-脱氧野尻霉素溶液进行同上测定,得到吸光度分别为0.172 2和0.278 3。结果显示,本法检测DNJ标准品含量的最低检测限为0.015 6 mg/mL,灵敏度为0.015 6 mg/mL。
2.4 回收实验(准确度)取0.125 mg/mL的1-脱氧野尻霉素溶液100 μL三份,按0.8,1.0,1.2倍DNJ量加入5 mg/mL的1-脱氧野尻霉素2.0 μL,2.5 μL,3.0 μL,每份做3个重复,共测定9次。测得回收率分别为108.5%、109.2%和109.8%。
2.5 稳定性取浓度为1.0 mg/mL、0.5 mg/mL、0.25 mg/mL和0.125 mg/mL,0.062 5 mg/mL的1-脱氧野尻霉素溶液按1.2.1的测定方法,在90 min内,波长440 nm处每隔10 min测一次吸光度值,结果见图 3。从上往下曲线依次对应浓度为1.0 mg/mL,0.5 mg/mL,0.25 mg/mL,0.125 mg/mL,0.062 5 mg/mL,在90 min内,随着DNJ溶液浓度的提高,产物的OD值随时间变化而降低得更快。
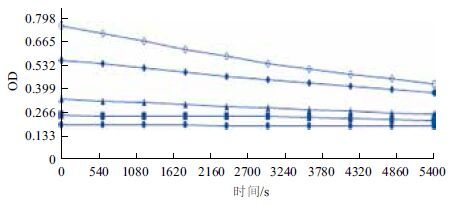
|
| 图 3 90 min内DNJ溶液的吸光度变化 |
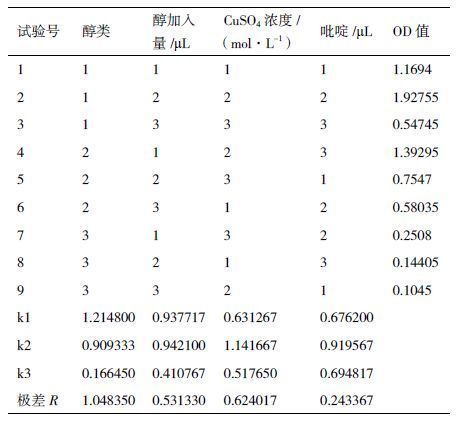
正交试验结果见表 2,根据正交试验原理,极差越大,说明该因子对实验结果影响越大。因此本次试验中,对实验影响大小:醇类 > CuSO4浓度 > 醇加入量 > 吡啶加入量;K值越大,对应因子的水平越好,因此本次实验最优水平也即本法最有反应条件为:乙醇,200 μL,CuSO4浓度0.03 mol/L,吡啶20 μL。
菌悬液稀释度为10-4的平板在诱变0 min、1 min、2 min、3 min、5 min及8 min后平均菌落数分别为131、89、44、18,3和1;菌悬液稀释度为10-5的平板在诱变0 min、1 min、2 min、3 min、5 min及8 min后菌落数分别为28、15、6、4、1和0;菌悬液稀释度为10-6的平板在诱变0 min、1 min、2 min、3 min、5 min和8 min后菌落数分别为6、2、0、1、0和0。菌落数在4个及以上时,随机挑取4个单克隆液体发酵,菌落数小于4的则全部转接至液体LB发酵。
2.8 应用比色法测定细菌发酵液中的DNJ含量在发酵36 h、48 h和60 h之后,测得菌株B-231发酵液中的DNJ产量分别为17.6 μg/mL,20.4 μg/mL和33.8 μg/mL;测得诱变菌株发酵液中DNJ含量,发现其中有一株突变菌发酵液中DNJ含量特别高,在发酵36 h、48 h和60 h其发酵液中DNJ含量分别为48.7 μg/mL,55.6 μg/mL和87.3 μg/mL,该菌株编号为B. subtilis var. niger- 431(以下简称B-431)。结果如表 3所示。其余菌株诱变后其发酵液中DNJ含量没有显著提高(数据未附上)。
参照Kim等[19]柱前衍生化反向高效液相色谱法,取细菌发酵液20 μL至1.5 mL EP管,加入5 mmol/L FMOC-Cl 40 μL,再加入0.4 mol/L硼酸钾缓冲液(pH8.5)50 μL,充分混匀后25℃反应25 min,加入890 μL 0.1%乙酸,0.22 μm针滤,取10 μL上样,测得B-431发酵60 h后DNJ含量为73.2 μg/mL。如图 4,FMOC-DNJ的出峰时间为第8.053-8.073 min。

|
| 图 4 RT-HPLC法测定B-431发酵液DNJ |
应用比色法测定1-脱氧野尻霉素标准品,结果在一定浓度范围内取得良好线性关系,拟合优度R2 = 0.996 1;5次平行测定平均偏差为0.878%,结果显示出很好的重复性;加标回收实验所得回收率在50%以上,准确度良好;该方法检测下限达到15.625 μg/mL DNJ水溶液;稳定性实验表明,在半个小时内完成对产物的检测,结果可行度比较高。本法灵敏度、准确度高、操作简便快速,而PNPG法采用大鼠的肠黏膜α-糖苷酶作为催化剂,利用DNJ对α-糖苷酶的抑制作用从而间接得出DNJ含量。由于酶活性易受较多因素影响,如温度、pH、各种离子浓度、抑制剂或活化剂、同源分子的干扰等,此法对测定结果带来一定的误差,且重复性较差[19]。RP-HPLC法中的衍生化反应程度不易控制,硼酸钾缓冲液的pH对衍生产物结果影响较大,衍生化产物不稳定易降解[20],并且检测需要高效液相色谱仪器,检测成本高。本研究采用的比色法检测细菌发酵液中DNJ的含量具有快速、灵敏的优点,与反向高效液相色谱法相比较,本法所测的细菌发酵液中DNJ含量稍微偏高,这可能与细菌培养液中含有较多的氨基酸有关,后者带来一定的系统误差。总体来说两种方法测定结果比较接近,而在操作上RT-HPLC更加繁琐且成本更高。因此本法更适于测定细菌发酵液中DNJ含量。由于本方法尚属于初步建立,在实际应用中可能存在各种干扰因素,目前仅用于测定高纯度DNJ和细菌发酵液中DNJ含量,后续工作中,我们正在实际应用于其他样品中以了解其各种干扰因素和可行性,目前正在试图用该方法测定桑树叶中的DNJ含量以证明该方法的普适性。
紫外线诱变育种的原理是,通过紫外线照射使DNA双链之间或同一条链上的两个相邻的胸腺嘧啶形成二聚体,并阻碍双链的分开、复制和碱基的正常配对,从而引起基因突变,最终导致微生物表形变化,紫外诱变是一种最常用的物理诱变因素,它经常被用于微生物育种。 因此本文采用紫外诱变来选育产DNJ高产菌株。通过紫外光照射处理细菌B-231,最终筛选到一株高产DNJ的菌株,命名为B-431,其产生DNJ的量较原始菌株B-231提高了4.2倍,DNJ含量达87.3 mg/L,比Zhu等[13]31 mg/L的DNJ含量也有了很大提高。最佳发酵时间为60 h,这与Zhu等[21]的最佳发酵时间66 h结论较为一致。
4 结论本实验应用比色法测定1-脱氧野尻霉素标准品,结果在一定浓度范围内取得良好线性关系,采用遗传诱变手段来处理枯草芽孢杆菌,使其DNJ产量达87.3 mg/L,较原始菌株原突变株提高了4.2倍。
| [1] | Kwon HJ, Chung JY, Kim JY, et al. Comparison of 1-Deoxynojirimycin and aqueous mulberry leaf extract with emphasis on postprandial hypoglycemic effects:in vivo and in vitro studies[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7SI): 3014–3019. |
| [2] | Lee S. 1-Deoxynojirimycin isolated from a Bacillus subtilis stimulates adiponectin and GLUT4 expressions in 3T3-L1 adipocytes[J]. Journal of Microbiology and Biotechnology, 2013, 23(5): 637–643. |
| [3] | He H, Lu YH. Comparison of inhibitory activities and mechanisms of five mulberry plant bioactive components against alpha-glucosidase[J]. J Agric Food Chem, 2013, 61(34): 8110–8119. |
| [4] | Niwa T, Tsuruoka T, Goi H, et al. Novel glycosidase inhibitors, nojirimycin-b and d-mannonic-delta-lactam - isolation, structure determination and biological property[J]. Journal of Antibiotics, 1984, 37(12): 1579–1586. |
| [5] | Onose S, Ikeda R, Nakagawa K, et al. Production of the α-glycosidase inhibitor 1-deoxynojirimycin from Bacillus species[J]. Food Chemistry, 2013, 138(1): 516–523. |
| [6] | Kim HS, Lee JY, Hwang KY, et al. Isolation and identification of a Bacillus sp producing alpha-glucosidase inhibitor 1-deoxynojirimycin[J]. Korean Journal of Microbiology and Biotechnology, 2011, 39(1): 49–55. |
| [7] | Nakagawa K, Kubota H, Kimura T, et al. Occurrence of orally administered mulberry 1-deoxynojirimycin in rat plasma[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8928–8933. |
| [8] | Shibano M, Fujimoto Y, Kushino K, et al. Biosynthesis of 1-deoxynojirimycin in commelina communis:a difference between the microorganisms and plants[J]. Phytochemistry, 2004, 65(19): 2661–2665. |
| [9] | Asano N, Oseki K, Tomioka E, et al. N-containing sugars from morus-alba and their glycosidase inhibitory activities[J]. Carbohydrate Research, 1994, 259(2): 243–255. |
| [10] | Gruters RA, Neefjes JJ, Tersmette M, et al. Interference with HIV-induced syncytium formation and viral infectivity by inhibitors of trimming glucosidase[J]. Nature, 1987, 330(6143): 74–77. |
| [11] | Butters TD, Dwek RA, Platt FM. Therapeutic applications of imino sugars in lysosomal storage disorders[J]. Current Topics in Medicinal Chemistry, 2003, 3(5): 561–574. |
| [12] | Kang KD, Cho YS, Song JH, et al. Identification of the genes involved in 1-deoxynojirimycin synthesis in Bacillus subtilis MORI 3K-85[J]. Journal of Microbiology, 2011, 49(3): 431–440. |
| [13] | Zhu YP, Yamaki K, Yoshihashi T, et al. Purification and identifica-tion of 1-Deoxynojirimycin(DNJ)in Okara fermented by Bacillus subtilis B2 from Chinese traditional food(Meitaoza)[J]. Journal of Agricultural and Food Fhemistry, 2010, 58(7): 4097–4103. |
| [14] | Kimura T, Nakagawa K, Kubota H, et al. Food-grade Mulberry powder enriched with 1-Deoxynojirimycin suppresses the elevation of postprandial blood glucose in humans[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14): 5869–5874. |
| [15] | 张志贤. 实用有机定量分析[M]. 上海: 上海科技出版社, 1965. |
| [16] | 张志贤, 张瑞镐. 有机官能团定量分析[M]. 北京: 化学工业出版社, 1990. |
| [17] | 周德庆. 微生物学实验教程[M]. 北京: 高等教育出版社, 2006. |
| [18] | 白豆, 龙玲, 朱乃硕. 一株1-脱氧野尻霉素(DNJ)枯草芽孢杆菌黑色变种的诱变育种研究[J]. 复旦学报:自然科学版, 2006, (1): 104–111. |
| [19] | Yamaki K, Mori Y. Evaluation of a-glucosidase inhibitory activity in colored foods:a trial using slope factors of regression curves[J]. Journal of the Japanese Society for Food Science and Technology-Nippon Shokuhin Kagaku Kogaku Kaishi, 2006, 53(4): 229–231. |
| [20] | Kim JW, Kim SU, Lee HS, et al. Determination of 1-deoxynojirim-ycin in Morus alba L[J]. Journal of Chromatography a, 2003, 1002(1-2): 93–99. |
| [21] | Zhu YP, Li XT, Teng C, et al. Enhanced production of α-glucosidase inhibitor by a newly isolated strain of Bacillus subtilis B2 using response surface methodology[J]. Food and Bioproducts Processing, 2013, 91(3): 264–270. |