2. 植物病虫害生物学与防控湖南省重点实验室 南方粮油作物协同创新中心,长沙 410128
2. Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests,Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China,Changsha 410128
水稻稻瘟病是由真菌稻瘟病菌Magnaporthe oryzae(无性世代为Pyicularia oryzae)引起的水稻灾害性病害,病害重的年份可造成减产40%-50%,甚至颗粒无收[1]。目前全世界水稻平均年总产量达到7.2亿t[2],超过30亿以上的人口以稻米为主要粮食[3],而中国水稻的年产量约2亿t,达到世界稻谷总产量的28.6%,位居世界第一[2]。防治稻瘟病的主要手段是化学农药防治,但由于抗瘟水稻品种的单一性、稻瘟病菌生理小种的复杂多变及用药不合理导致的病菌抗药性,各药剂田间防效不断降低,与此同时还给生态环境和人类健康带来了不可忽视的严重危害[4]。生防微生物有许多优于化学防治的优点,如对人畜和天敌安全、与环境相容性好、活体生物建立种群后对有害生物可达到长期较稳定的防控作用[5]并减缓病原菌抗药性的产生。生防细菌的研究与应用已经开展多年,国内外研究者报道了众多可以应用于植物病害防治的不同的细菌菌株。目前报道研究应用较多的植物病害生防微生物主要包括放线菌、真菌、细菌中的假单胞菌(Pseudomomnas)及芽胞杆菌(Bacillus)等,其中芽胞杆菌(Bacillus)是目前植物病害生防细菌研究中报道较多的一类[6]。芽胞杆菌防治植物病害的重要机制之一是其菌体及代谢产物可以引起寄主植物产生诱导抗病性,其另一重要优势是能够产生多种抗菌素和抗菌活性酶,具有很好的抗菌活性。目前生物防治研究存在着急需开发新的、高效的生防产品,提高生防制剂的有效性、实用性,降低生产、运输与应用成本等问题[7]。因此,从自然环境中分离获得稻瘟病菌的拮抗菌株对水稻的防病增产及粮食安全问题具有重要意义。
本研究从湖南桃江山区一季稻感病品种湘早籼24号的感稻瘟病稻丛的健康稻株中筛选出一株对稻瘟病菌具有较好抑制作用的拮抗细菌 JN005,对其进行形态学、生理生化特性及16S rDNA 序列系统发育分析鉴定,并进行代谢产物拮抗作用测定,旨在为生防菌在稻瘟病防治的应用提供参考。
1 材料与方法 1.1 材料作物病原真菌6种,即稻瘟病菌(Pyricularia oryzae)、水稻纹枯病菌(Rhizoctonia solani)、稻曲病菌(Ustilaginoidea virens)、水稻恶苗病菌(Fusarium moniliforme)、小麦赤霉病菌(无性为禾谷镰刀菌Fusarium graminearum)和辣椒炭疽病菌(Colletotrichum gloeosporioides);作物病原细菌4种,即水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae)、烟草青枯病菌(R. solanacarum)、柑橘溃疡病菌(Xanthomonas campestris pv. citri)和马铃薯环腐病菌(Clavibactermichiganense subsp. sepedonicum);大肠杆菌(Escherichia coli)、 金黄色葡萄球菌(Staphylococcus aureus subsp. aureus)。这12种菌均由湖南农业大学植物病理研究室提供。
供试培养基:牛肉膏蛋白胨培养基(NA)、牛肉膏蛋白胨培养液(NB)、燕麦片培养基、PDA培养基、需氧测定培养基、糖氧化发酵培养基、淀粉水解培养基、硝酸盐还原培养基、V.P 培养基、明胶液化培养基、石蕊牛奶培养基,均按方中达及陈捷[8, 9]的方法配制。
1.2 方法 1.2.1 样品采集样品的采集地点位于湖南省桃江县大栗港镇牌形上村(N28°31'49.02″,E111°54'24.86″)。采样即从感稻瘟病的稻丛中选出未患病的健康稻株,于4℃冰箱保存备用。
1.2.2 拮抗菌株的分离纯化及筛选将样品剪成长为4-6 mm小段于灭过菌的研钵中研磨捣碎,加入10 mL无菌水,静置30 min后,梯度(10-1-10-7)稀释,每个梯度取 0.2 mL菌液涂布于NA平板上,每浓度涂平皿1个,重复3次,置于28℃ 恒温培养箱中倒置培养。待平板内长出单菌落后,挑取不同形态的单菌落于新的平板上划线纯化。采用平板对峙法[10]测定待筛选的菌株对稻瘟病菌的拮抗作用,即在PDA平板中央接种1块稻瘟病菌菌饼(直径5 mm),待筛选菌株划线接种于菌饼两侧,27℃倒置培养,以只接种稻瘟病菌菌饼的PDA平板为对照,每处理3次重复。待对照菌落接近长满平板时,观察实验平皿中有无抑菌带,留取抑菌带明显的平皿并测量抑菌带的宽度。
1.2.3 JN005菌株的分类鉴定 1.2.3.1 菌株形态观察及生理生化特性测定 1.2.3.2 16S rDNA片段的扩增、序列分析及系统发育分析采用细菌基因组提取试剂盒(上海生工生物有限公司)抽提JN005菌株全基因组DNA,用通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')扩增。PCR扩增条件:95℃预变性2.5 min;94℃变性30 s,55℃复性1 min,72℃延伸1 min,35个循环;72℃延伸10 min。扩增产物送上海生工生物有限公司进行测序,测序结果在GenBank上进行BLAST。采用Mega5对JN005菌株进行系统发育树构建。
1.2.4 JN005菌株抑菌谱测定JN005菌株对各病原细菌的拮抗作用采用纸碟法[14]测定;对各病原真菌的拮抗作用采用平板对峙法[10]测定。
1.2.5 JN005菌株代谢产物拮抗作用测定JN005菌株接种于NB中,在30代谢产物PDA培养基 = 1∶4)中央接种稻瘟病菌菌饼(直径5 mm),27℃ 倒置培养,以不加代谢产物并接种稻瘟病菌菌饼(直径5 mm)的PDA平板为对照,每处理3次重复。待对照皿中菌落接近长满平板时,采用菌丝生长速率法[15]计算抑菌率。
纯生长量(mm)=菌落平均直径-菌饼直径
抑菌率(%)=[(对照菌落纯生长量-处理菌落纯生长量)/对照纯生长量]×100%
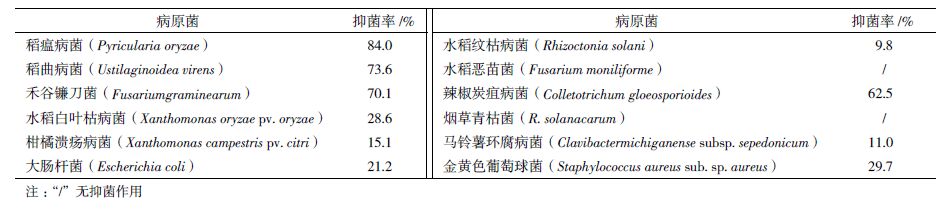
2 结果 2.1 稻瘟病菌拮抗菌株的分离本实验从样品中共分离获得817个细菌菌株,其中有26个菌株对供试稻瘟病菌有拮抗作用,占总分离菌数的3.18%,拮抗效果明显的(抑菌带宽度超过7 mm)有7个菌株,其中JN005菌株抑菌带宽度达到15.32 mm(图 1)。
|
| 图 1 JN005 菌株对稻瘟病菌菌丝生长抑制效果 A :拮抗菌抑制生长的菌落;B :正常菌落 |
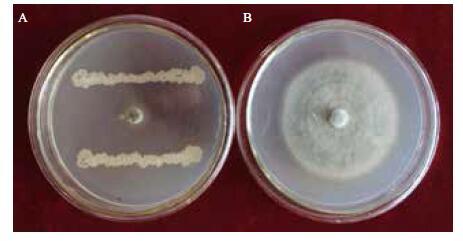
JN005菌株在NA培养基上28℃倒置培养48 h后,菌落形态不规则,边缘隆起,中间凹陷,粗糙不透明,表面干燥,污白色或微黄色。JN005菌体呈杆状,鞭毛周生,无荚膜,大小为(0.7-0.8)µm ×(2-3)µm(图 2),芽孢椭圆到柱状位于菌体中央或稍偏,长0.5-1.0 µm,最适生长温度28-30℃,革兰氏染色为阳性,参照东秀珠等《常见细菌系统鉴定手册》和布坎南等《伯杰氏细菌系统鉴定手册》,可鉴定JN005菌株为芽孢杆菌属。
|
| 图 2 JN005 菌株扫描电镜照片 |
JN005菌株对接触酶(24 h)、V.P反应等22项生理生化指标鉴定结果见表 1。根据JN005菌株的生理生化特征,并结合扫描电镜照片和菌落形态特征,参照《常见细菌系统鉴定手册》和《伯杰氏细菌系统鉴定手册》,将JN005菌株鉴定为枯草芽孢杆菌或蜡样芽孢杆菌。
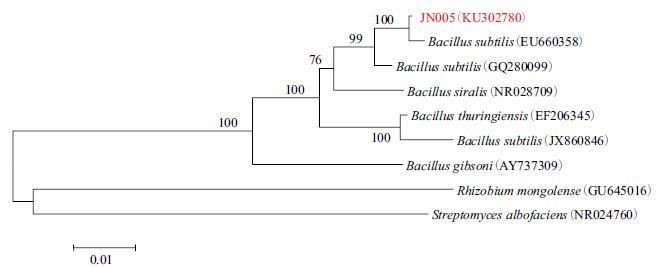
经测序,JN005菌株的16S rDNA 序列全长为1 601 bp(图 3),BLAST结果表明,JN005菌株与枯草芽孢杆菌(Bacillus subtilis)的同源性最高,相似性为100%。用N-J法计算JN005菌株的16S rDNA全序列遗传距离,并根据遗传距离得到系统发育树。结果(图 4)显示,JN005菌株与枯草芽孢杆菌(Bacillus subtilis)处于一个大的分支内,遗传距离最近,结合形态学及生理生化特征对JN005菌株的鉴定结果为枯草芽孢杆菌。
|
| 图 3 JN005 菌株16S rDNA PCR 产物的电泳结果 |
|
| 图 4 JN005 菌株的系统发育树 |
JN005 菌株除了对稻瘟病菌抑菌效果突出外,对供试的另外12种病原菌也有不同程度的拮抗作用(表 2)。其中JN005菌株对稻瘟病菌、稻曲病菌、禾谷镰刀菌及辣椒炭疽病菌的抑菌率大于60%,拮抗效果较好;对金黄色葡萄球菌、柑橘溃疡病菌、纹枯病菌、马铃薯环腐病菌、白叶枯病菌、大肠杆菌具有一定的拮抗作用;但对水稻恶苗病菌、烟草青枯病菌没有拮抗作用。
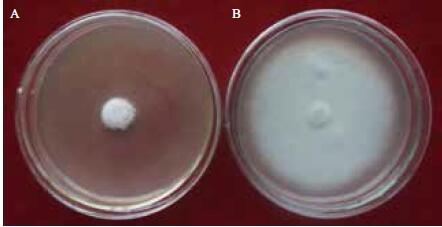
JN005菌株代谢产物对供试稻瘟病菌具有较好的拮抗作用,含有代谢产物的PDA平板上的稻瘟病菌菌落生长较对照组明显被抑制,其中对照组稻瘟病菌菌落平均直径达68 mm,实验组稻瘟病菌菌落平均直径仅为8 mm(图 5),抑菌率高达84%。
|
| 图 5 JN005 菌株代谢产物对稻瘟病菌的拮抗作用 A:代谢产物抑制生长的菌落; B:正常菌落 |
本研究从感稻瘟病稻丛的健康稻株中分离出817株细菌菌株,结合平板对峙法及代谢产物的菌丝生长速率法筛选出一株对稻瘟病菌具有较好抑制作用的拮抗细菌JN005,通过生理生化测定及16S rDNA分子序列分析将其鉴定为枯草芽孢杆菌。
枯草芽孢杆菌具有抑制植物病害的能力,又是自然界中广泛存在的动植物和土壤等环境中内外生细菌,对人畜无害,不污染环境;其自身没有致病性,只具有单层细胞外膜,能直接将许多蛋白分泌到培养基中;在营养缺乏的条件下,产生多种大分子的水解酶和抗生素,诱导自身的能动性和趋势化恢复生长,并且具有生长快、营养简单、能产生耐热、抗逆芽孢等突出特征,有利于生防菌剂的生产、剂型加工及在环境中的存活、定殖与繁殖,加之批量生产工艺简单,成本较低,施用方便,储存期长,是一种理想的生防微生物。国内外先后开发出多种芽孢杆菌生防制剂应用于多种病害的生物防治,取得了良好的效果[16]。如美国已有4株枯草芽孢杆菌生防菌株获得环保局(EPA)商品化或有限商品化生产应用许可,它们分别是GB03、MBI600、QST713和解淀粉枯草芽孢杆菌变种(B. subtils var. amyloliquefaciens FZB24)[17];我国利用枯草芽孢杆菌防治植物病害的应用研究也达到了世界先进水平,现已成功开发并投入生产的商品制剂有亚宝、百抗、麦丰宁、纹曲宁等[18]。此外,枯草芽孢杆菌还是防控稻瘟病菌的理想生物防治菌,Filippi等[19]从水稻根际土壤分离到148株细菌,促生能力筛选实验结果显示18株细菌对稻苗有显著促生作用。进一步对这些菌株对稻痕病菌的离体抑菌活性及温室盆栽防效进行测定,获得对稻叶痕防效最高的菌株rizo-46和rizo-55,防效最高可达90%-95%。Shan等[20]从原始森林土壤中分离得到一株甲基营养塑枯草芽胞杆菌Bacillus methylotrophicus BC79c离体抑菌实验结果显示该菌株能抑制许多植物病原真菌菌丝生长和孢子萌发。温室实验表明,BC79发酵液对稻瘟病具有89.87%的防效。经TLC与HPLC分析鉴定,其主要抑菌活性物质为Phenaminomethylacetic acid。而本研究发现JN005菌株具有较强的拮抗水稻稻瘟病菌活性,其代谢产物对水稻稻瘟病菌的抑菌率高达84%,是稻瘟病生防菌的重要资源。
后续尚需对JN005菌株工业化最佳发酵条件优化、剂型筛选、田间防治效果评价及作用机理等方面进行研究。
4 结论本实验共筛选出7个对稻瘟病菌拮抗效果明显的菌株,其中编号为JN005的菌株对稻瘟病菌的抑制作用最为突出,并且对稻曲病菌、禾谷镰刀菌及辣椒炭疽病菌也有较好的抑制效果。综合对JN005的形态特征、生理生化特征及16S rDNA测序分析,将其定名为枯草芽孢杆菌(Bacillus subtilis)。结果表明,该菌无论是菌株活体还是发酵液都都能明显抑制稻瘟病菌的菌丝生长。
| [1] | Skamnioti P, Gurr SJ. Against the grain :safeguarding rice from rice blast disease[J]. Trends in Biotechnology, 2009, 27(3): 141–150. |
| [2] | FAO, WFPj, IFAD. Economic growth is necessary but not sufficient to accelerate reduction of hunger and malnutrition. The State of Food Insecurity in the World[R]. Rome :FAO, 2012. |
| [3] | 宿桂红, 傅新红. 农业技术创新与农业现代化关系研究[J]. 湖北农业科学, 2011, (15): 3207–3210. |
| [4] | 林玲, 乔勇升, 顾本康, 等. 植物内生细菌及其生物防治植物病 害的研究进展[J]. 江苏农业学报, 2008, 24(6): 969–974. |
| [5] | Alabouvette C, Olivaln C, Steinberg C. Biological control of plant diseases :The European Situation[J]. European Journal of Plant Pathology, 2006, 114(3): 329–341. |
| [6] | 李双东. 防治稻瘟病芽胞杆菌的筛选及生防机制研究[D]. 北 京:中国农业大学, 2015 :9-12. |
| [7] | Lou YG, Zhang GR, Zhang WQ, et al. Biological control of rice insect pests in China[J]. Biological Control, 2014, 68(1): 103–116. |
| [8] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 2007.46-47. |
| [9] | 陈捷. 现代植物病理学研究方法[M]. 北京: 中国农业出版社, 2007. |
| [10] | 魏彩燕, 毛雪琴, 柴荣耀. 草莓炭疽病生防菌株MT-06 的鉴定 及生物学特性[J]. 菌物学报, 2010, (4): 481–487. |
| [11] | 东秀珠, 蔡妙英, 等. 常见细菌系统鉴定手册[M]. 北京: 科 学出版社, 2001.9-42. |
| [12] | Holt JG, Krieg NR. Bergeys manual of systematic bacteriology[M]. 9th ed. Baltimore London : Williams & Wilkins Co, 1994.353-376. |
| [13] | 朱立平, 陈学清. 免疫学常用实验方法[M]. 北京: 人民军 医出版社, 2000.102-107. |
| [14] | He YX, Yang Q, Xu HX, et al. Prokaryotic expression and purification of grass carp reovirus capsid protein VP7 and its vaccine potential[J]. African Journal of Microbiology Research, 2011, 13(5): 1643–1648. |
| [15] | 孙广字, 宗兆峰, 王建明, 等. 植物病理学实验技术[M]. 北 京: 中国农业出版社, 2002.142-143. |
| [16] | Idris H, Ahmed Labuschagne N, Korsten L. Screening rhizobacteria for biological control of Fusarium root and crown rot of sorghum in Ethiopia[J]. Biological Control, 2007, 40(1): 97–106. |
| [17] | http://www2. epa. gov/pesticides[DB] |
| [18] | 陈志谊, 陆凡, 刘永锋, 等. 防治水稻病害微生物农药纹曲宁 的研制及产业化[J]. 江苏农业学报, 2003, 19(2): 108. |
| [19] | Filippi MCC, da Silva GB, Silva-Lobo VL, et al. Leaf blast (Magnaporthe oryzae)suppression and growth promotion by rhizobacteria on aerobic rice in Brazil[J]. Biological Control, 2011, 58(2): 160–166. |
| [20] | Shan H, Zhao M, Chen D, et al. Biocontrol of rice blast by the phenaminomethylacetic acid producer of Bacillus methylotrophicus strain BC79[J]. Crop Protection, 2013, 44: 29–37. |