空通气孔同源框(empty spiracleshomeobox,emx)是人类与果蝇ems(empty spiracles)的同源结构域基因,含同源转录因子,在果蝇头部的早期发育中发挥重要作用[1, 2]。脊椎动物emx包括emx1和emx2,位于同源盒基因(homeotic genes,hox)家族的外侧,在脊椎动物发育中的大脑表达并对端脑背侧、大脑皮层和中枢神经系统发育起关键作用[3, 4]。在小鼠的成熟发育中,二者的表达时间与分布非常相似,但并不完全同步。例如,Emx2主要表达在端脑的背侧、间脑的背侧和前侧,而Emx1仅在端脑背侧表达。在小鼠胚胎中Emx2在8.5日龄就可以检测到,而Emx1在9.5日龄的胚胎中才可以检测到[5-8]。近年研究发现,哺乳动物Emx2基因在发育中的泌尿生殖系统以及能形成排泄器官和生殖系统的原基细胞中也有表达,并呈生殖周期性变化[9, 10];且在子宫内膜上皮细胞中是一种必不可少的增殖抑制基因[11]。缺乏Emx2可使小鼠患特纳综合症即性腺发育不完全[12]。这些研究表明emx2在泌尿生殖系统的发育和分化过程发挥重要作用,而对于emx1的研究目前仅限于大脑皮层及神经系统,对生殖中的作用研究甚少。
牙鲆是一种重要的海水经济鱼类,雌性个体明显大于雄性个体[13],有关牙鲆性别决定和生殖调控的分子调控机制研究备受重视。我们先前的研究鉴定了牙鲆emx2基因并对其在牙鲆中的表达进行了研究,发现emx2基因在牙鲆神经胚时期表达量最高,而在随后的胚胎发育期和早期仔鱼中表达水平逐渐降低,同时其在牙鲆成鱼的脑、性腺包括卵巢和精巢中均有表达,尤其在卵巢中的表达量最高[14],表明emx2基因不仅在鱼类神经系统中发挥作用,也可能在鱼类生殖中起重要作用。因此,本研究进一步克隆牙鲆emx1基因,并分析其分子特性及在牙鲆各组织和早期发育中的表达模式,以期为阐述emx基因在牙鲆生殖调控中的作用提供参考。
1 材料与方法 1.1 材料 1.1.1 实验用鱼牙鲆成鱼采集于中国水产科学研究院黄海水产研究所,随机选取6条成鱼(雌雄各3条)进行解剖取组织,包括脑、鳃、肝脏、肾脏、卵巢、精巢、心脏、肌肉、胃、肠,DEPC水冲洗干净后在液氮中速冻,然后置于-80℃保存备用[15]。牙鲆胚胎和仔鱼采集于中国水产科学研究院北戴河中心实验站,在(16±1)℃的过滤海水中孵化和饲养,分别采集未受精卵(0 h)、受精卵(0.5 h)、囊胚期(9 h)、原肠胚期(26 h)、神经胚期(42.5 h)、胚孔封闭期(48 h)、心跳期(71 h)、出膜前(75 h)及刚出膜(78.5 h)、孵化后3、7、9、10、14、17、20、23、29、36 和41 d 仔鱼,各期样品平行取样3组,每组15-30个体[16]。
1.1.2 菌株和质粒pMD®19-T Vector购自TaKaRa公司;大肠杆菌DH5α均由本实验室保存。
1.1.3 主要试剂Trizol Reagent试剂盒购自Invitro-gen公司;DNase I、RNase Inhibitor、M-MLV Rtase等反转录试剂购自Promega公司;Gel Extraction Kit购自天根生化科技(北京)有限公司;2×iQTM SYBR Green Supermix购自Bio-Rad公司。
1.2 方法 1.2.1 总RNA的提取和反转录将上述各牙鲆样品依照Trizol Reagent试剂盒方法提取总RNA。总RNA用Agilent 2100 Bioanalyzer测定OD260/OD280值及浓度,P值均在1.8-2.0之间。用2%甲醛变性琼脂糖凝胶电泳检测RNA完整性,确认28S和18S条带清晰,无RNA降解,RNA质量能够满足后续实验要求,置于-80℃保存备用。
所得总RNA用DNase I 处理后,按以下体系进行反转录:在除酶离心管中加入1 000 ng总RNA,1 μL OligodT Primer(50 μmol/L),补充DEPC处理的ddH2O至10 μL,702O至20 μL;在PCR仪上进行反转录,反应条件为:42℃ 60 min,75℃ 15 min。反转录后的cDNA置于-20℃保存。
1.2.2 牙鲆emx1的克隆查询本实验室先前高通量测序的牙鲆转录组文库,检索到一牙鲆emx1基因的EST序列,根据该EST序列设计基因特异性引物emx1-F和emx1-R(表 1),用牙鲆各组织混合的cDNA为模板进行PCR扩增。PCR反应条件为:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸72 s,共36个循环;72℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳分离后,用Gel Extraction Kit 纯化回收目的条带。将纯化产物连接到pMD®19-T Vector上,16℃连接过夜后,转化到大肠杆菌DH5α菌株中,经蓝白斑筛选,挑选阳性克隆送上海生工生物工程有限公司测序。
用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测牙鲆emx1可能的开放阅读框,并推测编码的氨基酸序列。用BioEdit软件将得到的牙鲆Emx1蛋白序列和GenBank数据库中其他生物同源蛋白的氨基酸序列进行比对分析。运用MEGA 5.2软件,采用NJ(Neighbor-Joining)法构建进化树。其他脊椎动物的EMX1氨基酸序列均从NCBI中GenBank下载,登录号如下:雀鲷(Stegastes partitus)(XP_008277178);斑马鱼(Danio rerio)(NP_937787.1);半滑舌鳎(Cynoglossus semilaevis)(XP_008314554.1);花鳉(Poecilia formosa)(XP_007569597.1);海龟(Chelo-nia mydas)(XP_007072072.1);罗非鱼(Oreochro-mis niloticus)(XM_003447768.2);牛(Bos taurus)(NP_001179152.1);原鸡(Gallus gallus)(XP_001-232151.2);墨西哥脂鲤(Astyanax mexicanus)(XP_007236486.1);热带爪蟾(Xenopus tropicalis)(NP_001005459.1);智人(Homo sapiens)(NP_004088.2);小鼠(Mus musculus)(NP_034261.1)。
1.2.4 定量PCR设计高效特异的引物(表 1),在CFX96TouchTMReal-Time PCR Detection System(Bio-Rad,USA)上进行定量检测。首先制备目的基因和内参基因(18S)的标准曲线。20 μL的反应体系包括了1 μL cDNA(从100 ng-0.1 ng,10倍梯度稀释),0.4 μL的特异性引物(qemx1-F和qemx1-R),10 μL的2×iQTM SYBR Green Supermix和8.2 μL的ddH2O。反应条件为:95℃ 1 min;95℃ 10 s,61℃ 15 s,并随之采集荧光40次,然后进行熔解曲线的扩增。标准曲线结果显示目的基因和内参基因的R值均大于0.99,相应的扩增效率(E)均介于95%-100%之间。随后对所有样品进行定量检测,PCR反应体系和条件同上,实验设3个重复。
1.2.5 统计分析牙鲆emx1mRNA的表达水平采用2-ΔΔCt法计算,其数值用平均值±标准误(x±s)表示,n=3。牙鲆各发育时期以未受精卵中的相对 mRNA 量为对照,牙鲆不同组织以肝脏中的相对mRNA量为对照。统计分析采用SPSS 17.0软件中的单因素方差分析(one-way ANOVA),使用Dunnett's T3 test进行比较,当P<0.05时表示差异显著。
2 结果 2.1 牙鲆emx1的克隆及结构分析以牙鲆总RNA为模板,通过PCR克隆得到一段长1 127 bp的cDNA序列,与目的序列大小一致。经生物信息学分析,该序列包括长708 bp的开放阅读框(Open reading frame,ORF),编码235个氨基酸,含278 bp的3'非翻译区(3' untranslated region,3'-UTR)和141 bp的5'-UTR(图 1)。编码的蛋白质分子量和等电点分别为26.9 kD和9.74。ORF区的135-195个氨基酸是一个保守的同源蛋白结构域。在3'-UTR区,发现2个mRNA快速降解信号(AT-TTA)和1个聚腺苷酸化信号(ATTAA)。

|
| 图 1 牙鲆emx1 cDNA 序列及推导出的氨基酸序列 * 表示终止密码子;..... 表示mRNA 快速降解信号;—表示聚腺苷酸化信号;方框中为保守的同源蛋白结构域 |
通过多物种的emx1氨基酸序列比较(图 2)显示,牙鲆Emx1蛋白与雀鲷和花鱂的同源性最高,均为95%;其次是罗非鱼(90%)、斑马鱼(87%)、墨西哥脂鲤(84%)、半滑舌鳎(79%),而与两栖动物热带爪蟾同源性为80%,与爬行动物海龟的同源性为81%,与哺乳动物人、小鼠、牛的同源性也较高,分别为72%、72%和73%。同时,Emx1同源结构域在脊椎动物中是高度保守的,且在所有鱼类中达到100%一致性。经 NJ 系统进化树分析,牙鲆Emx1与所有鱼类聚为一支(图 3)。

|
| 图 2 牙鲆emx1 与其他物种的氨基酸序列比对 亮灰色显示的是一些物种间的不同氨基酸,方框中为保守的同源蛋白结构域 |

|
| 图 3 基于NJ 法构建的emx1 氨基酸序列系统进化树 |
定量PCR结果(图 4)显示,emx1基因在牙鲆早期发育的各个阶段均有表达,并且多个发育时间点差异表达显著(P<0.05)。在未受精卵、受精卵、囊胚期emx1表达量很低,在原肠胚、神经胚期逐渐升高,而在胚孔封闭和心跳期达到顶峰,在出膜和出膜后其表达逐渐降低,但直至孵化后10 d仍保持较高的表达水平;而在孵化后14-41 d的仔鱼中降至很低的水平。

|
| 图 4 牙鲆emx1 在早期发育中的相对表达 字母相同表示差异不显著,字母不相同表示差异显著(P<0.05),下同 |
图 5显示,牙鲆emx1基因在所检测的组织中广泛表达,并且不同组织中的表达差异显著(P<0.05)。emx1基因在卵巢中表达最高,约为肝脏中的97倍(P<0.01);其次,emx1在精巢中也有较高的表达,而在包括脑在内的其他各组织中的表达均较低。
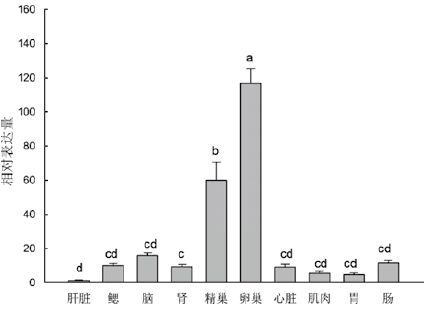
|
| 图 5 牙鲆emx1 在成体组织中的相对表达 |
本研究克隆得到了牙鲆emx1基因的cDNA序列并分析了其序列特征。系统进化和氨基酸同源比对分析都表明牙鲆emx1基因与脊椎动物各物种均具有较高的同源性(72%-95%),且与其他脊椎动物一样,在牙鲆emx1基因中有一个高度保守的同源结构域,该同源保守域在牙鲆和其他硬骨鱼类保持100%一致。这说明emx1在脊椎动物的系统进化过程中是高度保守的。研究发现,该同源域参与调控众多基因的表达,通过影响大脑皮层神经纤维的发育和成熟来调控神经系统的发育[17],同时也是生殖系统重要的增殖抑制因子[18, 19]。
在牙鲆早期发育中,emx1基因从神经胚期开始表达量急剧升高,在胚孔封闭和心跳期达到最高水平,而在随后的胚胎期和孵化后仔鱼中其表达量逐渐降低。从神经胚期开始的早期发育阶段是鱼类神经系统产生、发育和完善的重要时期,此时emx1基因的高表达表明其与其他脊椎动物emx1基因一样,可能在神经系统的发育中具有重要作用。有较多的研究已表明,Emx1基因在哺乳动物发育中的大脑中大量表达[4, 5, 20-22],Emx1和Emx2双重缺失的小鼠大脑皮层会造成早期发育模式的缺陷,如海马体和齿状回缺失,嗅球增长和纹理缺陷[23-25]。此外,与牙鲆emx2在神经胚期即达到最高表达水平[14]相比,牙鲆emx1的表达要相对滞后,在胚孔封闭和心跳期才出现表达高峰,这与Simeone等[4]发现Emx2比Emx1在小鼠胚胎中的表达要更早更快的结果是一致的。
在牙鲆组织分布上,emx1基因与先前鉴定的牙鲆emx2[14]相似,二者均在成体性腺中比在脑中具有更为丰富的表达,且在卵巢中的表达量高于精巢。Pellegrini等[26]和Miyamoto等[27]报道,Emx2基因在哺乳动物尤其是小鼠性腺包括精巢和卵巢中均有表达,且在卵巢中表达水平相对偏高。研究表明Emx2对哺乳动物的泌尿生殖系统有重要影响,在敲除Emx2的小鼠中,肾脏、输尿管、性腺和生殖道完全消失,而肾上腺和膀胱正常发育[28],Emx2通过改变子宫内膜细胞的增殖以调控哺乳动物生殖,组成型Emx2表达量升高会导致平均着床率下降40%[29]。目前有关Emx1基因表达的报道主要集中在哺乳动物的神经系统和泌尿系统相关的组织中[30],而缺乏关于其在脊椎动物性腺中的表达及在生殖系统中的功能研究,本研究结果提示emx1基因在鱼类生殖中可能发挥着重要作用。
4 结论本研究克隆了牙鲆emx1cDNA序列,并利用定量PCR技术检测了其在牙鲆早期不同发育阶段和成鱼不同组织中的表达,结果表明emx1在牙鲆早期的胚孔封闭期、心跳期及成体卵巢中表达丰富。
| [1] | Dalton D, Chadwick R, Mcginnis W. Expression and embryonic function of empty spiracles :a Drosophila homeobox gene with two patterning functions on the anterior-posterior axis of the embryo[J]. Genes & Development, 1989, 3: 1940–1956. |
| [2] | Walldorf LJ, Gehring WJ. Empty spiracles, a gap gene containing a homeobox involved in Drosophila head development[J]. The EMBO Journal, 1992, 11: 2247–2259. |
| [3] | Simeone A, Acampora D, Gulisano M, et al. Nested expression domains of four homeobox genes indeveloping rostral brain[J]. Nature, 1992, 358(6388): 687–690. |
| [4] | Simeone A, Gulisano M, Acampora D, et al. Two vertebrate homeobox genes related to the Drosophila empty spiracles gene are expressed in the embryonic cerebral cortex[J]. The EMBO Journal, 1992, 11(7): 2541. |
| [5] | Gulisano M, Broccoli V, Pardini C, et al. Emx1 and Emx2 show different patterns of expression during proliferation and differentiation of the developing cerebral cortex in the mouse[J]. European Journal of Neuroscience, 1996, 8(5): 1037–1050. |
| [6] | Boncinelli E, Gulisano M, Broccoli V. Emx and Otx homeobox genes in the developing mouse brain[J]. Journal of Neurobiology, 1993, 24(10): 1356–1366. |
| [7] | Pellegrini M, Mansouri A, Simeone A, et al. Dentate gyrus formation requires Emx2[J]. Development, 1996, 122(12): 3893–3898. |
| [8] | Bishop KM, Rubenstein JLR, O'Leary DDM. Distinct actions of Emx1, Emx2 and Pax6 in regulating the specification of areas in the developing neocortex[J]. Journal of Neurobiology, 2002, 22: 7627–7638. |
| [9] | Kusaka M, Katoh-Fukui Y, Ogawa H, et al. Abnormal epithelial cell polarity and ectopic epidermal growth factor receptor(EGFR) expression induced in Emx2 KO embryonic gonads[J]. Endocrinology, 2010, 151(12): 5893–5904. |
| [10] | Pellegrini M, Pantano S, Lucchini F, et al. Emx2 developmental expression in the primordia of the reproductive and excretory systems[J]. Anatomy and Embryology, 1997, 196(6): 427–433. |
| [11] | Noonan FC, Goodfellow PJ, Staloch LJ, et al. Antisense transcripts at the EMX2 locus in human and mouse[J]. Genomics, 2003, 81(1): 58–66. |
| [12] | Miyamoto N, Yoshida M, Kuratani S, et al. Defects of urogenital development in mice lacking Emx2[J]. Development, 1997, 124(9): 1653–1664. |
| [13] | 王清印. 海水养殖生物的细胞工程育种[M]. 北京: 海洋出版社, 2007. |
| [14] | Yin C, Zhang JL, Shi ZY, et al. Identification and expression of the target gene emx2 of miR-26a and miR-26b in Paralichthys olivaceus[J]. Gene, 2015, 570(2015): 205–212. |
| [15] | 翟万营, 张俊玲, 施志仪, 等. 牙鲆胰岛素样生长因子结合蛋 白IGFBP-1 cDNA 全长的克隆及表达分析[J]. 水产学报, 2012, 36(2): 171–179. |
| [16] | 王古樾, 付元帅, 施志仪, 等. 牙鲆中Dicer 基因的鉴定与表 达[J]. 海洋渔业, 2013, 35(3): 258–268. |
| [17] | Qiu M, Anderson S, Chen S, et al. Mutation of the Emx-1 homeobox gene disrupts the corpus callosum[J]. Developmental Biology, 1996, 178: 174–178. |
| [18] | Taylor HS, Igarashi P, Olive DL, et al. Steroids mediate HOXA11 expression in the human peri-implantation endometrium 1[J]. The Journal of Clinical Endocrinology & Metabolism, 1999, 84(3): 1129–1135. |
| [19] | Taylor HS, Bagot C, Kardana A, et al. HOX gene expression is altered in the endometrium of women with endometriosis[J]. Human Reproduction, 1999, 14(5): 1328–1331. |
| [20] | Gorski JA, Talley T, Qiu M, et al. Cortical excitatory neurons and glia, but not GABAergic neurons, are produced in the Emx1- expressing lineage[J]. Neuroscience, 2002, 22: 6309–6014. |
| [21] | Jin XL, Guo H, Mao C, et al. Emx1-specific expression of foreign genes using “knock-in" approach[J]. Biochemical and Biophysical Research Communications, 2000, 270: 978–982. |
| [22] | Sen S, Hartmann B, Reichert H, et al. Expression and function of the empty spiracles gene in olfactory sense organ development of Drosophila melanogaster[J]. Development, 2010, 137: 3687–3695. |
| [23] | Bishop KM, Garel S, Nakagawa Y, et al. Emx1 and Emx2 cooperate to regulate cortical size, lamination, neuronal differentiation, development of cortical efferents, and thalamo cortical pathfinding[J]. The Journal of Comparative Neurology, 2003, 457: 345–360. |
| [24] | Shinozaki K, Yoshida M, Nakamura M, et al. Emx1 and Emx2 cooperate in initial phase of archipallium development[J]. Mechanisms of Ageing and Development, 2004, 121: 475–489. |
| [25] | Yoshida M, Suda Y, Matsuo I, et al. Emx1 and Emx2 functions in development of dorsal telencephalon[J]. Development, 1997, 124(1): 101–111. |
| [26] | Pellegrini M, Pantano S, Lucchini F, et al. Emx2 developmental expression in the primordia of the reproductive and excretory systems[J]. Anatomy and Embryology, 1997, 196(6): 427–433. |
| [27] | Miyamoto N, Yoshida M, Kuratani S, et al. Defects of urogenital development in mice lacking Emx2[J]. Development, 1997, 124(9): 1653–1664. |
| [28] | Eggers S, Sinclair A. Mammalian sex determination—insights from humans and mice[J]. Chromosome Research, 2012, 20(1): 215–238. |
| [29] | Taylor HS, Fei X. Emx2 regulates mammalian reproduction by altering endometrial cell proliferation[J]. Molecular Endocrinology, 2005, 19(11): 2839–2846. |
| [30] | Briata P, Blas ED, Gulisana M, et al. EMX1 homeoprotein is expressed in cell nuclei of the developing cerebral cortex and in the axons of the olfactory sensory neurons[J]. Mechanisms of Development, 1996, 57(2): 169–180. |





