红鳍东方鲀(Takifugu rubripes)隶属于鲀形目(Telraodontiformes)、 鲀科(Tetradontidae)、东方鲀属(Takifugu),是暖水性海洋底栖鱼类,其规格较大、肉质较紧、营养丰富、味道鲜美、经济价值高,为我国北方地区的优良海水养殖鱼类之一[1]。红鳍东方鲀作为鱼类中的模式生物,其基因组草图已经完成,为后续深入研究相关基因及其功能提供了充分的参考资料。
GATA因子是一类具有保守锌指结构域的转录因子,在脊椎动物生长发育过程中具有多种调控功能。GATA家族成员具有2个锌指结构C-X2-C-X17-C-X2-C(C为半胱氨酸,X为可变氨基酸,数值为氨基酸个数),并分别命名为氨基端(N)锌指和羧基端(C)锌指[2]。GATA因子能结合位于靶基因启动子和增强子部位上的一段共同的核苷酸序列[T/A(GATA)A/G],因而这类转录因子被命名为GATA转录因子。根据GATA因子的基因结构和功能,哺乳动物GATA家族的6个成员可以分为两个亚家族,GATA1/2/3亚家族包括GATA1、2、3,主要在造血肝细胞中表达;GATA4/5/6亚家族包括GATA4、5、6,主要在心脏、肠上皮细胞和性腺中表达[3-6]。其中GATA4在调节胚胎形态发育和细胞分化过程中具有重要作用。一些研究表明GATA4参与生物体生长发育的多个过程,如个体的存活,细胞组织的分化和心肌细胞前体的迁移[7]。在小鼠胚胎早期敲除GATA4基因,由于心血管不能形成,导致小鼠早期死亡[8]。小鼠早期雌雄性腺发育过程中,均在未分化的生殖脊中发现GATA4高表达,而在卵巢分化结束后,GATA4的表达迅速下降,在成鼠的卵泡颗粒细胞中有较高表达。在人类的睾丸发育过程中,从胎儿时期到成人,GATA4均有表达[9]。虽然GATA4在鱼类中也有相关研究,如在斑马鱼和青鳉中GATA4调节多种器官的形成[10],但GATA4在鱼类性腺发育中的功能文献报道较少。
实时定量PCR(Quantitative real-time polymerase chain reaction,qRT-PCR)是检测基因表达最灵敏的方法之一,尤其是针对表达量较低的基因[11]。qRT-PCR具有可直接监测扩增中荧光信号变化获得定量结果,精确性高,定量和扩增同步进行[12]等优点。
本研究通过qRT-PCR[13-15]对红鳍东方鲀成鱼肾脏、脑、肌肉、脾脏、肝脏、精巢和卵巢等组织进行GATA4的组织表达分析以及不同发育时期(23、30、40、60和80日龄)的红鳍东方鲀幼鱼个体水平的GATA4表达分析,以期为今后进一步研究红鳍东方鲀GATA4的功能提供参考。
1 材料与方法 1.1 材料实验用3龄健康的红鳍东方鲀成鱼采自大连天正实业有限公司,采集肾脏、脑、肌肉、脾脏、肝脏、精巢和卵巢,保存在RNAlater试剂中。
实验用健康的红鳍东方鲀幼鱼采自大连富谷水产有限公司,分别于23日龄、30日龄、40日龄、60日龄和80日龄时采集幼鱼个体,保存在RNAlater试剂中。
1.2 方法 1.2.1 引物设计及合成按照SYBR Premix Ex TaqTMⅡkit(Tli RNaseH Plus)引物设计原则,用Primer Premier 5软件[16]设计GATA4基因的qRT-PCR引物,利用NCBI上的Primer-BLAST在Takifugu rubripes的基因组和转录组下进行比对,结果显示GATA4引物的特异性好[17]。内参基因选用红鳍东方鲀β-actin基因的引物[18]。引物序列由大连宝生物公司合成,引物信息见表 1。
按照Trizol说明书(上海生工)的步骤提取成鱼肾脏、脑、肌肉、脾脏、肝脏、精巢、卵巢组织和各个时期幼鱼的总RNA。用浓度为1% 的琼脂糖凝胶进行电泳确定总RNA 的完整性,可以明显看到28S、18S 和5S的三条带。利用分光光度计测定RNA 的OD 值以确定RNA 的浓度及纯度,且保证OD260nm/OD280nm 值在1.8-2.0 之间。按照PrimeScriptTM RT reagent Kit(大连宝生物)说明书的步骤,进行反转录反应,获得GATA4 的cDNA。
1.2.3 基因序列的测序及鉴定利用合成的GATA4引物,将获得的cDNA进行PCR扩增,获得GATA4的DNA序列,与pUCm-T vector载体连接,导入到DH5α大肠杆菌感受态细胞中,培养过夜,进行蓝白斑筛选。挑取白斑扩增培养后提取质粒,经琼脂糖电泳检测后的完整质粒送宝生物公司进行测序,进而鉴定引物的可用性。
1.2.4 标准曲线的制定目的基因和内参基因分别设置5组标准品,以水为模板作为阴性对照,每组设置3个平行。β-actin的模板是将上述cDNA原液按100倍、101倍、102倍、103倍和104倍进行稀释。GATA4的模板是将上述cDNA原液按50倍、51倍、52倍、53倍和54倍进行稀释。实时定量设备为ABI公司的Stepone plus荧光定量PCR仪。PCR反应体系(20 μL):2×TransStart®Top Green qPCR SuperMix 10 μL,Passive Reference DyeⅠ(50×)0.4 μL,上下游引物各0.2 μL,cDNA模板1.0 μL,DEPC水8.2 μL。PCR反应条件:95℃预变性30 s;95℃变性5 s,61℃退火15 s,72℃延伸10 s,共40个循环。
1.2.5 相对表达定量荧光PCRβ-actin和GATA4两个基因分别以上述获得的cDNA为模板,进行相对表达实时定量PCR,成鱼肾脏、脑、肌肉、脾脏、肝脏、精巢、卵巢和各时期幼鱼的基因表达分别设置3个重复。
1.2.6 数据处理在β-actin和GATA4的标准曲线的斜率接近的情况下,Stepone plus荧光定量PCR仪输出的相对表达实时定量结果,以相同模板β-actin的表达进行归一化处理,进行2-ΔΔCT数据处理[19-21],GATA4在各个组织的表达量、不同发育时期进行比较。使用SPSS20软件进行数据单因素方差分析[22]和新复极差法(Duncan法)多重比较,显著性水平设为0.05。
2 结果 2.1 基因序列的测序及鉴定结果用BioEdit software打开经公司测得的GATA4 PCR产物序列峰图,查找GATA4引物序列所在位置。根据表 1所示上游引物序列5'-AAACGCAAACCCA-AGAACC-3'进行比对查找,根据表 1下游序列的反向互补序列5'-ATTTCAGCCCTGCCTGC-3'进行比对查找,结果如图 1所示。由图 1可以算出GATA4 PCR片段总长度为191 bp,与用Primer-BLAST比对后的片段长度相同。用MegAlign software打开GATA4 PCR产物FASTA格式的测序结果与GATA4的mRNA序列进行比对,完全吻合。
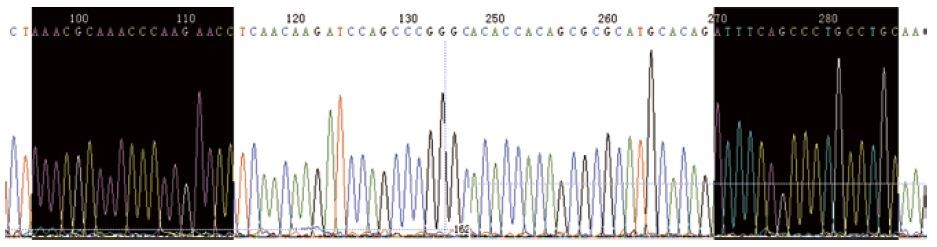
|
| 图 1 GATA4 上游和下游引物序列与测序峰图比对结果 |
通过实时定量PCR反应,GATA4和β-actin的熔解曲线分别在90.64℃和87.82℃处有一峰,且无杂峰,说明此次设计的GATA4引物特异性良好,符合实时定量PCR的要求,可以继续进行实验。
2.3 β-actin和GATA4引物扩增效率的鉴定标准曲线由实时定量PCR仪自动生成,其中纵坐标是荧光信号到达阈值时所经历的循环数,横坐标表示模板的相对浓度(假设原模板的浓度时1,根据稀释倍数,浓度依次递减)。β-actin和GATA4引物的扩增效率分别为99.964%和102.344%,均在90%-105%之间,线性程度在98%以上,说明两对引物可以用于2-ΔΔCT相对定量表达分析。
2.4 红鳍东方鲀GATA4的组织表达红鳍东方鲀GATA4的组织表达结果见图 2。根据标准曲线中目的基因各个浓度的CT值的大小,选择原液作为模板进行GATA4相对表达(2-∆∆ct法)实时定量实验,选用性腺发育成熟后的红鳍东方鲀的肾脏、脑、肌肉、脾脏、肝脏、精巢和卵巢组织作为本实验的样本,分别获得3个个体的肾脏、脑、肌肉、脾脏、肝脏、精巢、卵巢和各时期幼鱼组织的RNA后进行反转录。将模板cDNA和实时定量试剂盒进行混合,用ABI 公司的Stepone plus实时定量仪进行定量,将获得的结果进行整理,得到的结果每个组织3个复孔之间的标准差SD均<0.5。
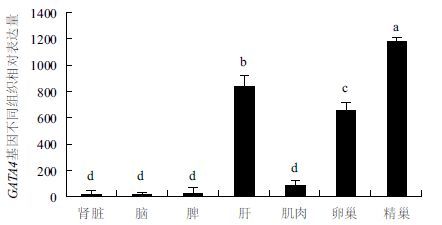
|
| 图 2 红鳍东方鲀GATA4 基因的表达谱 不同字母的柱形表示两者之间存在显著性差异(P<0.05);误差线所示标准差值均扩大200 倍 |
通过SPSS软件进行单因素方差分析和Duncan法多重比较获得两两组织之间的差异显著性,成鱼红鳍东方鲀精巢、卵巢和肝脏GATA4表达量显著高于其他组织(P<0.05);GATA4在精巢中显著性高于肝脏中的表达(P<0.05),而肝脏中的表达量显著高于卵巢中的表达;在肌肉、脾脏、肾脏和脑4个组织中的表达差异不显著。图 2显示,GATA4在精巢中的表达量最高,在脑中最低。精巢中的表达量约是卵巢中的2倍。结果显示,表达量顺序是:精巢>肝脏>卵巢>肌肉>脾脏>肾脏>脑。
2.5 红鳍东方鲀GATA4的不同发育时期表达红鳍东方鲀GATA4的不同发育时期表达结果如图 3所示。红鳍东方鲀雌性个体各个发育时期GATA4的表达情况为:40日龄幼鱼GATA4的表达量最高,与其他时期GATA4的表达量相比,存在显著性差异(P<0.05)。23日龄、30日龄和80日龄幼鱼之间GATA4表达差异不显著;23日龄幼鱼和60日龄幼鱼之间GATA4表达量差异不显著。在雄性个体不同发育时期,30日龄幼鱼GATA4的表达水平显著性高于其他时期(P<0.05)。同样,23日龄幼鱼和80日龄幼鱼,60日龄幼鱼和40日龄幼鱼,两两之间GATA4表达差异不显著,但与其他时期存在显著性差异(P<0.05)。23日龄、30日龄、60日龄雄性幼鱼GATA4的表达量极显著高于同时期的雌性幼鱼,在40日龄时雌性GATA4的表达极显著高于雄性表达;80日龄雄性幼鱼的表达显著性高于雌性幼鱼。
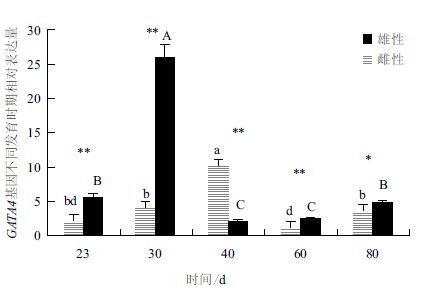
|
| 图 3 红鳍东方鲀GATA4 基因在发育过程中的表达 标有大、小写字母的柱形分别表示雄性、雌性红鳍东方鲀GATA4 表达量的差异显著性水平,不同字母表示存在显著性差异(P<0.05);** 表示GATA4表达量在同一时期的雌雄性间存在的差异极显著(P<0.01);* 表示GATA4表达量在同一时期的雌雄性间存在的差异显著(P<0.05) |
雌性幼鱼5个发育时期中,从23日龄到40日龄逐渐升高,40日龄最高,随后表达量降低到60日龄,从80日龄后又有上升的趋势。在雄性幼鱼5个发育时期,GATA4表达量从23日龄到30日龄逐渐升高,30日龄最高,随后表达量降低到40日龄,从60日龄到80日龄又有上升的趋势。各时期雌雄幼鱼GATA4的表达量比较,除40日龄外,其他各个时期在雄性中的表达量均高于在雌性中的表达量。
3 讨论 3.1 GATA4的组织表达人们曾对一些动物GATA4的结构和功能做了深入研究,其中,对人、小鼠等哺乳动物中GATA4的研究较广、较全面,研究了各组织中的表达,发现GATA4在很多器官的重要发育时期都有表达,如:心脏、肝脏、胃、胰腺、肠、肾上腺等,并且在雌雄性腺中均有表达,GATA4在性腺的发育早期高表达,之后的发育过程中,在精巢的支持细胞和间质细胞中表达,在卵巢的颗粒细胞中有表达[23]。叶凯等[24]通过qRT-PCR研究罗非鱼GATA4组织表达模式,检测到GATA4在心脏、肝脏、肠、精巢、卵巢和头肾中均有表达。与哺乳动物和罗非鱼中的GATA4组织表达情况一样,qRT-PCR检测红鳍东方鲀成鱼的7个组织:肾脏、脑、肌肉、脾脏、肝脏、精巢和卵巢组织中GATA4在各组织中也有广泛表达。
在哺乳动物中,Hu等[25]通过对小鼠GATA4的沉默,进行包埋荧光免疫切片观察,结果显示实验组小鼠胚胎中没有性腺发育的痕迹,而在对照组中发现性腺发育的上皮细胞明显增厚,也发现GATA4在性腺的形成中必不可少。红鳍东方鲀在精巢中GATA4表达量最高,其次是肝脏中的表达量,卵巢中的表达量排第3,在肌肉中少量表达,肾脏、脑和脾脏中表达量极少。罗非鱼[26]GATA4主要在肝脏中表达,其次是精巢、卵巢和心脏,可以看出GATA4在红鳍东方鲀和罗非鱼的性腺中均有较高的表达,推测GATA4对性腺发育过程具有重要作用。
本研究还发现红鳍东方鲀精巢的表达量高于卵巢,预测红鳍东方鲀中的GATA4对雄性性腺发育至关重要。叶凯等[24]通过qRT-PCR研究罗非鱼GATA4组织表达模式,发现GATA4能上调雄性相关基因Amh的表达,抑制雌雄通路相关基因cyp19a1a的表达,通过基因调节苗勒管的退化和雄性激素的产生来促成雄性生殖腺的发育,从而表明GATA4可能是雄性通路上的重要基因。Manuylov等[27]通过敲除GATA4的小鼠胚胎,发现睾丸间质细胞急剧减少,而且卵巢特异性表达基因foxl2被发现,GATA4在小鼠中影响性腺的分化[28, 29]。这些实验均表明GATA4在雄性性腺发育中具有重要作用。
3.2 GATA4在不同发育时期的表达应用qRT-PCR检测红鳍东方鲀不同发育时期(23、30、40、60和80日龄)个体GATA4的表达情况,各时期雌雄幼鱼的GATA4表达量对比发现,除40日龄外,其他各个时期GATA4表达量在雄性中均高于在雌性中的表达量,这与前面得出的结果一致。
雌性幼鱼GATA4表达从23-40日龄之间表达量逐渐升高,在40日龄时表达量最高,之后下降。幼鱼雄鱼GATA4表达从23-30日龄之间,表达量逐渐升高,在30日龄时表达量最高,之后下降。斑马鱼[30]GATA4在胚胎发育50%外包之前表达量较低,从75%外包开始升高并且在胚胎封口期表达量达到最高,随后表达量降低,稳定表达到12 d左右,之后有所降低。两者的GATA4不同时期表达量的总体趋势相同,都是先升高后降低,但是出现表达量最高的时间不同,这是由于红鳍东方鲀和斑马鱼的发育周期不同。在两种鱼的形态发育早期,GATA4均表现出高水平表达。
根据GATA4介导类固醇生物合成步骤中所需要的基因,从而调节雌雄激素的合成,影响性腺的发育,成熟。红鳍东方鲀幼鱼性腺分化或者发育的关键时期,雌雄性激素大量合成,需要GATA4进行调节,从而导致GATA4的高表达。雄鱼23日龄,雌鱼40日龄GATA4的高表达是否由于性腺的分化引起,有待进一步探究,例如可以研究GATA4调节的下游雌性相关基因cyp19a或者雄性相关基因gsdf在红鳍东方鲀发育过程中的表达及其功能。
4 结论本研究利用qRT-PCR对GATA4在红鳍东方鲀成鱼不同组织中和幼鱼不同发育阶段的表达进行了初步的分析,GATA4在精巢中表达量最高,其次是在肝脏、卵巢中的表达量,且在精巢中的表达量接近在卵巢中的表达量的2倍。GATA4在23日龄、30日龄、40日龄、60日龄和80日龄各阶段的表达,除40日龄外,其他各个时期GATA4在雄性中的表达量均高于在雌性中的表达量。雌性幼鱼GATA4的表达量从23-40日龄,表达量逐渐升高,在40日龄时达到最高值,之后下降。雄鱼幼鱼GATA4的表达量从23 日龄到30日龄,表达量逐渐升高,30日龄时表达量最高,之后下降。
| [1] | 万蓁蓁. 青岛: 中国海洋大学[M]. 2005. |
| [2] | Santhanam B, Cai H, Devreotes PN, et al. The GATA transcription factor GtaC regulates early developmental gene expression dynamics in Dictyostelium[J]. Nature Communications, 2015, 6: 7551. |
| [3] | Ludwig LS, Gazda HT, Eng JC, et al. Altered translation of GATA1 in Diamond-Blackfan anemia[J]. Nat Med, 2014, 20: 748–753. |
| [4] | El-Hachem N, Nemer G. Identification of new GATA4-small molecule inhibitors by structure based virtual screening[J]. Bioorganic & Medicinal Chemistry, 2011, 19(5): 1734–1742. |
| [5] | Lu H, Huang S, Zhang X, et al. DNA methylation analysis of SFRP2, GATA4/5, NDRG4 and VIM for the detection of colorectal cancer in fecal DNA[J]. Oncology Letter, 2014, 8(4): 1751–1756. |
| [6] | Vale-Pereira S, Todo-Bom A, Geraldes L, et al. FoxP3, GATA-3 and T-bet expression in elderly asthma[J]. Clinical & Experimental Allergy, 2011, 41(4): 490–496. |
| [7] | Charron F, Paradis P, Bronchain O, et al. Cooperative interaction between GATA-4 and GATA-6 regulates myocardial gene expression[J]. Mol Cell Biol, 1999, 19(6): 4355–4365. |
| [8] | Kuo CT, Morrisey EE, Anandappa R, et al. GATA4 transcription factor is required for ventral morphogenesis and heart tube formation[J]. Genes Dev, 1997, 11: 1048–1060. |
| [9] | Ketola I, Pentik?inen V, Vaskivuo T, et al. Expression of transcription factor GATA-4 during human testicular development and disease[J]. The Journal of Clinical Endocrinology & Metabolism, 2000, 85(10): 3925–3931. |
| [10] | Holtzinger A, Evans T. GATA4 regulates the formation of multiple organs[J]. Development, 2005, 132: 4005–4014. |
| [11] | Di ME, Cangemi G, Filippetti M, et al. Development and clinical validation of a real- time PCR using a uni-molecular Scorpionbased probe for the detection of Mycoplasma pneumoniae in clinical isolates[J]. New Microbiol, 2007, 30(4): 415–421. |
| [12] | 陈旭, 齐凤坤, 康立功, 等. 实时荧光定量PCR 技术研究进展 及其应用[J]. 东北农业大学学报, 2010, 41(8): 148–155. |
| [13] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using Real-Time Quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. |
| [14] | 唐永凯, 贾永义. 荧光定量PCR 数据处理方法的探讨[J]. 生物技术, 2008, 18(3): 89–91. |
| [15] | Zhang C, Wang X, Liu Y. Simultaneous detection of enteroviruses from surface waters by real-time RT-PCR with universal primers[J]. J Environ Sci, 2010, 22(8): 1261–1266. |
| [16] | 黄韧. 生物信息学网络资源与应用[M]. 广东: 中山大学出版社, 2003. |
| [17] | 尤超, 赵大球, 梁乘榜, 等. PCR 引物设计方法综述[J]. 现 代农业科技, 2011, 17: 48–51. |
| [18] | 闻涛. 红鳍东方鲀性别相关基因表达的初步研究[D]. 大连: 大连海洋大学, 2013. |
| [19] | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T)method[J]. Nat Protocols, 2008, 3(6): 1101–1108. |
| [20] | Teng X, Zhang Z, He G, et al. Validation of reference genes for quantitative expression analysis by real-time rt-PCR in four lepidopteran insects[J]. Journal of insect Science, 2012, 12: 60. |
| [21] | Feng S, Tan H, Ling H, et al. Detecting overexpression level of HER2 gene in NSCLC by real-time quantitative PCR and the 2[J]. 中国肺癌杂志, 2011, 14(12): 938–942. |
| [22] | 王济平. SPSS 简明操作教程- 以案例分析为导向[M]. 武汉: 湖北科学技术出版社, 2012.125-167. |
| [23] | Tremblay JJ, Viger RS. Transcription factor GATA-4 is activated by phosphorylation of serine 261 via the cAMP/Protein kinase a signaling pathway in gonadal cells[J]. The Journal of Biological Chemistry, 2003, 278(24): 22128–22135. |
| [24] | 叶凯. 尼罗罗非鱼GATA 因子表达及其功能的初步研究[D]. 重庆:西南大学, 2012. |
| [25] | Hu YC, Okumura LM, Page DC. GATA4 is required for formation of the genital ridge in mice[J]. PLoS Genetics, 2013, 9(7): 1–12. |
| [26] | Li J, Chen W, Wang D, et al. GATA4 is involved in the gonadal development and maturation of the teleost fish tilapia, Oreochromis niloticus[J]. J Reprod Dev, 2012, 58(2): 237–242. |
| [27] | Manuylov NL, Zhou B, Ma Q, et al. Conditional ablation of GATA4 and Fog2 genes in mice reveals their distinct roles in mammalian sexual differentiation[J]. Dev Biol, 2011, 353: 229–241. |
| [28] | Bouma GJ, Washburn LL, Albrecht KH, et al. Albrecht Correct dosage of Fog2 and GATA4 transcription factors is critical for fetal testis development in mice[J]. Proc Natl Acad Sci USA, 2007, 104(38): 14994–14999. |
| [29] | Zaytouni T, Efimenko EE, Tevosian SG. GATA transcription factors in the developing reproductive system[J]. Advance in Genetics, 2011, 76: 93–134. |
| [30] | 田佳, 王艺磊, 陈芸, 等. 斑马鱼性别决定相关基因的表达分 析[J]. 水生态学, 2010, 3(5): 10–16. |




