2. 广州万孚生物技术股份有限公司,广州 510663
2. Guangzhou Wondfo Biotech Corporation Ltd.,Guangzhou 510663
N末端B型钠尿肽原(NT-proBNP)是心肌细胞在合成多肽类激素B型钠尿肽(BNP)的过程中所产生无生物活性的直链多肽片段[1]。当负荷引起心室压力变化以及室壁张力的增加时,心室肌细胞就会合成和分泌NT-proBNP,因此NT-proBNP浓度的升高可以很好地反映心室结构和功能的改变,以及心脏有无损伤及损伤程度[2]。目前,NT-proBNP已被公认为心功能紊乱最敏感和最特异的指标,是诊断心力衰竭的一个具有划时代意义的客观标志物[3]。
目前国际上检测人NT-proBNP常用的是免疫学方法,主要为NT-proBNP快速诊断试剂,其类型包括多克隆抗体和特异性强、灵敏度高的单克隆抗体。但是市售的NT-proBNP快速诊断试剂基本为国外公司所垄断,如罗氏及生物梅里埃。而国内在NT-proBNP上的研究远远晚于国外,长期依赖进口,给病患带来沉重的经济负担[4]。因此自主研发制备优质的抗NT-proBNP商品化单克隆抗体可加快国内NT-proBNP快速诊断试剂的研发。本实验采用传统的免疫学方法制备NT-proBNP单克隆抗体,以期为其快速诊断试剂的开发提供良好的物质条件。
1 材料与方法 1.1 材料 1.1.1 材料及试剂雌性 Balb/c小鼠:6-8周龄,SPF级,中山大学医学院实验动物中心;SP2/0 骨髓瘤细胞,南方医科大学;带DSBA标签重组NT-proBNP(hrNT-proBNP-DSBA)、抗人NT-proBNP 单克隆抗体H1、抗人NT-proBNP单克隆抗体H3,广州万孚公司提供;小鼠单抗Ⅰg类/亚类鉴定用ELⅠSA试剂盒,洛阳佰奥通实验材料中心;完全弗氏佐剂、不完全弗氏佐剂,美国Sigma公司;其他试剂均是分析纯。
1.1.2 仪器96孔酶标板:深圳金灿华;酶标仪,Thermo scientific MK3;Gel DocTMXR+型凝胶成像系统:美国伯乐公司。
1.2 方法 1.2.1 NT-proBNP特异性单克隆抗体的制备 1.2.1.1 动物免疫按照50 μg重组蛋白/只小鼠的剂量将免疫原注射到Balb/c小鼠体内进行第1次免疫。15 d后,按照25 μg重组蛋白/只小鼠的剂量进行第2次免疫。第25天后进行第3次免疫(同第2次免疫)。第35天后进行第四次免疫(同第3次免疫),免疫完成后7 d用间接ELⅠSA法检测小鼠血清抗体效价[5]。
于融合前3 d按每只小鼠100 μg重组蛋白(hrNT-proBNP-DSBA)的剂量,不加佐剂,直接小鼠尾静脉注射进行加强,准备融合。
1.2.1.2 细胞融合和阳性克隆孔的筛选采用PEG诱导的半固体基培养法进行细胞融合实验[6],将免疫效价达融合要求的脾细胞与SP2/0细胞按10∶1比例进行混合细胞培养[7, 8]。采用间接ELⅠSA法筛选出对hrNT-proBNP-DSBA和hrNT-proBNP均呈阳性的细胞株[9]。免疫小鼠血清、抗人NT-proBNP单克隆抗体H1和H3分别稀释1 000倍作阳性对照,未经免疫小鼠血清稀释1 000倍作阴性对照,空白对照为稀释液。
1.2.1.3 阳性杂交瘤细胞的亚克隆有限稀释法对筛选出来的阳性杂交瘤细胞进行单细胞分离培养[10],间接ELⅠSA法进行检测,选取对hrNT-proBNP检测结果是阳性最强的克隆,进行连续亚克直至细胞阳性率100%,即可定株。
1.2.1.4 细胞冻存和复苏用冻存液将2.1.3得到的单克隆杂交瘤细胞株制成1×106个/mL的细胞悬液,液氮保存。复苏时,取出冻存管,立即放入37℃水浴中,离心去除冻存液,最后移入培养瓶内培养。
1.2.1.5 单克隆抗体的生产与纯化选取健康成年F1小鼠,液体石蜡腹腔注射0.5 mL/只。一周后,收集生长状态良好的杂交瘤细胞,当细胞浓度为0.5×106-1×106个/mL,每只小鼠腹腔注射0.5 mL。7-12 d后,采集小鼠腹水。通过正辛酸-饱和硫酸铵法纯化腹水[11]。
1.2.2 单克隆抗体的分析鉴定 1.2.2.1 单克隆抗体亚类的鉴定将无标签重组蛋白hrNT-proBNP稀释至0.25 μg/mL,加入96孔酶标板中进行抗原的包被。采用ELⅠSA试剂盒,按照说明书操作测定单克隆抗体亚类。
1.2.2.2 腹水及纯化后抗体效价的测定用动物体内诱生法制备单抗腹水,间接ELⅠSA法进行鉴定[12],经Bradford法测定纯化后蛋白浓度。再将腹水或蛋白浓度调整到1 mg/mL,纯化后抗体分别用稀释液稀释103、104、105、106和107倍,当OD450值大于阴性对照值2.1倍以上的稀释倍数时的值作为腹水及抗体的效价。融合小鼠的血清稀释1 000倍作阳性对照,未经免疫小鼠血清稀释1 000倍作阴性对照,稀释液作空白对照。
1.2.2.3 纯化后抗体纯度的测定每个上样孔加入5 μg左右的抗体蛋白,使用SDS-PAGE电泳法并结合美国伯乐公司的 Gel DocTMXR+型凝胶成像系统,检测纯化后抗体纯度[13]。
1.2.2.4 单克隆抗体特异性鉴定(1)Western blot鉴定单克隆抗体与特异抗原的反应原性:以无标签重组蛋白hrNT-proBNP,采用Western blot法检测抗原抗体的识别反应[14],排除产生针对带DSBA标签和其它无关杂蛋白的抗体。
(2)间接ELⅠSA法测定单克隆抗体与其它心肌标志物的交叉反应性:在制备针对hrNT-proBNP快诊试剂的单克隆抗体时,必须检测该抗体与其它心肌标志物有无交叉反应,本实验采用间接ELⅠSA法测定单克隆抗体与其它心肌标志物的反应,包括心型脂肪酸结合蛋白(H-FABP)、肌红蛋白(Myo)、肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白Ⅰ(CTnⅠ)等,以排除这些干扰因素影响。
1.2.2.5 检测单克隆抗体的相对亲和力采用非竞争ELⅠSA法测定[15-17]亲和常数,用以评价抗体与抗原结合的紧密程度,结合越牢固,则亲和力越强。将无标签重组蛋白hrNT-proBNP稀释至1 μg/mL,进行倍比稀释,连续稀释11个梯度,最后酶标仪读取OD450数值。选择4个最合适的包被浓度,每个浓度包被2行,重复实验。
1.2.2.6 单克隆抗体细胞稳定性实验将定株的细胞株扩大培养至T25培养瓶中,连续传代培养3个月,每隔半个月使用间接ELⅠSA法检测细胞培养上清的抗体效价,以确定细胞株分泌抗体能力的稳定性。
2 结果 2.1 免疫小鼠血清效价分析间接ELⅠSA法测定第4次免疫7 d后小鼠尾静脉血清的效价。结果(图 1)显示,小鼠均能产生只针对NT-proBNP的抗体,且抗体效价均达106,符合融合要求。
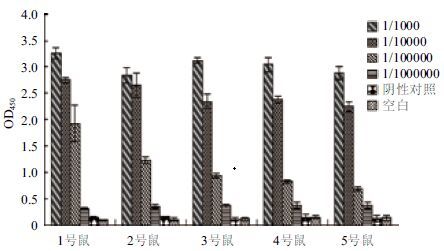
|
| 图 1 第4 次免疫后小鼠血清的效价 |
本实验共进行5次细胞融合实验,累计挑取5 000株左右的杂交瘤细胞。最终得到4株对hrNT-proBNP-DSBA和hrNT-proBNP均显阳性的细胞株,分别命名1G12、1B2、3D5和2D11,检测结果如图 2所示。

|
| 图 2 阳性杂交瘤细胞株的筛选 |
单克隆抗体亚类的鉴定结果(图 3)显示,1G12和1B2均为ⅠgG2a型,2D11为ⅠgG1型,3D5为ⅠgG2b型。

|
| 图 3 四株单克隆抗体的亚类型鉴定 |
采用间接ELⅠSA对小鼠腹水效价进行测定,结果(图 4)显示,1G12、1B2和3D5的腹水效价均能达到106,而2D11的效价仅达104。

|
| 图 4 四株腹水的效价检测结果 |
根据Bradford法标准曲线,测得4株纯化后抗体1G12、1B2、3D5和2D11的蛋白浓度分别为3.98、4.96、3.18和3.97 mg/mL。将抗体浓度均调节至1 mg/mL,测定抗体的效价,结果(图 5)显示,1G12、1B2 和3D5抗体的效价均能达到106,而2D11的效价仅达104。
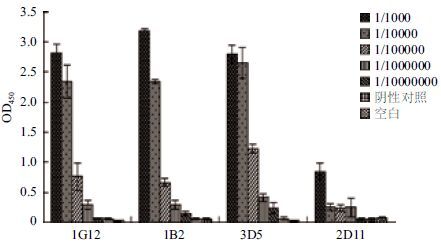
|
| 图 5 四株单克隆抗体的效价检测结果 |
检测4株纯化后单克隆抗体的纯度,结果(图 6)显示,4株抗体均可见两条明显的主带,抗体重链大约为50 kD,轻链约为25 kD。经分析测得,单克隆抗体1G12、1B2、3D5和2D11的纯度分别为79.8%、86.3%、84.4%和75.3%,均大于75%。
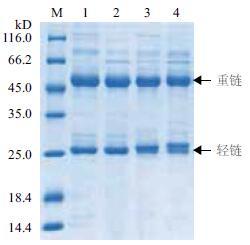
|
| 图 6 SDS-PAGE 电泳分析纯化后的抗体纯度 M :蛋白分子量 Marker ;1 :1G12 ;2 :1B2 ;3 :2D11 ;4 :3D5 |
blot鉴定结果 结果(图 7)显示,4株单克隆抗体均能与分子量约为8 kD的hrNT-proBNP产生反应,且条带明显,无其它杂带。表明这4株单抗均为抗hrNT-proBNP的单克隆抗体,与间接ELⅠSA法的筛选结果一致。
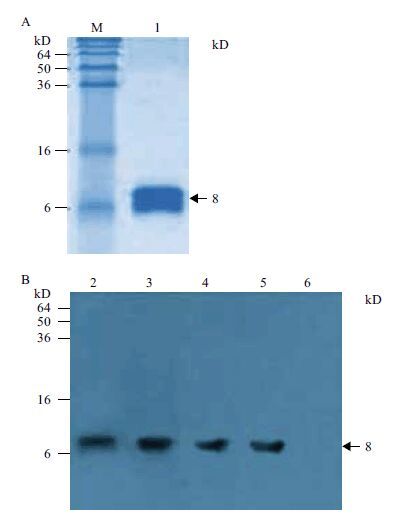
|
| 图 7 四株单克隆抗体的Western blot 分析 M :蛋白分子量 Marker ;1 :hrNT-proBNP ;2 :1G12 ;3 :1B2 ;4 :3D5 ;5 :2D11 ;6 :Mab-hH-FABP 1B9 |
结果(图 8)显示,4株单克隆抗体与重组蛋白hrNT-proBNP呈明显的阳性反应,与其它蛋白均无特异性交叉反应。

|
| 图 8 四株单克隆抗体与其它心肌标志物的交叉反应性 |
单克隆抗体相对亲和力检测结果(图 9)显示,1G12、1B2、3D5和2D11四株单克隆抗体识别包被抗原hrNT-proBNP的亲和常数依次为9.32×1011、1.07×1012、2.31×1012和6.33×1010。
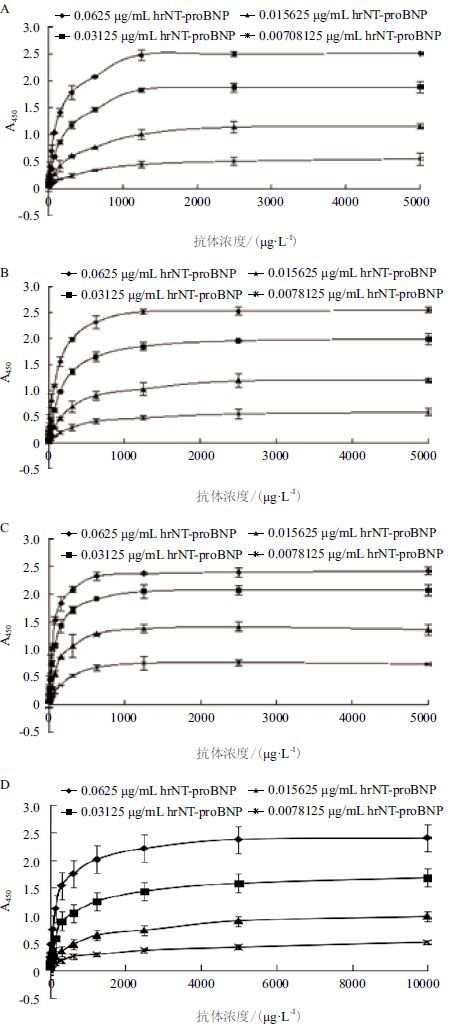
|
| 图 9 非竞争ELⅠSA 法检测1G12(A)、1B2(B)、3D5(C)和2D11(D)的亲和常数 |
杂交瘤细胞株分泌抗体能力的稳定性的检测结果(图 10)表明,4株细胞均能连续3个月稳定分泌特异性抗hrNT-proBNP的抗体。
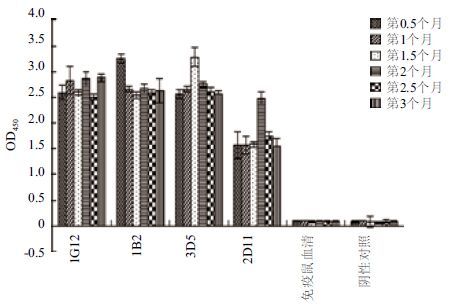
|
| 图 10 四株杂交瘤细胞株分泌抗体能力的稳定性的检测 |
BNP隶属于钠尿肽家族,是一种肽类激素,具有利尿、利钠、抗肾素—血管紧张素—醛固酮系统、舒张血管和降低血压等作用,参与人体水盐平衡的调节。而NT-proBNP则是BNP形成过程中所产生的无生物活性的氨基酸片段,NT-proBNP生物半衰期更长更稳定,是比BNP更敏感可靠的指标,因此在临床应用上逐渐取代了BNP。正常人体内,NT-proBNP 水平极低,外周血的浓度一般小于450 pg/mL,当因容量负荷引起心室压力的改变以及室壁张力的增加时,会刺激BNP分泌,因此血液中NT-proBNP浓度的升高能很好地反映心室结构和功能的改变,心脏有无损伤及损伤程度[18]。大量临床研究表明NT-proBNP在预测心力衰竭和术后监测方面是代表性标志物,是一个强有力的独立预测因子[19]。近年来NT-proBNP在检测胎儿PDA和双胞胎宫内生长受限方面也取得了重要的进展,成为一个更加重要的指标[20, 21]。
国际上检测NT-proBNP最常用的是免疫学方法,包括双抗体夹心法,荧光免疫层析法,电化学发光法等多种方法,而电化学发光法由于特异性强,灵敏度高,检测线低得到广泛应用。免疫学方法中诊断试剂盒检测的准确性、稳定性与抗体的性能如特异性、稳定性密切相关[22]。单克隆抗体由于特异性强,均一性高,生物活性单一和来源稳定,易于大量生产等优点在疾病研究及诊断中的应用逐步取代了多克隆抗体。但生产检测试剂所需要的单抗隆抗体基本上被国外公司所垄断,价格昂贵,因此国内自主研发优质单克隆抗体显得很重要。制备单克隆抗体基本分为两种方法,传统的免疫学方法和基因工程的方法,传统免疫学方法技术成熟应用更为广泛者,而基因工程技术由于可获得大量高活性,高纯度,特异性强的抗体的优点,在临床研究中逐步有所应用。本研究采用传统免疫学方法制备了4株单克隆抗体,本章共进行了5次的细胞融合实验,经间接ELⅠSA法筛选和亚克隆后,共获得4株能稳定分泌抗人NT-proBNP单克隆抗体的阳性杂交瘤细胞株1G12、1B2、3D5和2D11。采用小鼠体内诱生法大量制备单抗腹水并用正辛酸-硫酸铵沉淀法对腹水进行纯化获得4株相应的单克隆抗体。经鉴定,4株单克隆抗体的纯度均达75%以上,且与人H-FABP、Myo、CK-MB、CTnⅠ等4种常见心肌标志物的天然蛋白均无交叉反应,特异性良好;1G12、1B2和3D5的抗体效价可达106,相对亲和常数分别为9.32×1011、1.07×1012、2.31×1012;而2D11的抗体效价达104,相对亲和常数为6.33×1010。2D11抗体效价和亲和常数明显低于其它3株抗体,针对开发免疫层析式快速诊断试剂时,需要高亲和力的抗体才能实现检测灵敏,快速。这表明2D11极可能不适合应用于荧光免疫层析平台。
利用本实验室特有的甲基纤维素半固体基培养法进行杂交瘤细胞培养和筛选,在显微镜下直接挑取单细胞克隆,大大地减少了利用传统的有限稀释法进行细胞亚克隆的次数,极大地提高了抗体制备的工作效率。获得了4株特异性抗人NT-proBNP的单克隆抗体,丰富了国内市场NT-proBNP单抗的种类。NT-proBNP是一种标志性的心肌标志物,其临床应用价值必将越来越广泛。因此针对NT-proBNP不同抗原表位的单克隆抗体也必将逐渐丰富起来,同时为了增加诊断的准确性,结合其它的标志物如cTnⅠ等制备复合型快速诊断试剂在未来必将有更加广泛的应用。国内POCT市场对其快速定量试剂诊断的需求必将越来越旺,研发更多国内优质的NT-proBNP单克隆抗体对冲破国际市场的垄断,降低成本,减轻病患的负担有更加积极的意义。
4 结论本研究共进行了5次的细胞融合实验,经间接ELⅠSA法筛选和亚克隆后,共获得4株能稳定分泌抗人NT-proBNP单克隆抗体的阳性杂交瘤细胞株1G12、1B2、3D5和2D11。
| [1] | 郭晋元, 刘敏. BNP/NT-proBNP 在诊断心力衰竭方面的进展[J]. 科技信息, 2011, 14(3): 525–526. |
| [2] | 易维京. 人NT-proBNP 单克隆抗体的制备及其免疫传感器的初 步研究[D]. 广州:第三军医大学, 2008. |
| [3] | 马茹, 张巧令. BNP、NT-proBNP 在心血管疾病中的应用进 展[J]. 中西医结合心脑血管病杂志, 2012, 8(2): 987–988. |
| [4] | 易维京, 梁文斌, 李鹏, 等. 诊断用抗人NT-proBNP 抗体的制 备及其应用[C]. 重庆:重庆市生物化学与分子生物学学术 会议, 2009. |
| [5] | Deng A, Tan W, He S. Monoclonal antibody-based enzyme linked immunosorbent assay for the analysis of jasmonates in plants[J]. Journal of Ⅰntegrative Plant Biology, 2008, 16(8): 1046–1052. |
| [6] | 王红. 人降钙素原单克隆抗体的制备及其应用研究[D]. 广州: 华南理工大学, 2012. |
| [7] | 金涌. 单克隆抗体技术及其在食品卫生检验中的应用[J]. 农 牧产品开发, 2001, 23(5): 9–12. |
| [8] | 何莹, 郑怡麟, 陈安, 等. 抗人NGAL 单克隆抗体的制备及其 定量检测方法的建立[J]. 免疫学杂志, 2013, 16(1): 50–54. |
| [9] | 朱佳男, 姚娜, 官丽莉, 等. KGF-2 单克隆抗体间接ELⅠSA 筛 选方法的建立[J]. 北华大学学报:自然科学版, 2010, 20(3): 222–224. |
| [10] | 胡智颖, 万云霞, 郭素娟, 等. 抗人BPⅠ_(23)单克隆抗体 的制备和鉴定[J]. 基础医学与临床, 2009, 10(6): 1097–1101. |
| [11] | 周玉, 李岩松, 潘风光, 等. 小鼠腹水ⅠgG 类单克隆抗体纯化 方法的研究[J]. 黑龙江畜牧兽医, 2006, 10(8): 14–16. |
| [12] | 杜春红, 钟佑宏, 陈平, 等. BALB/c 小鼠选择与腹水产量和抗 体效价间关系的研究[J]. 实验动物科学, 2008, 34(6): 9–11. |
| [13] | 周华蕾, 吕茂民, 王娜, 等. 应用A 蛋白亲和层析法纯化单克 隆抗体[J]. 生物技术通报, 2005, (5): 72–74. |
| [14] | 郑怡麟, 何莹, 陈安, 等. 抗人降钙素原特异性单克隆抗体的 制备鉴定及初步应用[J]. 广州:第三军医大学学报, 2013, 21(6): 523–526. |
| [15] | 倪超. HⅠV-1 核心蛋白p24 单克隆抗体的制备及其在免疫检 测中的应用[D]. 广州:华南理工大学, 2013. |
| [16] | 白慧玲, 赵粤萍, 刘广超, 等. 非竞争ELⅠSA 法测定抗DR5 单克隆抗体功能性亲和常数[J]. 河南大学学报:医学版, 2005, 18(4): 11–13. |
| [17] | Beatty JD, Beatty BG, Vlahos WG. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J]. Journal of Ⅰmmunological Methods, 1987, 100(1-2): 173–179. |
| [18] | 胡大一, 杨振华. B 型钠尿肽的临床应用和最新进展[M]. 北京: 北京科学技术出版社, 2006.27-28. |
| [19] | 林敏瑜, 刘菁, 辛福顺, 郑伯仁. 慢性心衰患者NT-proBNP、 血浆肌钙蛋白Ⅰ、hsCRP 检测的意义[J]. 心血管康复医学杂志, 2012, 15(4): 379–382. |
| [20] | Talar T, Gulczyńska E, Cyranowicz B. Early fluid administration in extremely preterm newborns(with birth body mass ≤ 1200g) and its relationship with the level of NT-PROBNP and PDA[J]. Pediatric Research, 2011, 70: 740. |
| [21] | Fujiok K, Mizobuchi M, Saka H. N-terminal pro-brain natriuretic peptide levels in monochorionic diamniotic twins with selective intrauterine growth restriction[J]. Journal of Perinatology, 2014, 34: 6–10. |
| [22] | 戴雯, 李艳, 苏汉文, 等. 标本类型及存放时间对心衰患者 BNP 和NT-proBNP 检测结果的影响[J]. 微循环学杂志, 2012, 20(2): 37–38. |




