2. 河南农业大学牧医工程学院,郑州 450002
2. College of Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002
抗菌肽(Antibacterial peptide)是生物体内具有免疫屏障作用的一类多肽,是天然免疫系统中不可缺少的重要组成部分[1]。自20世纪70年代末Boman等[2]首次在惜古天蚕(Hyalopbora cecropia)中发现抗菌肽天蚕素(Cecropin)以来,迄今已有1 000多种具有抗菌活性的多肽被分离鉴定,且来源于昆虫的抗菌肽就有200多种。由于抗菌肽一般都具有抗细菌的活性,有的还具有抗病毒、抗原虫及抑制和杀伤肿瘤细胞等活性,并且具有热稳定性好、对正常细胞没有损害、不易产生耐药性等特点,已成为人们关注的热点。
家蝇能够在恶劣的环境中生存,在其长期抵御微生物的侵袭中形成了独特的免疫系统,人们对于家蝇抗菌肽的研究越来越多,其中研究较详细的有attacin、defensin、cecropin,而对双翅肽diptericin的研究较少。从昆虫体内提取天然抗菌肽的得率少,生产成本高,因此,构建基因工程菌来实现抗菌肽的高效表达成为人们研究的热点。本研究从家蝇幼虫体内克隆得到diptericin基因,与pGEX-4T-1载体连接后,在大肠杆菌BL21中进行表达,旨为后续筛选可以高效表达diptericin蛋白的基因工程菌提供参考。
1 材料与方法 1.1 材料 1.1.1 实验菌株家蝇 Musca domestica 种蝇由河南省疾病预防控制中心惠赠,幼虫由本实验室饲养,饲养温度25℃,相对湿度50%-70%;大肠杆菌DH5α、BL21购自天根生物生化科技有限公司,克隆质粒pMD19-T购自宝生物工程有限公司;大肠杆菌ATCC-25922和表达质粒pGEX-4T-1由本实验室保存。
1.1.2 试剂GSTrap HP,1 mL购自GE Healthcare Life Sciences,RNAiso Plus、M-MLV反转录酶、Taq DNA聚合酶、T4 DNA Ligase、蛋白质分子量标准、限制性内切酶EcoRⅠ、XhoⅠ和DNA Marker为TaKaRa公司产品,质粒提取和DNA纯化回收试剂盒购自天根生物科技有限公司,其它试剂为国产和进口分析纯。PCR引物合成及DNA序列测定由上海生物工程技术服务有限公司完成。
1.2 方法 1.2.1 家蝇幼虫总RNA的提取微生物刺激家蝇:培养大肠杆菌ATCC-25922至OD600=0.6-0.8,离心收集菌体,用生理盐水洗涤两次后重悬,最终OD600=1.8-2.0。选取大小均一、活动能力强的家蝇3日龄幼虫,用带有大肠杆菌的针刺破家蝇幼虫后1/3,饲养6 h后收集幼虫于液氮保存。总RNA提取:将幼虫于液氮研磨后,加入RNAiso Plus,提取总RNA(具体步骤按照RNAiso Plus试剂盒说明书),用1%琼脂糖凝胶电泳检测RNA的完整性,并测定RNA浓度及纯度。
1.2.2 RT-PCR克隆家蝇抗菌肽diptericin基因从GenBank中查到家蝇diptericin基因mRNA序列(GenBank ID:FJ795370.1),在其编码区设计引物,上游引物引入EcoRⅠ酶切位点,下游引物引入XhoⅠ酶切位点(下划线),并加入27个碱基的HA标签序列(斜体)。
P1:5'-TTAGAATTCAACAAAATGAAATATCTCTGGGCCATTGTTC-3';P2:5'-TATCTCGAGTCAAGCGTAGTCTGGGACGTCGTATGGGTACCATCTGTAGGTATAAC-3'。
以提取的总RNA为模板,用随机引物进行反转录合成cDNA第一链,反转录过程严格参照M-MLV反转录酶1st-strand cDNA合成的操作方法。以cDNA为模板,P1、P2为引物,扩增家蝇diptericin基因。PCR产物经纯化回收后,在T4 DNA连接酶作用下与pMD19-T载体连接,转化大肠杆菌DH5α,利用蓝白斑筛选方法筛选阳性克隆,具体方法参照《分子克隆实验指南》[3]第15章。挑选阳性克隆进行菌落PCR鉴定、EcoRⅠ和XhoⅠ双酶切鉴定,鉴定后的阳性克隆送至上海生工生物技术有限公司测序。
1.2.3 pGEX-4T-1-diptericin重组表达质粒的构建将重组克隆pMD19-T-diptericin质粒和表达载体质粒pGEX-4T-1同时进行EcoRⅠ和XhoⅠ双酶切,并纯化回收diptericin基因和pGEX-4T-1质粒,回收产物经T4 DNA连接酶连接后,转化大肠杆菌BL21,利用转化子的Amp抗性在LB平板上进行筛选,阳性克隆进行质粒PCR鉴定及双酶切鉴定,并进行测序,确定有正确的阅读框,无碱基突变后进行下步实验。
1.2.4 diptericin基因的融合表达从平板上挑取pGEX-4T-1-diptericin-BL21的单克隆菌落,接种于3 mL含有Amp的LB培养基中,37600=0.6-0.8,加入终浓度为1 mmol/L的IPTG诱导4 h。离心收集菌体,在冰上进行超声破碎,条件:300 W,超声4 s,间隔4 s,10 min。破碎之后离心收集上清液。将上清液与等体积的2×SDS上样缓冲液混合,沸水浴3-5 min,取8 μL进行SDS-PAGE电泳检测,以转化有空质粒pGEX-4T-1的大肠杆菌BL21为对照。SDS-PAGE蛋白电泳参照《分子克隆实验指南》第5章,蛋白质用考马斯亮蓝R-250染色,使用的分离胶浓度为12%。
1.2.5 Western-blot检测目的蛋白中引入了HA标签,用此标签进行Western-blot检测目的蛋白,一抗:小鼠源 Anti-HA antibody,二抗:荧光素标记羊抗鼠IgG。经过SDS-PAGE电泳后,去除浓缩胶,按照分离胶尺寸剪好滤纸和硝酸纤维素膜(NC膜),并将其与电转移装置配套的海绵垫置于转移缓冲液平衡10 min。安装好电转移装置后,冰浴条件下3 W转移110 min。将NC膜用封闭液封闭2 h,一抗在室温下孵育1-2 h,二抗室温孵育1 h,用Odessey荧光WB检测系统扫描图片。
1.2.6 diptericin-GST融合蛋白的纯化将重组pGEX-4T-1-diptericin-BL21大肠杆菌诱导表达后,离心取菌体沉淀进行超声破碎,取上清液用0.45 μm的过滤器进行过滤。按照GSTrap HP 1 mL纯化柱操作方法进行纯化,并进行SDS-PAGE电泳检测。
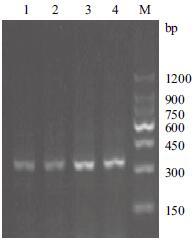
2 结果 2.1 家蝇幼虫总RNA的提取与RT-PCR扩增dipter-icin基因本实验用RNAiso Plus试剂提取家蝇幼虫总RNA,经电泳检测条带清晰完整性好,OD260/OD280在1.8-2.0之间纯度好,为后续实验顺利进行奠定了基础。RT-PCR扩增diptericin基因,结果(图 1)显示,扩增产物大小在350 bp左右,与预计的结果相符。
|
| 图 1 RT-PCR 扩增diptericin 基因 M :DNA Marker ;1-4 :diptericin 基因 |
提取阳性克隆质粒,进行EcoRⅠ和XhoⅠ双酶切,出现了大小约为4.9 kb和350 bp的两条带,表明重组质粒pGEX-4T-1-diptericin构建成功(图 2)。将通过鉴定的质粒送至上海生物技术服务有限公司测序,分析测序结果,选取插入方向正确,具有正确的阅读框,无碱基突变的重组菌。测序结果显示,含有酶切位点及HA标签序列的diptericin基因长为345 bp,diptericin基因与GenBank中已公布diptericin序列的同源性最高达到99.9%,对其编码蛋白进行分析,diptericin基因编码99个氨基酸,分子量约为10.796 kD。

|
| 图 2 重组质粒pGEX-4T-1-diptericin 双酶切鉴定 M :DNA Marker ;1,2 :重组质粒pGEX-4T-1-diptericin 双酶切 |
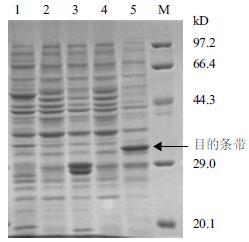
挑选重组pGEX-4T-1-diptericin-BL21的单菌落进行诱导表达,细胞破碎后提取上清,经过SDS-PAGE电泳,同时将大肠杆菌BL21和含有空质粒的大肠杆菌pGEX-4T-1-BL21作为对照,结果(图 3)显示,目的蛋白为带有GST标签的diptericin蛋白,约为37 kD,与理论大小相符,而对照组此位置均无条带,pGEX-4T-1-BL21经诱导后在大小约为26 kD处有明显条带,应为GST标签蛋白条带。
|
| 图 3 重组diptericin 基因表达产物SDS-PAGE 电泳 M :蛋白分子质量标准;1 :大肠杆菌BL21 ;2 :大肠杆菌pGEX-4T-1-BL21 ;3 :大肠杆菌pGEX-4T-1-BL21 诱导上清;4 :pGEX-4T-1-diptericin-BL21 未诱导上清;5 :pGEX-4T-1-BL21 诱导表达破碎上清 |
通过HA抗体进行Western-blot检测,结果(图 4)显示,pGEX-4T-1-diptericin-BL21诱导后有单一条带的目的蛋白,而对照组pGEX-4T-1-BL21无条带,表明diptericin基因成功在大肠杆菌BL21中得到了表达。

|
| 图 4 重组diptericin 蛋白Western-blot 检测 M :蛋白分子质量标准;1 :大肠杆菌pGEX-4T-1-BL21 ;2 :pGEX-4T-1-diptericin-BL21 |
收集pGEX-4T-1-diptericin-BL21诱导表达后的菌体超声破碎上清,通过GSTrap HP 1 mL纯化柱纯化目的蛋白,将洗脱缓冲液洗脱后的样品进行SDS-PAGE电泳检测,结果(图 5)显示,通过GST纯化柱纯化到了目的蛋白,显示为单一条带,大小约为37 kD。

|
| 图 5 重组diptericin 蛋白的纯化 M :蛋白分子质量标准;1,2 :diptericin-GST 融合蛋白纯化 |
已有许多学者对构建基因工程菌来生产抗菌肽进行了研究,包括原核表达和真核表达,如Liang等[4]利用将家蝇Cecropin基因克隆到pGEX-4T-1载体上,实现了其在大肠杆菌中的融合表达,切除GST标签后的Cecropin蛋白对大肠杆菌具有一定的抑菌效果,李小波等[5]将家蝇抗菌肽attacin克隆至酵母表达载体pPIC9K中,实现其在毕赤酵母GS115中的表达。双翅肽(diptericin)最早由Dimarcq等[6]从经细菌诱导的新陆原伏蝇Phormia terranovae幼虫的血淋巴中分离得到,并证实其参与昆虫的体液免疫防御且发挥着十分重要作用。然而,对于家蝇diptericin基因的研究并不多。
抗菌肽对蛋白酶非常敏感,而且表达抗菌肽对宿主菌可能具有毒性或者表达的抗菌肽无活性[7],以融合蛋白的形式表达抗菌肽目的基因,可以减少抗菌肽本身对宿主菌的毒害作用,同时还能保护抗菌肽蛋白避免蛋白酶的降解[8]。pGEX-4T-1是目前较多使用的表达载体,它利用谷胱甘肽S-转移酶基因和目的基因连接,能够在大肠杆菌中产生GST融合蛋白,并且可以用凝血酶进行切割GST蛋白而获得目的基因产物。徐建华等[9]将家蝇Attacin基因分别克隆至原核表达载体pET30a(+)和pGEX-4T-1,转化大肠埃希菌,从pET30a(+)/Attacin重组质粒的表达宿主菌中未能获得His-Attacin融合蛋白,而从pGEX-4T-1/Attacin重组质粒转化菌种获得了GST-Attacin融合蛋白。舒梅等[10]将水生动物抗菌肽Y18和CEC1分别克隆到pGEX-4T-1载体上,构建了pGEX-Y18和pGEX-CEC1两个融合蛋白表达载体,获得了抗菌肽Y18和CEC1,并发现融合蛋白GST-Y18和GST-CEC1、抗菌肽Y18和CEC1都能有效地抑制E.coli DH5α、S. aureus、B. subtilis和S. cerevisiae的生长。
本研究将家蝇diptericin基因克隆至pGEX-4T-1载体中,对重组大肠杆菌进行IPTG诱导,SDS-PAGE蛋白电泳检测到大小约为37 kD的目的蛋白,Western-blot也检测到单一蛋白条带,说明diptericin基因在大肠杆菌中进行了融合表达。经过纯化,得到了含有GST标签的diptericin融合蛋白,以融合蛋白形式表达的diptericin蛋白对宿主菌没有明显的抑制生长作用,后续实验将通过切除GST标签来检测diptericin蛋白的生物活性,并通过研究不同诱导时间、温度等条件来改善目的基因的表达,以期筛选到可以高效表达diptericin蛋白的重组基因工程菌。
抗菌肽有不同的种类,通过将不同的抗菌肽串联进行表达有望得到活性更高的杂合抗菌肽,如陈玉海等[11]将非洲爪蟾皮肤分泌的两种抗菌肽magaininⅡ和PGLa在毕赤酵母中进行杂合表达,构建了杂合抗菌肽magaininⅡ-PGLa的分泌型毕赤酵母表达载体,实现了杂合抗菌肽在毕赤酵母中的分泌表达。因此,今后可将不同的家蝇抗菌肽基因进行串联表达,获得抗菌谱更广、活性更高的基因工程抗菌肽蛋白。
4 结论本研究成功构建了家蝇diptericin基因原核表达载体pGEX-4T-1-diptericin-BL21,在大肠杆菌BL21中获得了该蛋白的可溶性表达,经过GST标签纯化柱纯化得到了diptericin蛋白。
| [1] | Hoffmann JA, Kafatos FC, Janeway CA Jr, et al. Phylogenetic perspectives in innate immunity[J]. Science, 1999, 284(5418): 1313–1318. |
| [2] | Bulet P, Stcklin R, Menin L. Anti-microbial peptides :from invertebrates to vertebrates[J]. Immunol Rev, 2004, 198(1): 169–184. |
| [3] | 萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 第3 版. 黄培堂, 译. 北京:科学出版社, 2008. |
| [4] | Liang Y, Wang J, Zhao X, et al. Molecular cloning and characterization of cecropin from the housefly(Musca domestica)and its expression in E[J]. Dev Comp Immunol, 2006, 30(3): 249–257. |
| [5] | 李小波, 王婷婷, 马艳, 等. 家蝇抗菌肽Attacin 在毕赤酵母中 的异源表达[J]. 中国寄生虫学与寄生虫病杂志, 2010, 28(5): 332–336. |
| [6] | Dimarcq JL, Keppi E, Dunbar B, et al. Purification and characterization of a family of novel inducible antibacterial proteins from immunized larvae of the dipteran Phormia terranovae and complete amino-acid sequence of the predominant member, diptericin A[J]. Eur J Biochem, 1988, 171(1-2): 17–22. |
| [7] | 杨小蓉, 金小宝, 丁彩屏, 等. 家蝇幼虫抗菌肽diptericin-2 基因 的克隆及原核表达- 鉴定[J]. 现代预防医学, 2012, 39(11): 2791–2793. |
| [8] | Chen H, Xu Z, Xu N, et al. Efficient production of a soluble fusion protein containing human beta-defensin-2 in E[J]. J Biotechnol, 2005, 115(3): 307–315. |
| [9] | 徐建华, 朱家勇, 金小宝, 等. 家蝇幼虫抗菌肽Attacin 基因的 克隆表达及抑菌生物学活性[J]. 医学分子生物学杂志, 2007, 4(1): 20–26. |
| [10] | 舒梅, 许杨, 徐熙, 等. 两种水生动物抗菌肽的原核表达及活 性分析[J]. 中国生物工程杂志, 2011, 31(2): 56–61. |
| [11] | 陈玉海, 陈庆煌, 陈科, 等. 抗菌肽magainin Ⅱ的密码子优 化及在大肠杆菌和毕赤酵母中的表达[J]. 生物工程学报, 2014, 30(4): 615–624. |




