2. 贵州博康生物工程有限公司,贵阳 550004
2. Guizhou Bokang Bioengineering Co.,Ltd, Guiyang 550004
管家基因又称持家基因,是所有细胞中均表达的一类基因,其产物是对维持细胞基本生命活动所必需的[1, 2]。该基因一直处于活性转录状态,表达水平受环境因素影响较小,而且是在个体各个生长阶段的大多数,或几乎全部组织中持续表达,它的表达只受启动序列或启动子与RNA聚合酶相互作用的影响,而不受其他机制调节。管家基因被认为在转录和翻译水平方面保持恒定,其通常作为内参基因校正上样量及上样过程中存在的实验误差,保证实验结果的准确性[3]。随着对昆虫功能基因研究的不断深入,为了获得真实可靠的实验数据,实验通常采用内参基因进行数据校正和均一化[4],从而对内参基因的研究显得极为重要,目前通常以微管蛋白基因(α-tubulin、TUA、β-tubulin、TUB)[5]、核糖体蛋白(如RPSs、RPLs)[6]、肌动蛋白(如β-actin)[7]、甘油醛-3-磷酸脱氢酶基因(glyceraldeh-yde-3-phosphate dehydrogenase,GAPDH)[8]、转录延伸因子基因(Transcription elongation factors,EF-1α)、多聚泛素酶基因(ubiquitin,UBQ)、18S核糖体RNA(18S ribosomal RNA,18S rRNA)[9]等管家基因作为内参基因评估昆虫基因的表达[10]。
目前在真核细胞中发现的核糖体蛋白(Ribosomal protein,RP)有80多种,广泛分布于各种组织中,核糖体蛋白的命名与蛋白在核糖体的大小亚基有关。小亚基核糖体蛋白命名为S1-S31,大亚基核糖体蛋白命名为L1-L44[11]。越来越多的证据表明,多种 RP除组成核糖体、参与蛋白质生物合成之外,还具有其他的功能[12],如在哺乳动物和果蝇中,RPS3有核酸内切酶的作用,RPS2基因突变引起卵子发育停滞,RPS10参与转录过程中的抗终止作用,RPS12参与RNA的加工过程[13]。核糖体蛋白S18是真核生物核糖体40S亚基的组成蛋白之一,是一种高度保守的蛋白质,属于核蛋白S13超家族成员,由于稳定表达于不同类型的细胞和组织(如正常细胞和癌细胞)中,而且其表达量近似,并无显著性差别,近年来已有实验将其作为内参基因进行研究[14]。
家蝇(Musca domestica)呈世界性分布,是重要的媒介昆虫,对环境适应能力强,有强大的先天性免疫系统及生长代谢调节功能[15-17]。近年来,对于家蝇功能基因的系统研究已成为研究热点,从核酸和蛋白水平评估基因的时空表达变化是研究功能基因的基础。在家蝇中,仅在转录水平上对内参基因进行优化选择研究[18],但对于蛋白翻译水平,到目前仍未见相关研究报道。本研究通过对家蝇核糖体蛋白S18(RPS18)基因完整开放阅读框序列进行基因克隆及原核表达,并通过RT-PCR、qPCR及采用Western-blot从转录、翻译水平上分析其在家蝇不同发育时期和不同组织中的表达情况,评估RPS18基因作为家蝇内参基因的可靠性,旨在为今后进行家蝇功能基因的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 动物材料与菌种家蝇由贵州医科大学病原生物学教研室常规饲养;清洁级新西兰大白兔,由贵州医科大学实验动物中心提供;宿主菌感受态细胞Trans1-T1和Transetta(DE3)购自北京全式金生物技术有限公司;载体pMD18-T和pET28a(N端6×His蛋白纯化标签)购自TaKaRa公司。
1.1.2 主要试剂和仪器限制性内切酶、T4 连接酶、 rTaq酶、MiniBEST小量质粒抽提纯化试剂盒,DNA Marker DL2000、羊抗兔IgG/HRP、抗His标签抗体、protein marker、总RNA提取试剂TRIzol Reagent、PrimeScriptTM One Step RT-PCR Kit、DNA凝胶回收试剂盒均购自TaKaRa公司;考马斯亮蓝R-250、EZ-buffers H10*TBST buffer购自上海生工生物工程有限公司;卡那霉素;RPS18抗体由实验室自制;所用引物由上海生工生物工程公司合成。JY92-ⅡN超声波细胞粉碎机(宁波新芝生物科技股份有限公司),PCR扩增仪(德国Eppendorf公司),冷冻高速离心机(德国Eppendorf公司),凝胶成像系统IQuant400(美国Amersham Pharmacia公司)。
1.2 方法 1.2.1 家蝇幼虫总RNA的提取及cDNA合成总RNA的提取按照TaKaRa公司TRIzol说明书进行操作。分别对家蝇不同发育时期(卵、一龄幼虫、二龄幼虫、三龄幼虫、蛹、雌蝇、雄蝇)和三龄幼虫不同组织(体壁、马氏管、脂肪体、肠道、唾液腺)提取总RNA,总RNA经电泳检测,GeneQuant公司核酸定量分析仪测定A260/280比值及浓度,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书分别合成cDNA第一链,三龄幼虫作为基因克隆的模板。
1.2.2 引物设计根据NCBI公布的家蝇基因组RPS18基因预测序列,筛选到编码该基因的ORF序列,运用Primer 5.0软件设计基因克隆引物(F1、R1),成熟肽原核表达引物(F2、R2)。以上引物由生工生物工程(上海)股份有限公司合成,其序列如下:F1:5'-ATGTCGCTCGTTATCCCAGAAAAG-3',R1:5'-TTACTTCTTCTTGGATACACCGACA-3';F2:5'-CGCGGATCCATGTCGCTCGTTAT-3',R2:5'-CCCAAGCTTTTACTTCTTCTTGGAT-3'。
1.2.3 pMD18-T/RPS18克隆载体的构建以上述家蝇幼虫cDNA为模板,应用基因克隆引物进行 PCR扩增,扩增条件:94℃预变性 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃延伸10 min。取PCR产物检测:2%的琼脂糖凝胶电泳。用DNA凝胶回收试剂盒,纯化PCR产物。将PCR产物连接到pMD18-T载体上,转化Trans1-T1感受态细胞,涂布于Amp+抗性的LB固体培养基平板培养,次日挑单克隆进行PCR鉴定,扩大培养后提取质粒,送生物公司测序。
1.2.4 生物信息学分析利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System,ExPASy,http://ca.expasy.org/)提供的生物信息学工具分析家蝇RPS18基因的特点;运用NCBI Blast对基因序列进行同源比对,用ProtParam分析蛋白等电点、分子质量;ProtScale分析蛋白质的疏水性;SignaIP4.1分析信号肽位点;免疫表位数据库分析资源IEDB Analysis Recource网站(http://tools.immuneepitope.org/tools/bcell/iedb_input)分析抗原表位。
1.2.5 pET28a/RPS18表达载体的构建以pMD18-T/RPS18质粒为模板,应用表达引物(F2、R2)扩增RPS18序列,PCR反应条件为:94℃预变性 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃延伸10 min。取PCR产物检测:2%的琼脂糖凝胶电泳。PCR产物用胶回收试剂盒回收纯化,将纯化的PCR产物与原核表达载体pET28a重组,连接产物转化Transetta(DE3)感受态细胞,涂布于含Kan+抗性的LB平板上,37℃培养过夜,随机挑取10个阳性克隆,扩大培养后,用质粒提取试剂盒抽提质粒,测序并鉴定。
1.2.6 家蝇RPS18重组蛋白的诱导表达和纯化及Western-blot鉴定将重组质粒pET28a/RPS18转入Transetta(DE3)。挑取阳性克隆接种于5 mL LB培养液中37600检测值是0.6时,加入IPTG至终浓度为0.25 mmol/L,34℃,继续培养18 h。用12% SDS-PAGE检测重组蛋白表达情况。诱导菌液离心10 000 r/min,10 min收集菌体,裂解缓冲液重悬菌体,超声裂解悬浮液(160 W,超声2 s,间歇5 s,循环数90)。悬浮液4℃、13 000 r/min离心30 min,收集上清和沉淀,根据Ni-IDA Agarose蛋白纯化说明书操作进行纯化,12% SDS-PAGE判断重组蛋白的可溶性。用兔来源的抗6×His 单克隆抗体(1∶2 000)为一抗,羊抗兔IgG-HRP(1∶2 000)为二抗,进行Western blotting鉴定纯化的家蝇RPS18融合蛋白。
1.2.7 多克隆抗体的制备及抗血清特异性分析将纯化好的重组蛋白作为抗原免疫新西兰大白兔,600 μg分为4次注射,蛋白质与等体积的完全弗氏佐剂充分混匀,皮下多点注射新西兰大白兔,初次注射量为300 μg。加强免疫每次间隔10 d,蛋白质与等体积的不完全弗氏佐剂充分混匀,皮下多点注射新西兰大白兔,注射量为100 μg,4次免疫后间隔7 d再进行采血,并分离血清。500 μL/管分装,-80℃保存。同时以注射PBS的新西兰大白兔作为阴性对照。
以新西兰大白兔抗家蝇RPS18重组蛋白血清和初次免疫前新西兰大白兔阴性血清为一抗(1∶20),以羊抗兔IgG-HRP为二抗(1∶2 000),进行West-ern blotting分析家蝇RPS18重组蛋白的免疫原性。
1.2.8 RPS18基因转录水平研究通过RT-PCR方法,以家蝇不同发育时期(卵、一龄幼虫、二龄幼虫、三龄幼虫、蛹、雌蝇、雄蝇)和三龄幼虫不同组织(体壁、马氏管、脂肪体、肠道、唾液腺)cDNA为模板,用F1、R1为引物扩增RPS18序列,PCR反应条件为:94℃预变性5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃延伸10 min。取PCR产物检测:2%的琼脂糖凝胶电泳检测家蝇不同发育时期和不同组织RPS18基因的表达。
RPS18的qPCR,按照TaKaRa SYBR Premix Ex TaqTM Ⅱ(Perfect Real Time)试剂盒说明,使用ABI PRISM 7500(ABI,USA)进行Real-time PCR,每个反应3个重复。反应体系总体积为20 μL,其中SYBR Premix Ex Taq Ⅱ(2×)10 μL、上下游引物(10 μmol/L)各0.8 μL、ROX Reference Dye Ⅱ(50×)0.4 μL、cDNA 2.0 μL;灭菌蒸馏水补足体积。反应程序为:95℃预变性30 s;95℃ 5 s,60℃ 34 s,40个循环。反应结束后,确认qPCR的熔解曲线鉴定产物的特异性。
1.2.9 RPS18基因翻译水平研究提取不同发育时期(卵、一龄幼虫、二龄幼虫、三龄幼虫、蛹、雌蝇、雄蝇)家蝇及家蝇三龄幼虫不同组织(体壁、马氏管、脂肪体、肠道、唾液腺)总蛋白,用Western-blot检测RPS18的表达情况。
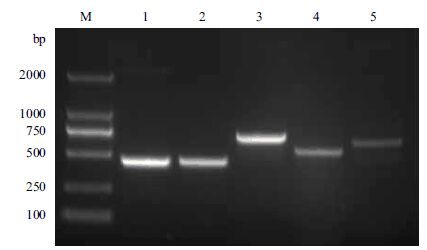
2 结果 2.1 家蝇pMD18-T/RPS18克隆载体构建选用克隆引物进行PCR 鉴定重组质粒,结果(图 1第1泳道)显示,提取重组质粒进行测序鉴定,确定插入片段连接方向正确。
|
| 图 1 pMD18-T/RPS18 及pET28a/RPS18 重组质粒 PCR鉴定 M:DL2000 DNA Marker ;1:克隆重组质粒PCR ;2:表达重组质粒 PCR ;3:T7F 和T7R ;4:RPS18F 和T7R ;5:T7F 和RPS18R |
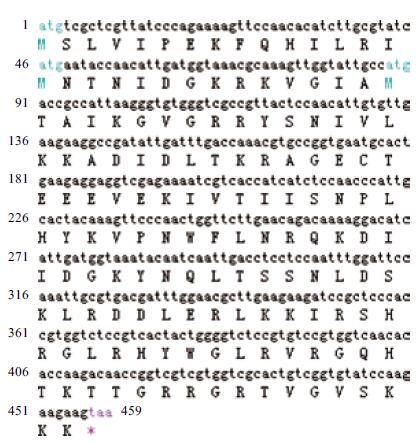
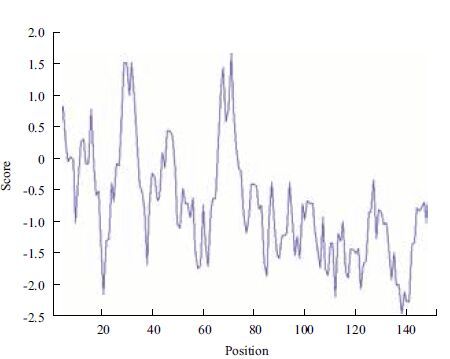
家蝇RPS18蛋白基因全长为459 bp,编码152个氨基酸(图 2)。 序列已上传 NCBI GenBank,登录号:KT006855。ExPASy中 ProtParam预测RPS18的理论分子量17 590.5 Da,其等电点为10.48。280 nm处的摩尔消光系数为 16 960 M-1cm-1,0.1%浓度的ABS为0.964。若其成熟肽N-末端为蛋氨酸时,在哺乳动物网织红细胞体外表达的半衰期为30 h,在酵母和大肠杆菌中表达的半衰期分别<20 h和<10 h。在溶液中RPS18 的不稳定指数为47.41,其性质不稳定,RPS18的疏水指数为90.99,疏水性较高(图 3)。
|
| 图 2 RPS18 基因开放阅读框cDNA 序列及对应编码的氨基酸序列 |
|
| 图 3 ProtScaler 软件RPS18 的疏水性分析 |
选用组合引物:表达目的基因上游+下游组合;质粒 T7启动子+质粒T7终止子;目的基因上游+质粒T7终止子;质粒T7启动子+目的基因下游进行PCR鉴定重组质粒。结果(图 1第2、3、4、5泳道)显示,提取重组质粒进行测序鉴定,显示表达载体构建成功。
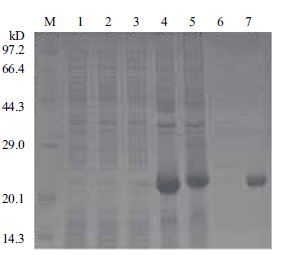
2.4 家蝇pET28a/RPS18重组蛋白表达、纯化鉴定及抗体制备 2.4.1 家蝇pET28a/RPS18重组蛋白表达及纯化将鉴定为阳性的重组表达质粒导入到表达菌株Transetta(DE3)中,经终浓度为0.25 mmol/L的IPTG诱导18 h获得重组蛋白。SDS-PAGE电泳分析结果(图 4)显示,在约21 kD处有外源蛋白表达条带出现(pET28a载体His标签及部分载体蛋白大小约为3.2 kD),与预期分子量一致。将蛋白进行纯化,结果(图 3第7泳道)证明目的蛋白纯化成功。
|
| 图 4 12% SDS-PAGE 分析pET28a/RPS18 在大肠杆菌Transetta(DE3)中表达纯化效果 M:蛋白Marker ;1:pET28a 未经IPTG 诱导;2:pET28a 经IPTG 诱导;3:pET28a/RPS18 未经IPTG 诱导;4:pET28a/RPS18 经 IPTG 诱导;5:pET28a/RPS18 经IPTG 诱导后的沉淀;6:pET28a/RPS18 经IPTG 诱导后的的上清;7:pET28a/RPS18 经IPTG 诱导表达后纯化蛋白 |
用兔来源的抗6×His单克隆抗体作为Western-blot中的一抗,其能够识别家蝇RPS18纯化蛋白,出现特异性目的条带,结果进一步证实RPS18基因原核重组表达成功,重组蛋白带有His纯化标签(图 5第1、2、5、6、9、10泳道)。

|
| 图 5 His 单克隆抗体鉴定纯化的RPS18 重组蛋白的表达 M:蛋白Marker ;1,2,5,6,9,10:目的蛋白;3,4,7,8,11,12: 阴性对照 |
将纯化的RPS18重组蛋白分别与重组蛋白免疫的新西兰大白兔的抗血清相互作用,在约21 kD(图 6第1、2、5、6、9、10泳道)可见一明显的免疫反应条带,其大小与预测RPS18重组蛋白分子量相近,阴性对照血清(图 6第3、4、7、8、11、12泳道)在相应的位置未识别出条带,说明制备的多克隆抗体能与RPS18蛋白产生特异的免疫印迹反应。

|
| 图 6 RPS18 重组蛋白的抗血清特异性分析 M:蛋白Marker ;1,2,5,6,9,10:目的蛋白;3,4,7,8,11,12: 阴性对照 |
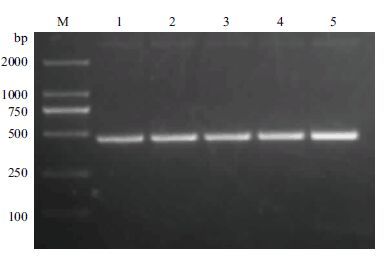
以家蝇不同发育时期和三龄幼虫不同组织cDNA为模板,进行RT-PCR扩增,均能扩增出特异性条带(图 7,图 8),说明RPS18基因在家蝇不同发育时期及不同组织间呈一致性表达,且表达量较为稳定。
|
| 图 7 家蝇不同组织RPS18 基因的扩增结果 M:DNA Marker ;1:体壁;2:唾液腺;3:肠道;4:脂肪体;5:马氏管 |

|
| 图 8 家蝇不同发育时期RPS18 基因的扩增结果 M:DNA Marker ;1:卵;2:一龄幼虫;3:二龄幼虫;4:三龄幼虫;5:蛹;6:雌蝇;7:雄蝇 |
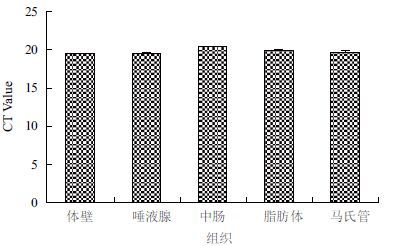
通过软件GraphPad Prism 5,采用CT值法对RPS18基因在家蝇生活史中各龄期及不同组织中的表达进行统计学分析并以CT Value为纵坐标、各龄期或三龄幼虫不同组织为横坐标作图。结果表明,RPS18基因的qPCR分析,CT值线性范围为19-21之间(图 9,图 10)。

|
| 图 9 RPS18 基因在家蝇生活史不同发育时期的表达 |
|
| 图 10 RPS18 基因在家蝇三龄幼虫不同组织的表达 |
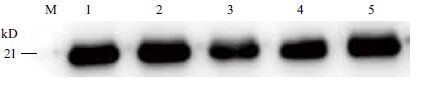
将提取的家蝇不同发育时期及三龄幼虫不同组织总蛋白进行Western-blot分析,结果(图 11,图 12)显示,约在21 kD处均显示有目的蛋白。
|
| 图 11 家蝇不同组织RPS18 蛋白的表达 M:蛋白Marker ;1:体壁;2:唾液腺;3:脂肪体;4:马氏管;5:肠道 |

|
| 图 12 家蝇不同发育时期RPS18 蛋白的表达 M:蛋白Marker ;1:卵;2:一龄幼虫;3:二龄幼虫;4:三龄幼虫;5:蛹;6:雌蝇;7:雄蝇 |
选择理想的内参基因对获得准确的基因表达结果是至关重要的,选择适当的内参基因以减少检测标本间的差异是必须的[19],因此内参基因的表达水平应相对稳定且受环境影响较小。家蝇孳生于杂乱菌丛的环境中传播疾病,是重要的媒介昆虫,其免疫防御、免疫协助得到很多研究者的关注,而目前为止没有一个内参基因能够作为家蝇功能基因研究的参照和参考依据,但对于其他昆虫(如娥[20]发现β-tubulin和β-actin基因在金纹细蛾不同发育阶段虫态间表达最稳定;β-actin和18S基因在金纹细蛾成虫不同组织间表达最稳定;蚊[21]rspL40、BTF3在不同组织中表达最稳定,rspL40、rsp5在吸血不同时相表达最稳定)已有关于稳定内参基因的相关报道,此外对于家蝇内参基因的研究仅限于转录水平[18-22],且在不同组织及发育时期能够稳定表达,与本研究结果一致,对于翻译水平,到目前仍未见相关研究报道。本研究从家蝇幼虫cDNA 文库中筛选到核糖体蛋白S18基因序列,全长459 bp,编码152个氨基酸,理论分子量为17 590.5 Da,等电点为10.48。成功克隆了RPS18基因,并插入pET28a表达载体,选用pET系统是因为该载体具有很强的表达重组蛋白的能力,而本实验选用的pET28a载体本身包含His序列,使载体表达的重组蛋白含有His融合标签,获得高纯度和高浓度的重组蛋白,并成功制备血清抗体,His单抗鉴定及抗血清特异性分析其均可见单一条带。本研究从转录水平和翻译水平上对家蝇不同发育时期、三龄幼虫不同组织间RPS18基因的表达稳定性进行了研究,结果显示RPS18基因在家蝇不同发育时期及幼虫不同组织间均能够稳定表达。综合分析显示,该基因在家蝇不同发育时期及幼虫不同组织均保持了较好的表达稳定性,同时在一定程度上证明此次家蝇内参基因筛选结果的准确性和可靠性,但对于不同胁迫条件(冷、热刺激、微生物感染等)下该基因的稳定性有待进一步研究。本研究将为今后家蝇基因表达的研究提供依据和参照,为进一步对家蝇功能基因的研究奠定基础。
4 结论本研究成功构建pET28a/RPS18重组原核表达载体并表达出RPS18蛋白,获得纯化蛋白及其抗体。在转录和翻译水平上证明,RPS18基因在家蝇不同发育时期及幼虫不同组织间均保持了较好的表达稳定性,同时证实此次家蝇内参基因的筛选结果是准确可靠的。
| [1] | Chang E, Shi S, Liu J, et al. Selection of reference genes for quantitative gene expression studies in Platycladus orientalis (Cupressaceae)using Real-time PCR[J]. PLoS One, 2012, 7(3): e33278.. |
| [2] | Juhas M, Stark M, von Mering C, et al. High confidence prediction of essential genes in Burkholderia cenocepacia[J]. PLoS One, 2012, 7(6): e40064. |
| [3] | Teng X, Zhang Z, He G, et al. Validation of reference genes for quantitative expression analysis by real-time RT-PCR in four lepidopteran insects[J]. Journal of Insect Science, 2012, 12: 60. |
| [4] | 魏永赞, 赖彪, 胡福初, 等. 用于荔枝qPCR 分析的内参基因克 隆及稳定性分析[J]. 华南农业大学学报, 2012, 33(3): 301–306. |
| [5] | Li B, Chen C, Xu Y, et al. Validation of housekeeping genes as internal controls for studying the gene expression in Pyropia haitanensis(Bangiales, Rhodophyta)by quantitative real-time PCR[J]. Acta Oceanologica Sinica, 2014, 33(9): 152–159. |
| [6] | 张晋华, 崔峥嵋. 核糖体蛋白S5(RPS5)基因研究进展[J]. 前沿科研, 2007, (213): 19–21. |
| [7] | 徐真, 马洪雨, 马春艳, 等. 拟穴青蟹β- 肌动蛋白基因的克隆、 组织表达及作为内参的可靠性分析[J]. 生物技术通报, 2013, (8): 105–112. |
| [8] | 卢秉国, 何炜毅, 申艳红, 等. 龙眼子叶胚3- 磷酸甘油醛脱氢 酶基因的cDNA 克隆及序列分析[J]. 福建农林大学学报:自 然科学版, 2009, 38(5): 506–511. |
| [9] | 付媛媛, 穆春生, 高洪文, 等. 紫花苜蓿18S rRNA 基因的克隆 及内参基因表达稳定性评价[J]. 植物生理学报, 2014, 50(12): 1809–1815. |
| [10] | Wu K, Liu W, Mar T, et al. Sequencing and validation of reference genes to analyze endogenous gene expression and quantify yellow dwarf viruses using RT-qPCR in viruliferous Rhopalosiphum padi[J]. PLoS One, 2014, 9(5): e97038.. |
| [11] | 伍文星, 张俊平. 核糖体蛋白S5 的医学研究进展[J]. 解放 军医学杂志, 2011, 36(4): 418–420. |
| [12] | 叶嘉良, 陈健, 吕正兵, 等. 家蚕泛肽- 核糖体蛋白S27a 的表 达及功能研究[J]. 蚕业科学, 2007, 33(3): 394–402. |
| [13] | 王辉, 刘伟利. 核糖体蛋白基因表达与肿瘤的关系[J]. 生理 科学进展, 2007, 38(4): 376–379. |
| [14] | Svingen T, Letting H, Hadrup N, et al. Selection of reference genes for quantitative RT-PCR(RT-qPCR)analysis of rat tissues under physiological and toxicological conditions[J]. Peer J, 2015, 3: e855.. |
| [15] | 修江帆, 魏川川, 尚小丽, 等. 家蝇(Musca domestica)羧肽 酶基因克隆及原核表达[J]. 广东农业科学, 2014, (10): 152–154. |
| [16] | 彭传林, 王宇, 吴建伟, 等. 家蝇热休克蛋白HSP20 基因克隆、 表达和序列分析[J]. 中国公共卫生, 2015, 31(3): 330–333. |
| [17] | 王宇, 吴高吉, 罗曼, 等. 家蝇Thymosin(THY)基因的克隆 及原核表达[J]. 生物技术通报, 2015, 31(2): 143–147. |
| [18] | Lu Y, Yuan M, Gao X, et al. Identification and validation of reference genes for gene expression analysis using quantitative PCR in Spodoptera litura(Lepidoptera :Noctuidae)[J]. PLoS One, 2013, 8(7): e68059. |
| [19] | 陈凤花, 王琳, 胡丽华. 实时荧光定量RT-PCR 内参基因的选 择[J]. 临床检验杂志, 2005, 23(5): 393–395. |
| [20] | 郭长宁. 金纹细蛾内参基因克隆分析及稳定性评价[D]. 杨凌: 西北农林科技大学, 2014. |
| [21] | 吴家红, 程金芝, 孙宇, 等. 白纹伊蚊基因表达定量PCR 内参 基囚的选择[J]. 中国人兽共患病学报, 2011, 27(5): 432–435. |
| [22] | Zhong M, Wang X, Wen J, et al. Selection of reference genes for quantitative gene expression studies in the house fly(Musca domestica L[J]. Acta Biochimica et Biophysica Sinica, 2013, 45(12): 1069–1073. |




