制片技术是生物学工作者常用的一门实验技术,它是从事动植物生物技术、细胞生物学、结构植物学、植物生殖生物学、植物发育生物学等研究的必要技术基础,在生物科学领域占有重要地位。
石蜡切片法是组织学、发育生物学研究最常用的制片技术之一,广泛运用于临床病理诊断、教学和科研工作中。常规的石蜡切片制作过程是:取材→固定→脱水→透明→浸蜡→包埋→切片→染色→脱蜡→封片。传统使用的透明剂和脱蜡剂是二甲苯[1, 2],二甲苯是一种有芳香气味的刺激性、易挥发液体,有毒性,主要对中枢神经和植物神经有麻痹和黏膜刺激作用,是一种潜在的致癌物质。大量的动物实验研究表明,过多接触二甲苯会引起神经系统、肝脏、肺、皮肤等多个组织的毒性反应[3-7]。二甲苯的细胞学毒性主要体现在诱导线粒体解偶联和氧化应激反应[8]。接触和使用化学试剂的安全性可以从http://www.proscitech.com/网站上查询物质安全资料表(MSDS)得到。
由于二甲苯对人体危害大,广大科研工作者一直致力于寻找更加安全的二甲苯代替物。1978年,Maxwell曾提出可使用三氯乙烷作为透明剂,此后便有越来越多的技术人员使用该替代物[9],但由于三氯乙烷的蒸气仍然有毒,因此在实验过程中必须保持良好的通风状态[10]。此后,多种二甲苯替代物,例如:植物油[11]、葵酸丁酯[12]、异丙醇[13]、异丙醇-矿物油混合物[14]、丙二醇甲酯[15]、辛烷[16, 17]、硬脂酸[18]、松节油[19]、环保透明剂[20]、Y透明剂[21]、甲基环己烷[22]等被相继使用。
正庚烷是一种脂肪族烃化合物,无色易挥发液体,不溶于水,溶于醇,可混溶于乙醚、氯仿,熔点-90.5℃,沸点98.5℃,易燃,为汽油的组成成分之一,主要用作测定辛烷值的标准物[23]。此前,已有研究者将正庚烷作为二甲苯的替代物,用于动物组织切片的透明和脱蜡过程,并取得良好效果[24]。但正庚烷是否同样适用于植物组织切片,尚无人研究。本实验室多年来一直致力于被子植物受精与胚胎发生的研究,组织切片是本实验室研究的必要基础技术。本研究以拟南芥不同发育时期的花药切片为例,探究正庚烷替代二甲苯用于植物组织切片的可能性,拟为植物研究工作者提供借鉴。
1 材料与方法 1.1 材料 1.1.1 植物材料野生型拟南芥(COL)温室种植(22℃,16 h光照/8 h黑暗)长至开花期,取新鲜花序进行后续实验。
1.1.2 试剂FAA固定液(福尔马林5 mL,乙酸5 mL,50%乙醇90 mL),现配现用;无水乙醇,配成不同浓度备用;正庚烷(国药);石蜡(Sigma);多聚赖氨酸:粉末购自Sigma公司,称取20 mg多聚赖氨酸粉末溶于20 mL去离子水中,配成10×母液,-20℃保存;甲苯胺蓝染色液:粉末购自Sigma公司,称取1 g甲苯胺蓝粉末,溶于100 mL 70%乙醇中,4℃保存,使用时以双蒸水100倍稀释;加拿大树胶(Sigma)。
1.1.3 主要仪器石蜡切片机(AO),恒温加热仪(瑞华),磨刀机(Leica SP9000),光学显微镜(OL-YMPUS IX71)。
1.2 方法 1.2.1 处理载玻片用1%-2%盐酸乙醇(95%医用乙醇100 mL中加入浓盐酸1-2 mL)浸泡过夜→流水冲洗(放在塑料篮中)→取出后放入95%(医用)乙醇中备用。使用前擦干载玻片,均匀涂抹多聚赖氨酸水溶液,置于60℃烘箱烘1-2 h干燥。
1.2.2 固定取新鲜的拟南芥花序,放入20 mL小瓶中,加满FAA固定液,抽真空辅助固定20-30 min,更换固定液后,4℃冰箱放置过夜。
1.2.3 脱水50%乙醇→70%乙醇→85%乙醇→95%乙醇→100%乙醇→100%乙醇逐级脱水,材料在无水乙醇中脱水30 min,其他各级分别脱水1 h,最后一级脱水需更换2次无水乙醇。
1.2.4 透明1/2无水乙醇+1/2正庚烷→纯正庚烷→纯正庚烷逐级浸泡材料,每级放置1.5 h。
1.2.5 浸蜡提前融石蜡,弃上一级正庚烷,配置体积比为1∶1的正庚烷/纯石蜡混合液,于58℃恒温台浸泡材料过夜,之后使用纯石蜡替换上一级溶液,每隔12 h换一次纯石蜡溶液,共替换6次。
1.2.6 包埋将充分浸蜡的材料倒入已叠整齐的纸盒中,石蜡凝固前摆正材料方向,待石蜡凝固后放入4℃冰箱保存备用。
1.2.7 切片切片前磨刀→分割、修整蜡块呈梯形→固定蜡块→固定切片刀,调节刀的角度到15°→调节切片厚度使其为10 μm→调节刀口与蜡块的距离、蜡块的位置→切片。
1.2.8 展片、粘片将蜡带置于多聚赖氨酸处理过的载玻片上,加蒸馏水展平蜡带后于42℃展片台上烤干。
1.2.9 染色将玻片放入染缸,再将甲苯胺蓝染液加入染缸至淹没玻片,染色10 min,再用双蒸水清洗玻片,42℃烘箱中烘干。
1.2.10 脱蜡及封片正庚烷浸泡玻片2次,每次10 min,取出玻片滴加加拿大树胶,盖上盖玻片封片。
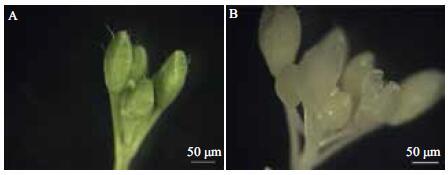
2 结果 2.1 正庚烷代替二甲苯作透明剂材料经固定及各级乙醇脱水后,再用正庚烷逐步透明。结果(图 1,图 2)显示,处理后的组织呈半透明状态,且能保持平整,无收缩、变形现象;浸蜡后切片,容易连续切片而且厚薄均匀,摊片时能在42℃水中自然展开,平整而无皱褶,说明以正庚烷作透明剂,不仅能与脱水剂充分混合,又能被石蜡完全取代,透明效果好,是一种合适的透明剂。
|
| 图 1 正庚烷透明拟南芥花序 A:新鲜花序;B:透明后花序 |
|
| 图 2 正庚烷透明拟南芥不同时期的花 A:新鲜的花;B:透明后的花;C:连续切片 |
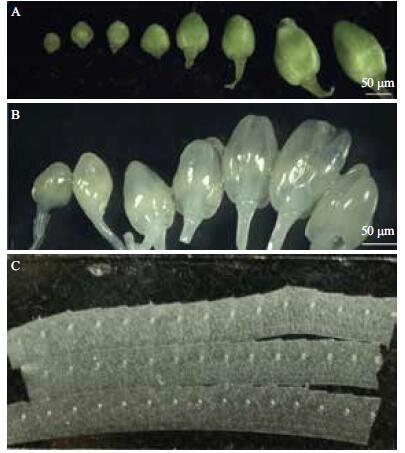
展片、烘片、染色以后,用正庚烷浸泡玻片2次,每次10 min。结果(图 3)显示,仅剩下植物组织仍保持在原位,用于支撑组织和细胞的石蜡已被完全溶解,组织、细胞更加透明清晰,便于观察;用正庚烷溶去组织内外的石蜡只需要20 min,脱蜡快而干净,表明正庚烷是一种合适的脱蜡剂。

|
| 图 3 正庚烷脱蜡效果 A:脱蜡前的切片;B:脱蜡后的切片 |
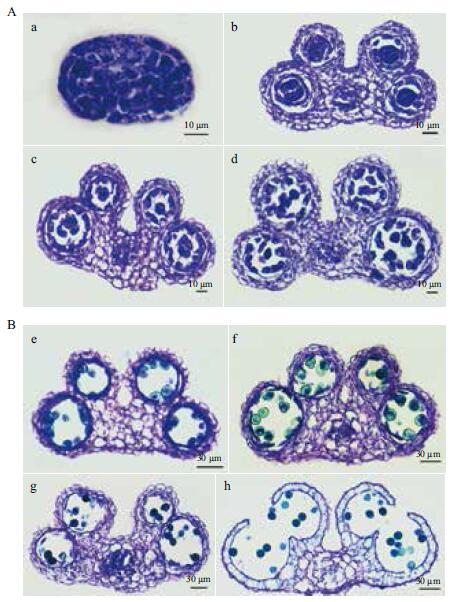
脱蜡后的组织经封藏剂封藏后,便可以长期保存,显微镜下观察切片,结果(图 4)显示,甲苯胺蓝染色颜色鲜亮,细胞着色好,核质分明,结构清晰,组织形态保持完好,能达到以二甲苯作透明剂的石蜡切片效果。
|
| 图 4 发育前期(A)及后期(B)的拟南芥花药 a:花药原基细胞开始分裂;b-d:四分体花粉的形成过程;e-g:成熟花粉的形成过程;h:花粉散出 |
在组织制片实验中,透明和脱蜡是两个十分重要的步骤,透明是脱水与浸蜡、脱水与封藏之间的桥梁,而切片后需要用脱蜡剂溶去组织和细胞内外的石蜡,才能使细胞、组织更加透明清晰,便于观察。传统使用的透明和脱蜡试剂是二甲苯,二甲苯是含苯环的芳香族化合物,毒性高,虽然已有各种二甲苯替代物被开发使用,但是却未普及:或因效果不稳定,或因价格较高[25],因此,新的、更加安全有效的二甲苯替代物亟待研发。
二甲苯具有慢性毒性,经常或反复侵入人体后会引起神经衰弱、植物神经紊乱或皮肤黏膜刺激等症状,具体如头痛、头晕、乏力、睡眠障碍、血压降低、轻度贫血、皮炎等表现[26]。对妊娠期妇女还会导致妊娠贫血、妊娠高血压综合征、自然流产等症状,对月经机能、生殖机能和子代发育有一定的影响和损害[27]。另有文献报道,苯类化合物在一定程度上会引发牙周组织疾病[28]。而正庚烷只是对直接接触的皮肤有轻度刺激性,并具有麻醉作用。国家标准职业性接触毒物危害程度分级,将二甲苯定为III级(中度危害),溶剂汽油(正庚烷为其组成成分之一)为IV级(轻度危害)[29]。
正庚烷是短链脂肪烃化合物,相比于芳香烃二甲苯,正庚烷与石蜡结构更为相似,溶解石蜡也更加迅速。常规二甲苯脱蜡时间为每次20 min,正庚烷脱蜡时间为每次10 min,脱蜡快而干净。以正庚烷为透明剂,透明效果好,处理后的材料呈半透明状,后续浸蜡充分,容易连续切片,不脱片,摊片时能在42℃水中自然展开,平整而无皱褶。本实验研究发现,经正庚烷处理后的组织染色效果好,甲苯胺蓝染色10 min即可,颜色鲜亮,核质分明,结构清晰,解决了植物油等二甲苯替代物染色不佳的问题。
在实验中,应用正庚烷需要注意的是:正庚烷易燃,其蒸气与空气可形成爆炸性混合物,应远离火种,密封、避光保存;有一定的挥发性,用完及时盖严。为了脱水彻底并使材料减少收缩,透明时可逐步从纯乙醇过渡到正庚烷,即1/2无水乙醇+1/2正庚烷→纯正庚烷→纯正庚烷(正庚烷应更换2次,以除尽乙醇)。
正庚烷作为一种新的、相对安全有效的二甲苯替代物,有望在植物组织切片中普及使用。拟南芥是植物研究的模式植物之一,花药是植物生殖生物学的重要研究对象。本研究成功地将正庚烷应用于拟南芥花药石蜡切片实验,下一步应选取更多种类的植物材料及更多样化的组织开展实验,以期将正庚烷普遍应用于植物制片技术,消除二甲苯对制片人员的危害,改善工作环境。
4 结论本研究对拟南芥不同时期的花药进行石蜡切片,通过使用正庚烷作为透明剂和脱蜡剂,消除了传统透明试剂二甲苯对实验人员的危害。用正庚烷处理材料,透明效果好,浸蜡充分,容易连续切片,脱蜡快速且干净,染色佳,组织结构保持完整。因此,正庚烷可以作为一种新的、相对安全有效的二甲苯代替物,应用于植物组织切片中。
| [1] | Matthews JB. Influence of clearing agent on immunehistochemical staining of paraffin-embedded tissue[J]. Clinical Pathology, 1981, 34(1): 103–105. |
| [2] | Pollard K, Lunny D, Holgate CS, et al. Fixation, processing, and immunochemical reagent effects on preservation of T-lymphocyte surface membrane antigens in paraffin-embedded tissue[J]. Histochemistry and Cytochemistry, 1987, 35(11): 1329–1338. |
| [3] | |
| [4] | Hass U, Lund SP, Simonsen K, et al. Effects of prenatal exposure to xylene on postnatal development and behavior in rats[J]. Neurotoxicol Teratol, 1995, 17(3): 341–349. |
| [5] | Kum C, Kiral F, Sekkin S, et al. Effects of xylene and formaldehyde inhalations on oxidative stress in adult and developing rats livers[J]. Experimental Animals, 2007, 56(1): 35–42. |
| [6] | Chatterjee A, Babu RJ, Ahaghotu E, et al. The effect of occlusive and unocclusive exposure to xylene and benzene on skin irritation and molecular responses in hairless rats[J]. Archives of Toxicology, 2005, 79(5): 294–301. |
| [7] | Sandikci M, Seyrek K, Aksit H, et al. Inhalation of formaldehyde and xylene induces apoptotic cell death in the lung tissue[J]. Toxicology and Industrial Health, 2009, 25(7): 455–461. |
| [8] | Revilla AS, Pestana CR, Pardo-Andreu GL, et al. Potential toxicity of toluene and xylene evoked by mitochondrial uncoupling[J]. Toxicology in Vitro, 2007, 21(5): 782–788. |
| [9] | Temel SG, Noyan S, Cavusoglu I, et al. A simple and rapid microwave-assisted hematoxylin and eosin staining method using 1, 1, 1 trichloroethane as a de-waxing and a clearing agent[J]. Biotechnic & Histochemistry, 2005, 80(3-4): 123–132. |
| [10] | Reid KJ, Young FJ. Are trichloroethane-based substitutes safer than xylene?[J]. Med Lab Sci, 1981, 38(2): 145–149. |
| [11] | Bruun Rasmussen B, Norring Hjort K, Mellerup I, et al. Vegetable oils instead of xylene in tissue processing[J]. Apmis, 1992, 100(9): 827–831. |
| [12] | Lyon H, Holm I, Prent P, et al. Non-hazardous organic solvents in the paraffi n-embedding technique :a rational approach[J]. Histochemistry and Cell Biology, 1995, 103(4): 263–269. |
| [13] | Viktorov IV, Proshin SS. Use of isopropyl alcohol in histological assays :dehydration of tissue, embedding into paraffin, and processing of paraffin sections[J]. Bulletin of Experimental Biology and Medicine, 2003, 136(1): 105–106. |
| [14] | Buesa RJ, Peshkov MV. Histology without xylene[J]. Annals of Diagnostic Pathology, 2009, 13(4): 246–256. |
| [15] | Chen CY, He T, Mao XL, et al. A novel xylene substitute for histotechnology and histochemistry[J]. Biotechnic & Histochemistry, 2010, 85(4): 231–240. |
| [16] | Fredricks DN, Relman DA. Paraffin removal from tissue sections for digestion and PCR analysis[J]. Biotechniques, 1999, 26(2): 198–200. |
| [17] | Xing M, Du Y, Wang X, et al. A simplified paraffin embedding method for small botanical samples[J]. Biotechnic & Histochemistry, 2010, 85(4): 241–246. |
| [18] | 魏永敬, 汪兆亮. 硬脂酸代替二甲苯透明在石蜡切片中的应 用[J]. 西南军医, 2007, 9(1): 57. |
| [19] | 李海鹤, 万明辉, 谭东海, 等. 松节油替代二甲苯在家禽组织 制片中的应用[J]. 中国家禽, 2013, 35(19): 51–52. |
| [20] | 兰淼, 李艳红, 巩俐, 等. 环保透明剂替代二甲苯在病理制 片技术中的应用[J]. 陕西医学杂志, 2012, 41(10): 1306–1307. |
| [21] | 孙帅, 赖洵. Y 透明剂替代二甲苯在病理制片中的应用[J]. 中国组织工程研究, 2012, 16(28): 5196–5199. |
| [22] | 王伟, 罗源. 一种针对人体皮肤组织快速、低毒的石蜡切片新 方法[J]. 吉林医学, 2013, 34(30): 6211–6212. |
| [23] | Windholz M. The merck index. An encyclopedia of chemicals, drugs, and biologicals[M]. 15th ed. Rahway :Royal Socirty of Chemistry, 2013. |
| [24] | Stockert JC, López-Arias B, Castillo P, et al. Replacing xylene with n -heptane for paraffin embedding[J]. Biotechnic & Histochemistry, 2012, 87(7): 464–467. |
| [25] | Piotrowska D, Długosz A, Pajak J. Antioxidative properties of coenzyme Q10 and vitamin E in exposure to xylene and gasoline and their mixture with methanol[J]. Acta Poloniae Pharmaceutica, 2002, 59(6): 427–432. |
| [26] | 李玲, 王文东, 栗学军, 等. 低浓度苯和甲苯及二甲苯对作业 人员健康及血清中超氧化物歧化酶的影响[J]. 工业卫生和 职业病, 2003, 29(4): 238. |
| [27] | 刘志敏, 王春华, 刘志勇, 等. 苯、甲苯和二甲苯作业女工对 月经及生殖结局的影响[J]. 天津医学院学报, 1994, 18(3): 3–5. |
| [28] | 程金霞, 杜程悦. 苯类化合物与牙周组织疾病关系的研究[J]. 职业与健康, 2001, 17(1): 8–9. |
| [29] | 中国预防医学科学院标准处. 劳动卫生国家标准汇编[G]. 北京:中国标准出版社, 1992. |




