2. 中国科学院昆明植物研究所,昆明 650201;
3. 中国科学院大学,北京 100049
2. Kunming Institute of Botany,Chinese Academy of Sciences,Kunming 650201;
3. University of Chinese Academy of Sciences,Beijing 100049
糖代谢在种子发育过程中具有重要作用。它不仅可以为种子生长发育提供营养物质和能量,与储存物质累积密切相关[1, 2],还可以作为关键的发育信号[3-5],调控种子完成细胞分裂和扩增、营养物质储存以及种子干燥成熟等一系列生理过程[6, 7]。通常,叶片(源器官)光合作用的产物主要以蔗糖的形式转运至果实、种子和根(库器官)中[8],并通过一系列生理生化过程将蔗糖卸载并转化为蛋白质、淀粉和油脂等营养物质储存在库器官中[9-11]。参与植物糖代谢与转运的酶主要分为3类:一是蔗糖转运蛋白(Sucrose transporter,SUT),参与蔗糖转运[1, 12, 13];二是蔗糖合成酶(Sucrose synthase,SS)和蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS),主要参与蔗糖合成[14-16];三是蔗糖转化酶(Invertase,INV),参与蔗糖分解[14, 16]。在种子发育早期,细胞处于旺盛的分裂和分化阶段,可溶性糖主要由葡萄糖和果糖组成,蔗糖含量低。此时,较高的己糖/蔗糖比值作为重要的糖信号,可以促进蔗糖转化酶高效表达,迅速将蔗糖转化为葡萄糖和果糖,用以满足发育早期较高的能量需求[17]。而在种子发育中后期,己糖/蔗糖比值下降,蔗糖合成酶和蔗糖磷酸合成酶高效表达;大部分葡萄糖和果糖转化为蔗糖(此阶段的可溶性糖主要由蔗糖组成),并用于蛋白质和油脂等储存物质合成[18]。
油脂累积不仅在油料种子发育和萌发过程中具有重要的生理意义,而且在粮食安全和生物能源开发领域也占据关键地位。所以,油料种子发育过程中脂肪酸合成与油脂累积的机理研究受到越来越多的关注。在油料种子发育过程中,可溶性糖代谢与油脂累积过程密切相关。通常,随着种子发育和储存物质累积,可溶性糖逐渐转化为脂肪酸和油脂储存下来[19]。在油料种子发育过程中往往存在一个显著的可溶性糖组分变化时期,它会直接或间接地影响后期种子油脂累积[20]。例如,在油菜种子油脂累积的前期,大量的可溶性糖转化为淀粉,并暂时性储存在胚中。随着种子发育和油脂累积过程的持续,淀粉逐渐转变为可溶性糖,并用于脂肪酸合成和油脂累积。另外,在油脂累积过程中,糖代谢(糖酵解或磷酸戊糖途径)的中间产物是脂肪酸合成与油脂累积的主要碳源[21]。在小桐子种子油脂累积时期,葡萄糖-6-磷酸(Glucose-6-phosphate)和磷酸三碳糖(Triose-phosphate)是脂肪酸合成的主要碳源[22]。已有研究表明,通过改变糖代谢相关基因的表达,可以显著提高种子油脂累积[23]。为探讨油料种子发育过程中可溶性糖代谢与油脂累积的关系,本研究利用高效液相色谱和RNA-seq测序技术调查不同发育时期蓖麻种子可溶性糖含量、组分及相关代谢基因的变化,并通过放射性同位素示踪的方法揭示蓖麻种子可溶性糖代谢在油脂累积过程中的作用,以期为蓖麻品种改良和分子育种提供理论参考。
1 材料与方法 1.1 材料本研究所用蓖麻(Ricinus communis L.)品种为淄蓖306,种子由山东省淄博市农业科学研究院提供。通常,蓖麻果实发育和种子成熟需要60 d。本研究以授粉后第一天的雌花开始挂牌记录果实发育天数(Days after pollination,DAP),分别选取授粉后第12、24、36、48和60天的种子和果皮作为实验材料。
1.2 方法 1.2.1 蓖麻种子鲜重、干重及含水量测定在实验样地内分别采集DAP 12、24、36、48和60 d的果实20颗,迅速带回实验室。用解剖刀将发育种子从果实内剥离,分别在分析天平上称量种子和果皮重量,记为鲜重(fresh weight,FW)。然后分别将10个不同发育时期的种子和果皮用液氮速冻,于-80 ℃保存备用(种子可溶性糖和含油量检测)。另外,分别将10个不同发育时期的种子和果皮用锡箔纸包裹,于65 ℃烘箱内烘干至恒重,记为种子干重(dry weight,DW)。根据以下公式计算种子含水量:
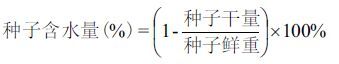
采用正己烷 -异丙醇法检测种子油脂含量[22]。取100 mg烘干后的蓖麻种子于球磨机内粉碎,加入2 mL提取液(正己烷 ∶异丙醇=3 ∶2,V/V),200 µL 0.1% NaCl溶液和5 µL BHT(butylated hydroxytoluene),充分振荡混匀后,12 000 r/min 离心5 min。收集上清液并重复以上步骤2次,将合并的上清液放入真空干燥箱内,于55 ℃,-0.6 MPa条件下挥发有机试剂至恒重,记为总油脂重量。根据以下公式计算种子油脂含量:
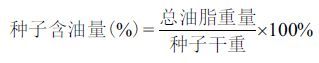
由于蓖麻种子油脂含量高,本研究中可溶性糖提取在Ribeiro等[24]方法的基础上略有改进。称取0.5 g组织材料(种子或果皮),研磨后加人10 mL提取液(氯仿 ∶异丙醇 ∶水= 3 ∶2 ∶1,V/V)充分振荡1 min,8 000 r/min 离心10 min,收集上层清液,有机相用10 mL 纯水重复提取2次。合并上清液,并用0.45 µm滤膜过滤,定容到25 mL供HPLC分析。可溶性糖组分测定参照王艳颖等[25]的高效液相色谱 -蒸发光散射法测定(略有改进)。仪器如下:高效液相色谱仪(Aglient 1100 Series型,美国Agilent公司),蒸发光散射检测器(Varian 380-LC型,美国VARIAN公司)。色谱分离条件如下:色谱柱(Carbohydrate High Perfermance 4 µm 4.6×250 mm Cartridge,美国Waters公司),上样量为5 μL,柱温为30 ℃,流动相为乙腈 ∶水=75 ∶25(V/V),流速为1 mL/min,单样品测量时间为28 min。蒸发光散射检测器(ELSD)气化温度为80 ℃,雾化温度为60 ℃,氮气作载气,流速1.7 L/min。
1.2.4 基于RNA-seq测序的糖代谢与油脂累积相关基因表达分析分别选取发育早期(DAP20)和中后期(DAP40)蓖麻种子3粒。种子总RNA提取、文库构建和RNA-seq测序委托北京诺禾生物技术有限公司完成。使用RPKM 法(Reads Per Kb per Million reads)计算基因表达量[26],计算公式为:
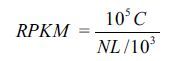
其中:RPKM,目的基因表达量;C,唯一比对到目的基因的reads数量;N,唯一比对到参考基因的总reads数量;L,目的基因的碱基数量。
1.2.5 14C放射性同位素示踪与代谢通量分析在实验样地内选取10株长势相近的植株,并随机分为对照组和遮阴处理组。对照组不做任何处理;在遮阴处理组植株上方1.5 m处设置遮阳网(光照强度下降80%)。遮阴处理一周后,分别在两组植株上选取5颗发育早期(DAP20)和中后期(DAP40)的果实,并在距离果实果柄1 cm处注射1 mL 14 C-蔗糖溶液,分别于0、4、8、12、16、20和24 h后采摘果实。置于液氮速冻后,按照方法1.2.2中介绍,将种子提取液分为正己烷相(含油脂)和水/异丙醇相(含可溶性糖)用于代谢通量分析。分别取1 mL以上溶液,并加入1 mL闪烁液后,使用液体闪烁仪(MicroBeta2 Plate Counter,美国PerkinElmer公司)读取样品放射性强度。
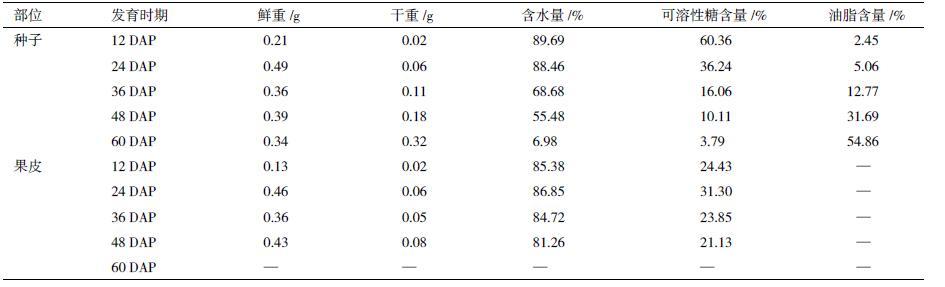
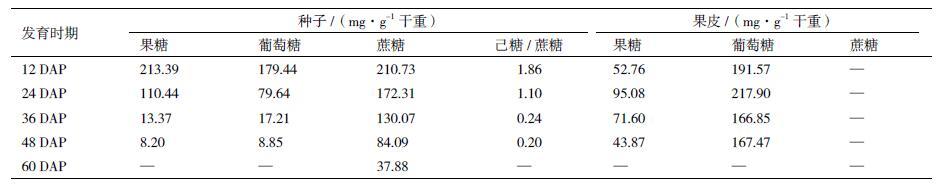
2 结果 2.1 不同发育阶段蓖麻种子和果皮可溶性糖含量及组分变化蓖麻种子发育可以分为细胞分裂分化、储存物质累积和成熟干燥3个发育时期。在细胞分裂分化时期(DAP1 2-24):种子鲜重迅速增加并达到最大值(0.49 g),干重增加相对缓慢,油脂含量较低;但种子含水量和可溶性糖含量高(表 1)。在储存物质累积时期(DAP2 4-48):种子鲜重略有下降,干重和油脂含量迅速增加,而种子含水量和可溶性糖含量逐渐下降。在成熟干燥时期(DAP4 8-60):种子完成生理成熟,含水量和可溶性糖含量急剧下降;干重和油脂含量持续增加,并分别达到最大值(0.32 g和54.86%)。整体而言,可溶性糖含量与油脂含量表现出一定的负相关性,即可溶性糖含量随着蓖麻种子发育逐渐下降,而油脂含量表现为逐渐上升的趋势。相对于发育种子,蓖麻果皮含水量和可溶性糖含量相对稳定,与种子油脂含量变化的相关性较小(表 1)。 为进一步调查蓖麻种子和果皮可溶性糖组分的变化,利用高效液相色谱法检测了不同发育时期种子和果皮的可溶性糖组分变化。实验结果(图 1)表明,蓖麻种子可溶性糖主要由果糖、葡萄糖和蔗糖组成;而果皮可溶性糖主要由果糖和葡萄糖组成,其中葡萄糖含量约为果糖的 2-4倍(表 2)。随着蓖麻种子发育,果糖、葡萄糖和蔗糖均表现出逐渐下降的趋势。另外,在发育早期(DAP1 2-24)己糖含量(果糖和葡萄糖)高于蔗糖含量,己糖/蔗糖比值约为1.1 0-1.86;而在发育中后期(DAP2 4-60)己糖含量急剧下降,明显低于蔗糖含量,己糖/蔗糖比值约为 0-0.24。相对于发育种子,果皮内葡萄糖和果糖含量相对稳定,随着果实发育未表现出明显的变化趋势。所以,通过调查发育种子和果皮内可溶性糖含量及组分的变化可以得出:蓖麻种子内可溶性糖的变化与种子油脂累积具有一定的负相关性;而果皮内可溶性糖变化对种子油脂的累积影响甚微。

|
| 图 1 对照品(A)与蓖麻样品(B)HPLC 色谱图 |
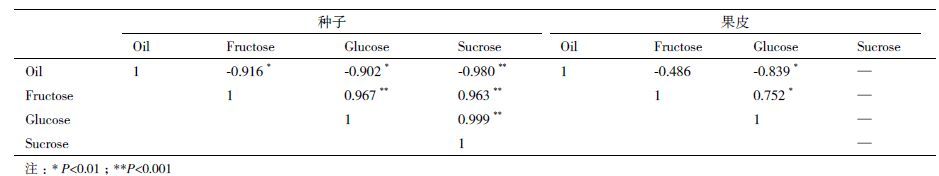
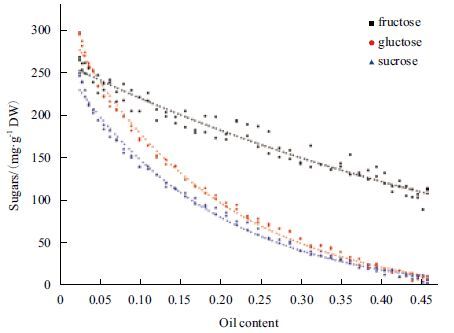
由于蓖麻种子可溶性糖含量变化与油脂含量变化表现出一定的负相关现象,本研究通过批量检测不同发育时期(以油脂含量为标准)蓖麻种子油脂含量及果糖、葡萄糖和蔗糖含量的变化得出:随着蓖麻种子油脂含量增加,蔗糖含量呈逐渐缓慢下降趋势;而果糖和葡萄糖含量在油脂含量较低范围内(0.0 2-0.20)迅速下降,在油脂含量较高的范围内(0.2 0-0.45)下降相对缓慢(图 2)。在低油脂含量范围内,种子处于细胞分裂分化阶段,旺盛的能量代谢需要大量消耗果糖和葡萄糖,用于满足发育早期种子快速生长和能量需求;而在高油脂含量范围内,果糖和葡萄糖的含量较低,种子发育的主要碳源为蔗糖,随着油脂快速累积,蔗糖含量呈现明显的直线下降趋势。通过对蓖麻种子油脂含量与果糖、葡萄糖和蔗糖含量进行皮尔逊相关分析发现:油脂含量与果糖、葡萄糖和蔗糖含量存在显著的负相关性(表 3)。其中,蔗糖含量变化与油脂含量表现出极显著的负相关性(P<0.001),意味着蔗糖代谢在油脂累积过程中具有重要作用。另外,对蓖麻种子油脂含量与果皮内果糖和葡萄糖进行皮尔逊相关分析发现(果皮内未检测到蔗糖):葡萄糖含量变化与种子油脂含量表现出一定的负相关性(P<0.01),但相关系数(-0.839)明显小于种子内各种糖分(表 3)。因此,果皮内葡萄糖代谢在种子油脂累积过程中可能也具有一定作用。但整体而言,蓖麻种子内可溶性糖代谢(尤其是蔗糖)在油脂累积过程具有更为重要的意义。
|
| 图 2 蓖麻种子可溶性糖组分变化与含油量关系 |
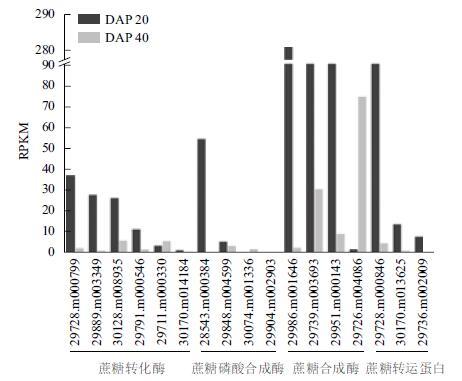
为进一步了解蓖麻种子糖代谢与油脂累积过程在基因表达水平的关系,本研究对发育早期(DAP-20)和中后期(DAP40)蓖麻种子进行RNA-seq测序,结果(图 3)显示,蔗糖转化酶、蔗糖合成酶、蔗糖磷酸合成酶和蔗糖转运蛋白均在蓖麻种子发育早期大量表达,这与蓖麻种子发育早期旺盛的糖代谢过程和较高的可溶性糖含量密切相关。蔗糖转运蛋白存在3个同工酶,其中29728.m000846在种子发育早期大量表达,可能在蓖麻种子发育早期蔗糖的吸收与卸载相关。蔗糖转化酶存在6个同工酶,在种子发育早期29728.m000799、29889.m003349和30128.m008935表达量相对较高,与发育早期较高的己糖含量关系密切。在种子蔗糖合成代谢中,蔗糖磷酸合成酶表达量整体偏低(仅28543.m000384在种子发育早期表达量较高);相反,蔗糖合成酶大量表达,其中29986.m001646、29739.m003693和29951.m000143在发育早期表达量高,而29726.m004086在种子发育后期大量表达。所以,在蓖麻种子蔗糖合成代谢过程中,蔗糖合成酶具有重要作用。
|
| 图 3 蓖麻种子中蔗糖代谢关键基因表达变化 |
同样,在早期种子(DAP20)中己糖代谢相关基因表达量明显高于中后期(DAP40)。参与糖酵解过程的果糖-1 ,6-二磷酸醛缩酶、磷酸果糖激酶和葡糖糖-6-磷酸异构酶表达量整体偏高,而已糖激酶表达量较低(图 4)。另外,催化果糖进入糖酵解过程的果糖激酶(29569.m000151)表达量很高,这与蓖麻种子发育早期旺盛的糖代谢过程和较高的己糖含量密切相关。很显然,早期发育种子细胞分裂分化与旺盛的能量代谢与糖酵解过程相关基因大量表达相吻合。但由于己糖代谢酶存在多个同工酶,可能存在表达的组织特异性。所以,在蓖麻种子及糖代谢过程中起主要作用的分别是:果糖-1 ,6-二磷酸醛缩酶(29092.m000460)、果糖激酶(29569.m000151)和葡萄糖-6-磷酸异构酶(29908.m006236),其表达量显著高于其它同工酶。
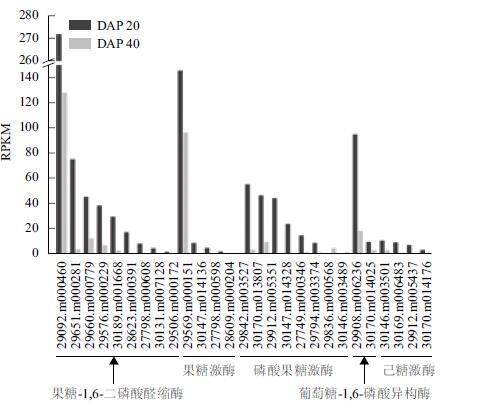
|
| 图 4 蓖麻种子中己糖代谢关键基因表达变化 |
油脂累积相关基因的表达模式与糖代谢基因相反:在蓖麻种子发育早期基因表达水平整体偏低,而发育中后期表达水平显著上调(图 5)。尤其是与油体形成相关的油体蛋白(Oleosin 1和Oleosin 2)基因在发育中后期特异性高表达(RPKM值分别为3982.34和1063.53),这充分表明此时期油脂在种子内快速合成并累积下来。另外,脂肪酸合成与三酰甘油组装相关基因同样在发育中后期上调表达,其中参与酰基转运的酰基载体蛋白(30128.m008670)和二酰甘油酰基转移酶(29682.m000581)表达量明显升高;参与脂肪酸合成的 β-酮脂酰-酰基载体蛋白还原酶(29929.m004732)和乙酰辅酶A羧化酶的生物素羧化酶亚基(29630.m000809)表达量也显著上调。在酰基修饰过程中,参与蓖麻油酸前体合成的硬脂酰酰基载体蛋白去饱和酶(27985.m000877)和蓖麻油酸形成的12-油脂酰羟基化酶(28035.m000362)表达水平在发育中后期明显上调。
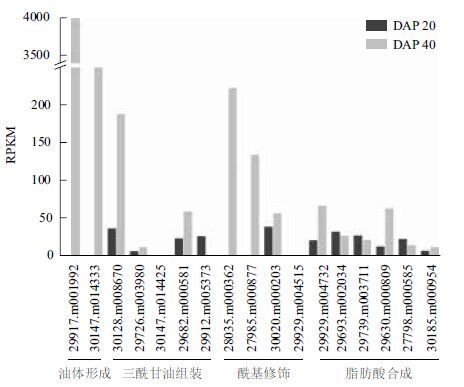
|
| 图 5 蓖麻种子中糖代谢关键基因表达变化 |
综上所述,糖代谢和油脂累积相关基因的表达趋势与可溶性糖和油脂含量的变化趋势相吻合。整体表现为发育早期糖代谢基因表达量较高,油脂累积相关基因表达量偏低;而在发育中后期糖代谢基因下调表达,油脂累积相关基因上调表达。
2.4 遮阴处理对糖代谢与油脂累积过程的影响14C蔗糖放射性示踪实验表明,遮阴处理(光照强度下降80%)使发育种子的蔗糖吸收能力显著下降,发育早期(DAP20)和中后期(DAP40)蓖麻种子的蔗糖吸收明显下降(图 6)。另外,随着蔗糖吸收的减少,种子的代谢通量也发生明显变化:在蓖麻种子发育早期(DAP20),种子吸收的蔗糖主要用于糖代谢过程,碳通量主要流向可溶性糖部分,而油脂部分的代谢通量相对较低;遮阴处理后油脂部分的代谢通量进一步降低,意味着糖类向油脂转化过程受到明显抑制。在种子发育中后期(DAP40),大部分碳通量流向油脂部分,可溶性糖部分的代谢通量明显下降。遮阴处理后油脂部分代谢通量下降而可溶性糖部分的代谢通量则略有增加,表明在油脂快速累积时期蔗糖吸收的减少同样使可溶性糖代谢通量流向油脂部分的过程受到抑制。这充分说明可溶性糖代谢在蓖麻种子油脂累积过程中具有重要作用,降低种子可溶性糖含量能够明显抑制糖类向油脂转化,进而限制蓖麻种子油脂累积。
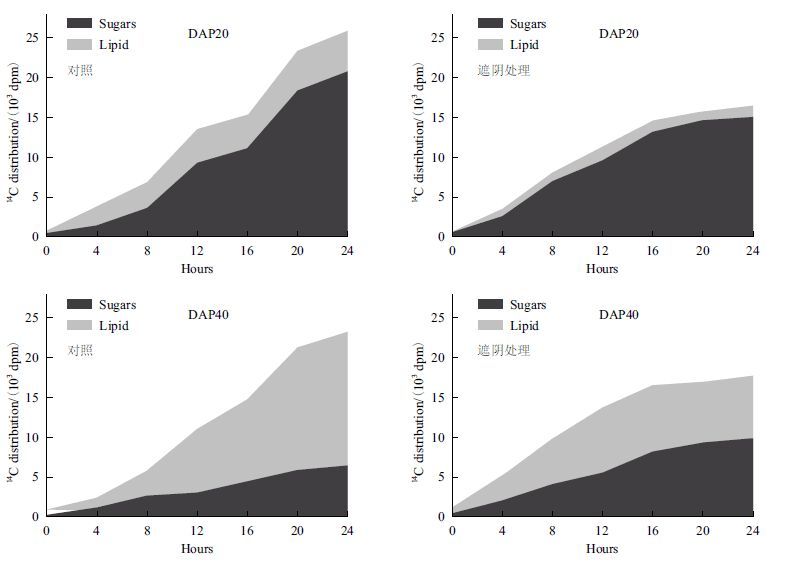
|
| 图 6 遮阴处理后蓖麻种子可溶性糖与油脂代谢通量变化 |
通过分子改良和遗传育种等手段修饰部分油脂代谢基因可以在一定程度上促进油料种子内油脂累积。但由于种子油脂累积是一个十分复杂的代谢过程,操作部分代谢酶的活性通常会受到整个油脂代谢网络的反馈调节,并不能使种子油脂累积达到预期的目标[27]。而通过增强种子“库强”的方式,增加光合代谢产物的供给(主要是蔗糖等可溶性糖)则可以显著提高种子含油量[23]。很显然,大量碳源的供给是脂肪酸合成与油脂累积的必要前提,改变种子可溶性糖供给和糖代谢水平对油脂累积过程中具有重要意义。
在油料种子中,可溶性糖代谢与油脂累积的关系较为复杂。前人对油菜果荚的研究认为,果荚的糖代谢过程对油菜种子油脂含量具有决定性作用[28]。在蓖麻果实发育过程中,尽管果皮内葡萄糖含量变化与种子油脂累积表现出一定的负相关性,但整体而言,果皮可溶性糖代谢对种子油脂累积影响相对较弱(表 3)。而种子可溶性糖含量与油脂累积过程存在明显的负相关关系,随着种子发育,可溶性糖含量逐渐降低而油脂含量逐渐升高(表 1)。在油菜果实发育和油脂累积时期,叶片光合作用降低(大部分叶片已经衰老),果荚光合作用产物(可溶性糖)是种子发育的主要碳源。果皮内可溶性糖水平的变化直接影响种子内储存物质累积(油脂)。相反,蓖麻果实光合作用的贡献相对较小,种子发育的主要碳源由叶片光合作用提供。所以,果皮内可溶性糖代谢对种子油脂累积的影响较弱;而种子内可溶性糖(尤其是蔗糖)含量变化与油脂累积则呈现显著的负相关性(表 3),种子内可溶性糖代谢在油脂累积过程中可能具有更为重要的作用。
蓖麻种子内可溶性糖主要由蔗糖、葡萄糖和果糖构成(表 2)。其中,己糖/蔗糖比值通常被视为种子发育过程中重要的生理信号。整体而言,种子发育初期己糖/蔗糖比值较高,可溶性糖主要以代谢较活跃的果糖和葡萄糖形式存在。发育初期糖类为种子的快速生长提供大量能量,以完成鲜重的急剧增加和快速的细胞分裂分化进程。而在发育中后期,种子代谢水平趋缓,可溶性糖主要以代谢较稳定的蔗糖形式存在,随种子发育和成熟储存下来或转化为蛋白质、淀粉和油脂等大分子高能量物质储存在种子中。所以,在蓖麻种子发育早期己糖/蔗糖比值较高(表 2),参与糖酵解过程的相关基因具有较高表达量(图 4)。张凌云等[29]对油茶果实糖含量与油脂累积的研究认为种子发育后期较高的蔗糖浓度可以促进蔗糖向储存物质转化,为油脂累积过程提供碳源。同样,在蓖麻种子发育中后期(DAP3 6-60),己糖/蔗糖比值明显小于发育早期,可溶性糖含量(主要是蔗糖)随种子发育和油脂累积呈明显的下降趋势(表 2)。通过皮尔逊相关分析得出,蓖麻种子蔗糖含量与种子油脂累积存在极显著的负相关性(表 3)。综上所述,在蓖麻种子油脂累积时期,蔗糖代谢对脂肪酸合成和油脂累积过程具有重要作用。
蔗糖代谢主要由蔗糖转化酶、磷酸蔗糖合成酶和蔗糖合成酶综合调控。通常,蔗糖合成酶对储存器官的“库强”起决定性作用,在光合产物的转运和分配过程中具有重要作用。在番茄果实发育过程中,降低蔗糖合成酶酶活性可以显著降低果实“库强”,储存物质(淀粉)累积显著下降[30]。另外,于安民等[31]也报道蔗糖合成酶对阳春砂果实糖代谢具有关键作用。同样,在蓖麻种子内蔗糖合成酶整体表达水平远高于蔗糖转化酶和磷酸蔗糖合成酶(图 3)。本研究认为在蓖麻种子发育过程中,蔗糖合成酶对蔗糖代谢起关键性作用。然而,也有一些学者认为蔗糖转化酶能够不可逆地将蔗糖分解为果糖和葡萄糖,是蔗糖分解过程中的关键酶。而在本研究中发现:蓖麻发育早期的蔗糖转化酶表达量并不高;相反,蔗糖合成酶表达量却非常高(图 3)。我们认为蔗糖合成酶在分解方向上的活性应该是蓖麻种子发育早期蔗糖分解的主要动力。因为蔗糖合成酶能够可逆性催化蔗糖与尿苷二磷酸生成果糖和尿苷二磷酸葡萄糖,所以蔗糖合成酶同时具有合成方向与分解方向的酶活性。很显然,蓖麻种子发育早期较高的己糖含量应该是蔗糖合成酶分解方向的产物。对于蓖麻种子蔗糖合成过程而言,磷酸蔗糖合成酶和蔗糖合成酶共同参与蔗糖合成,其中蔗糖合成酶(29726.m004086)在种子发育中后期具有较高的表达量(图 3),可能对种子油脂累积具有一定的促进作用。Moriguchi等[32]也发现在桃果实发育后期蔗糖积累中,蔗糖合成酶具有重要作用。而此时期蓖麻种子内较高的蔗糖合成酶基因表达量可能预示着糖类向油脂转化,高浓度的蔗糖被用作脂肪酸合成与油脂累积的主要碳源。
通过遮阴处理降低种子的“库强”,可以使蓖麻种子的蔗糖吸收显著下降(图 6)。而蔗糖吸收的下降对种子内部的代谢通量具有显著影响:可溶性糖向油脂代谢的碳通量受到限制,这进一步证实可溶性糖代谢在油脂累积过程中具有重要作用。在拟南芥种子中过表达蔗糖转运蛋白可以显著增加可溶性糖含量,使种子油脂含量得到显著提高[23]。所以,通过改变种子“库强”的方式调节种子的可溶性糖代谢,能够有效地调控种子的油脂累积过程。鉴于可溶性糖代谢与油脂累积的密切联系,可以综合考虑糖信号感受、转录调控、可溶性糖代谢和油脂累积的相互作用,通过代谢工程的方式促进蓖麻种子内糖类向油脂转化,提高种子油脂含量。本研究认为通过代谢工程的方式促进糖类向油脂转化,有望进一步提高蓖麻种子油脂含量。
4 结论蓖麻果实由果皮和种子两部分组成。果皮可溶性糖含量较稳定,对种子油脂累积的影响相对较弱。而种子可溶性糖含量与油脂累积过程呈现显著的负相关性。随着种子油脂不断累积,可溶性糖含量呈逐渐下降趋势。蓖麻种子的可溶性糖主要由葡萄糖、果糖和蔗糖构成。其中,蔗糖含量与种子油脂含量存在极显著的负相关关系。14C放射性同位素实验证实:降低蓖麻种子蔗糖摄入量,可以显著抑制糖类向油脂转化。对糖代谢和油脂累积相关基因进行RNA-seq测序分析得出:在蓖麻种子发育过程中,蔗糖合成酶在糖代谢过程中扮演重要角色,可能对油脂累积过程具有一定的促进作用。
| [1] | Weichert N, Saalbach I, Weichert H, et al. Increasing sucrose uptake capacity of wheat grains stimulates storage protein synthesis[J]. Plant Physiology, 2010, 152(2): 698–710. |
| [2] | Rosche E, Blackmore D, Tegeder M, et al. Seed-specific overexpression of a potato sucrose transporter increases sucrose uptake and growth rates of developing pea cotyledons[J]. Plant Journal, 2002, 30(2): 165–175. |
| [3] | Ljung K, Nemhauser JL, Perata P. New mechanistic links between sugar and hormone signalling networks[J]. Current Opinion in Plant Biology, 2015, 25: 130–137. |
| [4] | Lobo AKM, Martins MDO, Neto MCL, et al. Exogenous sucrose supply changes sugar metabolism and reduces photosynthesis of sugarcane through the down-regulation of Rubisco abundance and activity[J]. Journal of Plant Physiology, 2015, 179: 113–121. |
| [5] | Payyavula RS, Singh RK, Navarre DA. Transcription factors, sucrose, and sucrose metabolic genes interact to regulate potato phenylpropanoid metabolism[J]. Journal of Experimental Botany, 2013, 64(16): 5115–5131. |
| [6] | Ruan YL, Patrick JW, Bouzayen M, et al. Molecular regulation of seed and fruit set[J]. Trends in Plant Science, 2012, 17(11): 656–665. |
| [7] | Weber H, Borisjuk L, Wobus U. Sugar import and metabolism during seed development[J]. Trends in Plant Science, 1997, 2(5): 169–174. |
| [8] | Slewinski TL, Braun DM. Current perspectives on the regulation of whole-plant carbohydrate partitioning[J]. Plant Science, 2010, 178(4): 341–349. |
| [9] | Peuke AD, Gessler A, Trumbore S, et al. Phloem flow and sugar transport in Ricinus communis L[J]. Plant Cell and Environment, 2015, 38(3): 433–447. |
| [10] | Li X, Wang C, Cheng J, et al. Transcriptome analysis of carbohydrate metabolism during bulblet formation and development in Lilium davidii var[J]. BMC Plant Biology, 2014, 14(1): 358. |
| [11] | Desnoues E, Gibon Y, Baldazzi V, et al. Profiling sugar metabolism during fruit development in a peach progeny with different fructoseto- glucose ratios[J]. BMC Plant Biology, 2014, 14(1): 336. |
| [12] | Chen L, Lin IW, Qu X, et al. A cascade of sequentially expressed sucrose transporters in the seed coat and endosperm provides nutrition for the Arabidopsis embryo[J]. Plant Cell, 2015, 27(3): 607–619. |
| [13] | Kühn C, Grof CP. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology, 2010, 13(3): 287–297. |
| [14] | Wind J, Smeekens S, Hanson J. Sucrose :Metabolite and signaling molecule[J]. Phytochemistry, 2010, 71(14-15): 1610–1614. |
| [15] | Fallahi H, Scofield GN, Badger MR, et al. Localization of sucrose synthase in developing seed and siliques of Arabidopsis thaliana reveals diverse roles for SUS during development[J]. Journal of Experimental Botany, 2008, 59(12): 3283–3295. |
| [16] | Koch K. Sucrose metabolism :regulatory mechanisms and pivotal roles in sugar sensing and plant development[J]. Current Opinion in Plant Biology, 2004, 7(3): 235–246. |
| [17] | Morley-Smith ER, Pike MJ, Findlay K, et al. The transport of sugars to developing embryos is not via the bulk endosperm in oilseed rape seeds[J]. Plant Physiology, 2008, 147(4): 2121–2130. |
| [18] | Gibson SI. Control of plant development and gene expression by sugar signaling[J]. Current Opinion in Plant Biology, 2005, 8(1): 93–102. |
| [19] | Hill LM. Metabolism of sugars in the endosperm of developing seeds of oilseed rape[J]. Plant Physiology, 2003, 131(1): 228–236. |
| [20] | Borisjuk L, Rolletschek H, Radchuk R, et al. Seed development and differentiation :a role for metabolic regulation[J]. Plant Biology, 2004, 6(4): 375–386. |
| [21] | Chapman KD, Ohlrogge JB. Compartmentation of triacylglycerol accumulation in plants[J]. Journal of Biological Chemistry, 2012, 287(4): 2288–2294. |
| [22] | Liu H, Wang C, Komatsu S, et al. Proteomic analysis of the seed development in Jatropha curcas :From carbon flux to the lipid accumulation[J]. Journal of Proteomics, 2013, 91: 23–40. |
| [23] | Allen SM, Damude HG, Everard JD, et al. Sucrose transporter genes for increasing plant seed lipids :US, US20110126318 A1[P].2011-5-26. |
| [24] | Ribeiro P, Fernandez L, de Castro R, et al. Physiological and biochemical responses of Ricinus communis seedlings to different temperatures :a metabolomics approach[J]. BMC Plant Biology, 2014, 14(1): 223. |
| [25] | 王艳颖, 胡文忠, 庞坤, 等. 高效液相色谱- 蒸发光散射法测 定苹果中可溶性糖的含量[J]. 食品与发酵工业, 2008, 34(6): 129–131. |
| [26] | Mortazavi A, Williams BA, McCue K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nature Methods, 2008, 5(7): 621–628. |
| [27] | Bates PD, Johnson SR, Cao X, et al. Fatty acid synthesis is inhibited by inefficient utilization of unusual fatty acids for glycerolipid assembly[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(3): 1204–1209. |
| [28] | Hua W, Li R, Zhan G, et al. Maternal control of seed oil content in Brassica napus :the role of silique wall photosynthesis[J]. Plant Journal, 2012, 69(3): 432–444. |
| [29] | 张凌云, 王小艺, 曹一博. 油茶果实糖含量及代谢相关酶活性 与油脂积累关系分析[J]. 北京林业大学学报, 2013, 35(4): 55–60. |
| [30] | Wang F, Sanz A, Brenner ML, et al. Sucrose synthase, starch accumulation, and tomato fruit sink strength[J]. Plant Physiology, 1993, 101(1): 321–327. |
| [31] | 于安民, 张敏, 杨锦芬, 等. 阳春砂果实发育过程中可溶性糖 及蔗糖代谢酶活性变化规律的研究[J]. 世界科学技术- 中 医药现代化, 2014, 7: 1497–1504. |
| [32] | Moriguchi T, Sanada T, Yamaki S. Seasonal fluctuations of some enzymes relating to sucrose and sorbitol metabolism in peach fruit[J]. Journal of the American Society for Horticultural Science, 1990, 115(2): 278–281. |