药用野生稻是原产中国的3种野生稻之一,由于长期生长在恶劣的自然条件下,药用野生稻经受了各种自然灾害和不良环境的自然选择,是一种很稀缺和重要的野生稻种质资源,具有极高的科学研究价值[1]。
氮素是植物需求量最大的营养元素,长期大量单一施用化肥会造成肥料利用率低、农产品质量下降和环境污染,生物固氮可以为农作物提供氮素,与化肥相比不会降低土壤生产力、不污染环境,还是取之不尽、用之不竭的廉价氮源[2]。
植物内生固氮菌是指那些定殖在健康植物体内,与宿主植物进行联合固氮的一类微生物[3]。人们最早发现于1986年从巴西的甘蔗中分离得到内生固氮菌,迄今不到30年[4]。内生固氮菌是植物微生态系统的天然组分,可以通过固氮作用、产生生理活性物质、抗逆境、抗动物摄食和拮抗病原菌等作用从而促进宿主对环境的适应[5]。研究表明某些内生固氮菌具有促进植物生长、提高作物产量、生物防治等作用。Glick等[6]研究表明植物根际促生菌可产生1-氨基环丙烷-1-羧酸(1-Aminocyclopropane-1-carboxylate,ACC)脱氨酶,该酶通过催化乙烯的前体ACC分解成α-丁酮酸和氨来降低植物体内乙烯的合成,从而减少过量乙烯对植物生长造成的不利影响。王桂文等[7]研究认为内生固氮菌对植物的促生作用主要是通过生物固氮为植物提供氮营养或合成某些植物生长调节物质,如生长素、赤霉素。还有研究表明铁载体在植物根际促生菌对土传病害的生防有重要作用,田方等[8]发现产铁载体菌株可与根际病原微生物争夺有限铁营养而抑制病原微生物生长。还有研究表明某些内生固氮菌有强大的溶磷功能,通过分泌物或吸收作用把土壤中无效态磷转化为植物可以利用的有效态磷[9]。国内外对很多禾本科植物内生固氮菌的研究非常多,但是对生长于自然生态环境的药用野生稻内生固氮菌研究并不多。
本研究采用3种选择性无氮培养基从广西藤县药用野生稻中分离得到34株内生固氮菌,通过IS-PCR指纹图谱和全细胞蛋白电泳对所分离的内生固氮菌进行聚类分析。根据每个类群代表菌株的生理生化鉴定和16S rRNA基因序列分析构建系统发育树,旨在丰富内生固氮菌的菌种资源库和挖掘其在农业生产上的潜在应用价值,为微生物肥料生产收集菌种资源。
1 材料与方法 1.1 材料药用野生稻采集于广西梧州市藤县蒙江镇那塘村一处山洼。
采用Döbereiner改良无氮培养基[10](简称DN)、NFb无氮培养基[10]和CCM低氮培养基[11]3种选择培养基进行固氮菌的分离与筛选,VM-Ethanol培养基[10]进行富集培养。
1.2 方法 1.2.1 菌株分离纯化和固氮酶活性测定消毒:将野生稻的根、茎、叶冲洗干净后,切成3 cm左右小段放入灭菌培养皿中,先用70%乙醇浸泡3 min,再用0.1% HgCl2表面消毒3 min,最后用无菌水振荡洗涤5-7次,每次5 min,取最后一次洗涤液涂布LB平板,以检查消毒是否彻底。
分离纯化:将消毒后的根、茎、叶用灭菌剪刀剪碎,分别接种到3种半固体无氮培养基中用反口胶塞密封,37℃培养72 h后向试管中注射1/10体积10%乙炔(使其终浓度为1%)再培养24 h,用气相色谱仪检查固氮酶活性。将有活性的菌株通过对应无氮培养基划线分离,待长出单菌落后挑取单菌落接种至对应半固体培养基,用乙炔还原法检测固氮酶活性,再次划线分离直至获得纯的菌株,最后通过镜检观察其形态确定是否纯化。将纯化的菌株分别用15%无菌甘油保存于-80℃(长期保存)和-20℃(日常使用)。
固氮酶活性测定:将获得的纯菌株制成OD600=1的菌悬液,取10 μL菌液接种于3 mL相对应的半固体无氮培养基的10 mL试管中,反口胶塞密封。372H4和C2H2的峰面积。仪器参数为:柱箱温度80℃,进样器120℃,FID 180℃。根据下列公式计算固氮酶活性[12]:
EA=(58.0×Se×T×Pe)/(Sb×Te×P×t×V)(μmol·mL-1·h-1)
式中,Se:乙烯峰面积;T:开氏绝对温度(T=273.13 K);Pe:实验条件下大气压强(Pa);Sb:乙炔峰面积;Te:实验条件下温度(K);P:绝对大气压强;t:培养时间;V:容器体积。
1.2.2 细菌总DNA提取采用溶菌酶破壁提取DNA,参照毕江涛等[13]方法。
1.2.3 IS-PCR指纹图谱聚类分析参照王华荣等[14]方法,以单引物J3(5'-GCTCAGGTCAGGTGGCCT-GG-3')为引物,PCR反应条件为:95℃预变性3 min;95℃变性1 min,56℃复性50 s,72℃延伸60 s,35个循环;72℃延伸5 min。PCR产物先用1.5%琼脂糖电泳初步分析,再用高分辨率PAGE电泳进一步聚类分析。电泳图谱通过凝胶图像分析软件GIS3.74分析,获得电泳图谱相似性矩阵之后用软件TREECON进行UPGMA聚类。
1.2.4 SDS-PAGE全细胞蛋白电泳分析菌株全细胞可溶性蛋白提取参照谭志远等[11]方法。
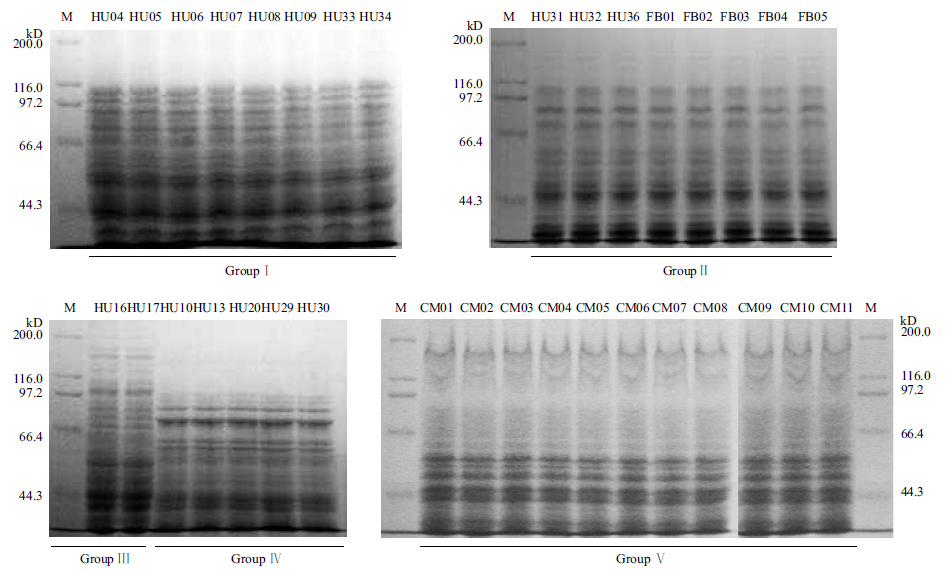
SDS-PAGE电泳分析:选择10%分离胶、 5%浓缩胶进行SDS-PAGE电泳,电泳条件先以60 V恒压30 min左右,待样品进入分离胶之后再以110 V恒压直到溴酚蓝恰好到达胶的底部。为便于比较,在IS-PCR聚类基础上,将同一个类群菌株集中在同一块胶上进行SDS-PAGE蛋白图谱分析。
1.2.5 16SrRNA基因序列分析 参照王华荣等[14]方法,采用通用引物25f:5'-AACTKAAGAGTTTGA-TCCTGGCTC-3'和1492r:5'-TACGG(C/T)TACCT-TGTTACGACTT-3'(K:G或T,Y:C或T)进行扩增,反应条件同IS-PCR。将PCR产物交由睿博兴科生物技术有限公司,测序引物为PCR扩增引物。将所得序列在GenBank数据库中进行比对(Blast),获得相似性较高的公开发表的模式菌株,再用软件GeneDoc进行格式转换和人工比对,比对结果用软件TREECON采用邻比法构建系统发育树。
1.2.6 nifH基因扩增参照Zehr等[15]方法,采用正向引物Zehrf1:5'-TGYGAYCCNAARGCNGA-3',反向引物Zehrr2:5'-NDGCCATCATYTCNCC-3'(D:A,G或T;N:A,G,C或T;Y:C或T;R:A或G)。PCR反应条件:97℃预变性3 min;97℃变性1 min,55℃复性50 s,72℃延伸35 s,32个循环;72℃延伸5 min。1.5%琼脂糖凝胶电泳检测PCR产物。
1.2.7 菌株生理生化鉴定过氧化氢酶、吲哚产生、甲基红测定、乙酰甲基甲醇实验、明胶液化、产氨测定、铁载体检测、NO3-还原实验参照赵斌与何绍江合著的《微生物学实验教程》[16]进行。
溶磷能力定性实验采用点接PKO培养基[9],计算溶磷圈直径与菌株直径比值;定量实验采用钼锑抗比色法[17];生长素定量实验采用Salkowski比色法[18];ACC脱氨酶活性测定[19]采用2,4-二硝基苯肼比色法,ACC脱氨酶活性(nmol/mg·h)=生成α-丁酮酸含量(nmol)/细菌蛋白含量(mg)×培养时间(h)。
2 结果 2.1 内生固氮菌的分离、固氮酶活性和部分菌株nifH基因扩增从供试材料中共分离到内生固氮菌34株,其中根中分离到28株,茎中分离到4株,叶中分离到2株。各菌株的分离来源和固氮酶活性,见表 1。这些菌株的固氮酶活性相差很大,从最低的5.0 nmol/(mL·h)(HU16)到最高的1 036.7 nmol/(mL·h)(HU31),说明其固氮能力存在差异。部分菌株的nifH基因扩增结果见图 1。
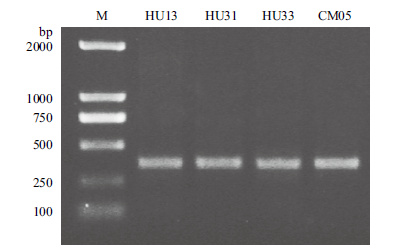
|
| 图 1 部分代表菌株nifH基因片段扩增产物电泳图 |
PCR扩增产物采用高分辨率6% PAGE电泳获得的IS-PCR多态性指纹图谱聚类结果见图 2。利用凝胶图像处理软件GIS3.74进行条带匹配得到同源性分析表,再利用TREECON以UPGMA方法聚类,34株供试菌株在81%的水平上分为5个主要类群,结果见图 3。

|
| 图 2 IS-PCR指纹图谱 A:类群I;B:类群II;C:类群III(HU16、HU17)和类群IV(HU10、HU13、HU20、HU29、HU30);D:类群V |
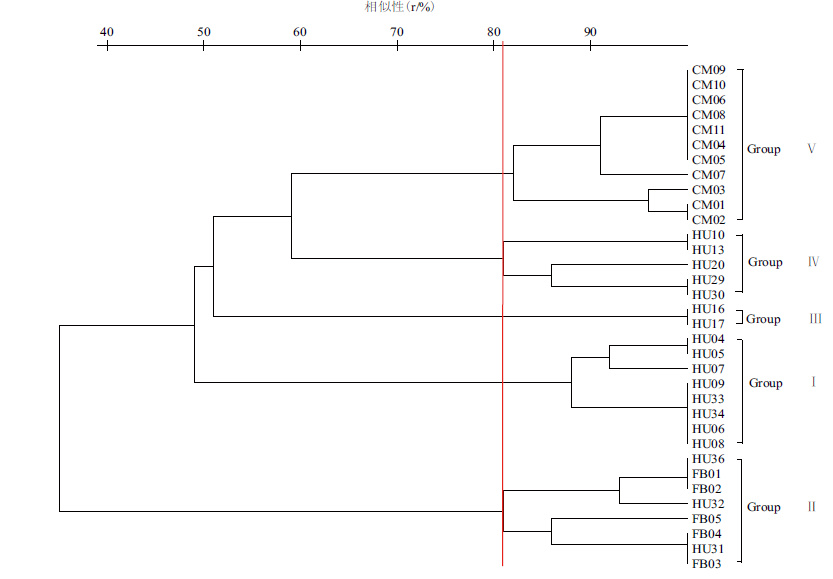
|
| 图 3 IS-PCR指纹图谱聚类树状图 |
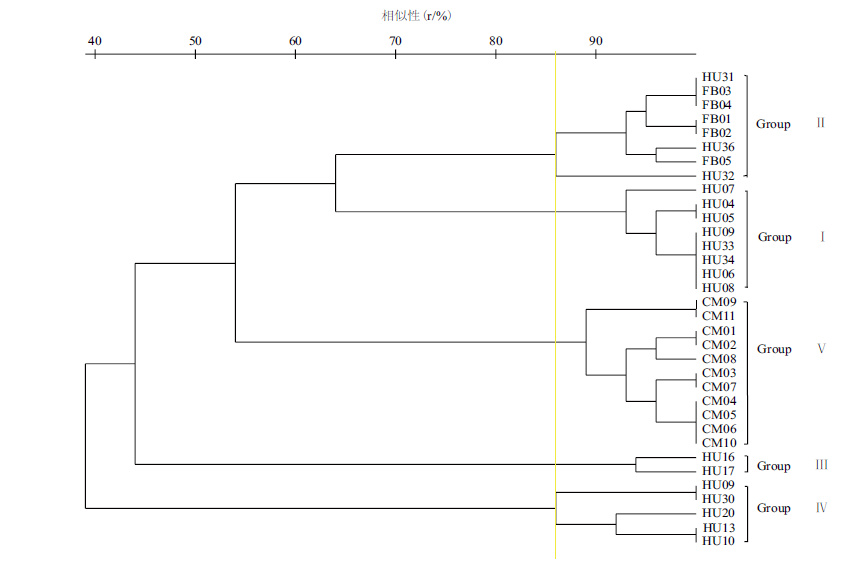
在IS-PCR聚类基础上,对34株供试菌株进行SDS-PAGE全细胞蛋白电泳,电泳图谱见图 4,将得到的电泳图谱采用同样的方法进行聚类分析,结果见图 5。
|
| 图 4 内生固氮菌全细胞蛋白电泳图谱 |
|
| 图 5 全细胞蛋白电泳图谱聚类树状图 |
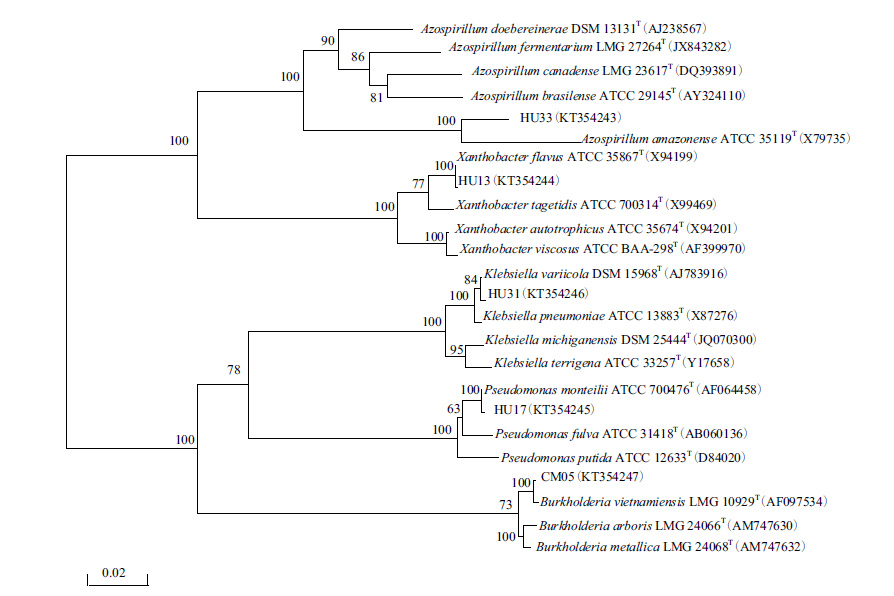
根据IS-PCR DNA指纹图谱和SDS-PAGE全细胞蛋白电泳聚类结果,挑取每一个类群中固氮酶活性最高菌株为代表菌株进行16S rRNA基因序列测定,将测定的序列与GenBank数据库中的模式菌株序列比较分析,并构建系统发育树(图 6)。
|
| 图 6 代表菌株的系统发育关系 |
类群I代表菌株HU33与无乳固氮螺菌(Azospirillum amazonense ATCC 35119T)相似性为97.13%;类群II代表菌株HU31与变栖克雷伯氏菌(Klebsiella variicola DSM 15968T)相似性为99.71%;类群III代表菌株HU17与蒙氏假单胞菌(Pseudomonas monteilii ATCC 700476T)相似性为99.86%;类群IV代表菌株HU13与黄黄色杆菌(Xanthobacter flavus ATCC 35867T)相似性为100%;类群V代表菌株CM05与越南伯克霍尔德菌(Burkholderia vietnamiensis LMG 10929T)相似性为99.86%。
2.5 代表菌株生理生化鉴定5个代表菌株生理生化测定结果(表 2)显示,所有供试菌株都有过氧化氢酶活性,表明这些内生固氮菌能将有毒代谢产物过氧化氢分解保护自身;除了菌株HU13,其他都有硝酸盐还原和产氨能力,说明这些菌株在N循环中可以将硝酸盐还原为亚硝酸盐和氨,再转化为氨基酸和细胞内其它含氮化合物;供试菌株将葡萄糖分解为丙酮酸后,不能再被分解为有机酸,所以甲基红反应为阴性;除了菌株HU13,其他菌株显V.P阳性反应,表明这些菌株能使葡萄糖分解为丙酮酸后再通过缩合和脱羧转变为乙酰甲基甲醇;供试菌株都不能使明胶液化;供试菌株都能分解蛋白胨中色氨酸产生吲哚;HU17、HU31、CMO5能产生铁载体。
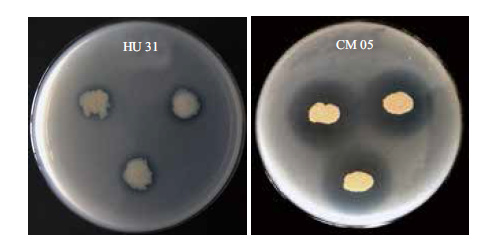
供试菌株在生长过程中都能分泌IAA(3-吲哚-乙酸),菌株分泌IAA浓度在0.5-69.5 μg/mL之间,HU31在有色氨酸存在的情况下产IAA远大于其他菌株,这些生物活性物质可以促进和调节植物生长,细菌合成IAA根据前体中是否包括色氨酸可以分为色氨酸途径和非色氨酸途径。菌株HU13、HU17、HU31合成IAA浓度比不加色氨酸高,说明这3株菌合成IAA主要是色氨酸途径,菌株CM05、HU33主要是非色氨酸途径;菌株CM05和HU31能形成非常明显的溶磷圈(图 7),说明这些菌株可以分泌出有机酸使无效态的磷酸钙溶解转变为植物可以吸收利用的有效态磷;供试菌株都有ACC脱氨酶活性,菌株活性为23.4-205.3 nmol/(mg·h)。
|
| 图 7 菌株的溶磷圈 |
插入序列(insertion sequence,IS)是最简单的转座元件,它的两侧是短反向末端重复序列,不同微生物的插入序列数量和位置存在差异[20],采用插入序列作为引物进行PCR扩增,扩增产物的大小和数量也存在差异。微生物属种确定的标准是菌株与模式菌株的DNA同源性≥70%[21],蛋白质是基因表达的产物,关系密切的细菌在相同生长期蛋白质组成上会有一定的相似性[10, 22]。阳洁等[23]采用IS-PCR指纹图谱和全细胞蛋白电泳图谱聚类方式相结合,将从陈皮中分离得到的23株有益菌分为4个类群。本研究中采用的IS-PCR指纹图谱和全细胞蛋白电泳图谱分别在DNA水平和全细胞蛋白质水平将所获菌株在81%相似性以上聚为5个类群,聚类结果有较好的一致性,聚类结果可以相互验证。
内生菌生活在植物体内,不仅能为宿主植物提供氮素营养,还能分泌生长素、铁载体和ACC脱氨酶促进作物生长、提高作物抗性,并对某些病原菌有拮抗作用,有着生物防治功能,是一类应用潜力巨大的微生物资源[24]。本研究采用3种不同的培养基尽可能多的分离不同种属内生固氮菌,共获得34株内生固氮菌,其中菌株大部分来自于根,少数来自于茎和叶,这与其它植物分离内生固氮菌结果基本一致[9, 10]。通过16S rRNA基因序列分析,所获菌株主要归属为固氮螺菌属、克雷伯氏属、假单胞菌属、黄杆菌属和伯克霍尔德属。原红娟[10]从澳洲野生稻分离获得内生固氮菌有伯克霍尔德属、克雷伯氏属、预研菌属、草螺菌属、枝动杆菌属等。孙建国[25]从小麦、水稻等作物中分离获得内生固氮菌有假单胞菌属、根瘤菌属、芽孢杆菌属、黄杆菌属、肠杆菌属、伯克霍尔德属和克雷伯氏属等。这表明不同植物内生固氮菌具有生物多样性,以及种群组成存在差异性,这可能与分离方法、分离季节以及许多环境因子等多因素相关。
近年来国内外关于内生菌对农作物的应用研究很多,许明双等[26]从水稻种子中分离得到一株柠檬色短小杆菌对水稻种子的萌发和幼苗促生有明显效果。尹坤等[27]从岑溪野生稻分离到一株变栖克雷伯氏菌有效促进水稻的萌发和生长。Sang等[28]从韩国水稻分离的内生固氮菌有较好的产生长素、产铁载体和溶磷能力,也能明显促进水稻生长,提高水稻的高度和干重。王志刚等[29]分离到一株溶磷菌对西瓜幼苗根系具有良好的促生作用。韩坤等[30]从盐生植物海滨锦葵块根中分离得到5株具有ACC脱氨酶活性的内生细菌均能提高小麦幼苗的耐盐性。鲁红学等[31]从开花期茄子根茎中分离得到一株内生枯草芽孢杆菌,不仅能促进茄子种子萌发、幼苗根系生长,还能对茄子黄萎病有很好的生防效果。本研究获得的固氮菌株都有ACC脱氨酶活性和产生长素能力,有两个类群对无机磷酸钙有良好的溶解作用,尤其是菌株HU31产生长素能力最高达到(69.4±4.6)μg/mL,固氮酶活性最高达到1 036.7 nmol/(mL·h)、ACC脱氨酶活性最高达到205.3 nmol/(mg·h)、溶磷能力最强达到(105.4±6.9)μg/mL、具有产铁载体的能力等众多植物促生菌的特性,该菌株在农业生产中具有一定的应用前景。
4 结论本研究从药用野生稻中获得的5个类群34株内生固氮菌,结果表明野生稻内生固氮菌具有遗传多样性,而且所获得的菌株都有良好的促生菌特性,为微生物肥料生产提供了菌种资源。一般情况下,16S rRNA基因序列同源性低于97%,则可认为属于不同种,同源性低于95%,则可认为属于不同属[32]。本研究中,被测菌株类群Ⅰ的16S rRNA基因序列与GenBank中无乳固氮螺菌(Azospirillum amazonense ATCC35119T)相似性为97.13%,因此,类群Ⅰ很可能代表一个新种或新属,有待进一步研究。
| [1] | 刘蕊, 张欢欢, 陈志雄, 等. 筛选和转化药用野生稻TAC克隆获得耐旱水稻[J]. 中国农业科学, 2014, (8): 1445–1457. |
| [2] | 杨慧, 刘立晶, 刘忠军, 等. 我国农田化肥施用现状分析及建议[J]. 农机化研究, 2014, (9): 260–265. |
| [3] | 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, (2): 349–363. |
| [4] | 安千里, 李久蒂. 植物内生固氮菌[J]. 植物生理学通讯, 1999, (4): 265–272. |
| [5] | 孙苗苗, 刁治民, 王恒生. 禾草内生固氮菌的研究现状及应用前景[J]. 青海草业, 2013, (1): 35–42. |
| [6] | Glick BR, Penrose DM, Li JP. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria[J]. Journal of Theoretical Biology, 1998, 190(1): 63–68. |
| [7] | 王桂文, 李海鹰, 范嘉晔. 甘蔗内生固氮菌研究[J]. 广西农业生物科学, 2000, (1): 68–72. |
| [8] | 田方, 丁延芹, 朱辉, 等. 烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理[J]. 微生物学报, 2008, (5): 631–637. |
| [9] | 张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻(Oryza rufipogon)内生菌的固氮及溶磷特性[J]. 应用与环境生物学报, 2006, (4): 457–460. |
| [10] | 原红娟, 严慧, 杨芳, 等. 澳洲野生稻(Oryza australiensis)内生固氮菌的分子鉴定及发育分析[J]. 应用与环境生物学报, 2014, (4): 571–577. |
| [11] | 谭志远, 傅琴梅, 彭桂香, 等. 青香茅和五节芒内生固氮菌的分离与生理生化鉴定[J]. 应用与环境生物学报, 2013, (4): 643–649. |
| [12] | 李倍金, 罗明, 周俊, 等. 几种禾草内生固氮菌的分离及固氮活性测定[J]. 草业学报, 2008, (5): 37–42. |
| [13] | 毕江涛, 贺达汉, 谢瑞梅, 等. 沙冬青根瘤菌固氮酶基因nifH PCR-RFLP分析[J]. 西北农业学报, 2009, (3): 315–321. |
| [14] | 王华荣, 彭桂香, 张国霞, 等. 糖蜜草(Melinis minutiflora Beauv. )内生固氮菌分离鉴定[J]. 生态学报, 2006, (8): 2566–2571. |
| [15] | Zehr JP, Mcreynolds LA. Use of degenerate oligonucleotides for amplification of the nifH gene from the marine cyanobacterium Trichodesmium thiebautii[J]. Applied and Environmental Microbiology, 1989, 55(10): 2522–2526. |
| [16] | 何绍江, 赵斌. 微生物学实验教程[M]. 北京: 高等教育出版社, 2013. |
| [17] | 叶震. 东祁连山高寒草地土壤优良解磷细菌的研究[D]. 兰州:甘肃农业大学, 2010. |
| [18] | Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793–796. |
| [19] | Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10–15. |
| [20] | 朱玉贤, 李毅, 郑晓峰, 等. 现代分子生物学[M]. 北京: 高等教育出版社, 2013. |
| [21] | Hassan JC, Peng GX, Hu M, et al. Genetic diversity of endophytic diazotrophs of the wild rice, Oryza alta and identification of the New Diazotroph, Acinetobacter oryzae sp. nov[J]. Microbial Ecology, 2012, 63(4): 813–821. |
| [22] | 张国霞, 关颖, 蒋云霞, 等. 石油降解菌的分子鉴定及降解能力研究[J]. 生态科学, 2015, 34(2): 51–56. |
| [23] | 阳洁, 尹坤, 谭习羽, 等. 陈皮中微生物的分离与鉴定[J]. 微生物学报, 2015, 55(6): 700–706. |
| [24] | 邢颖, 张莘, 郝志鹏, 等. 烟草内生菌资源及其应用研究进展[J]. 微生物学通报, 2015, 45(2): 411–419. |
| [25] | 孙建光, 罗琼, 高淼, 等. 小麦、水稻、玉米、白菜、芹菜内生固氮菌及其系统发育[J]. 中国农业科学, 2012, 45(7): 1303–1317. |
| [26] | 许明双, 生吉萍, 郭顺堂, 等. 水稻内生菌K12G2菌株的鉴定及其促生特性研究[J]. 中国农学通报, 2014, 30(9): 66–70. |
| [27] | 尹坤, 阳洁, 顾文杰, 等. 岑溪药用野生稻高效内生固氮菌分离及促生特性[J]. 微生物学通报, 2015, 42(8): 1482–1491. |
| [28] | Sang HJ, Mayank AG, Se-Chul C. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars[J]. Microbiological Research, 2014, 169(1): 83–98. |
| [29] | 王志刚, 胡云龙, 徐伟慧, 等. 一株溶磷菌的分离鉴定及对西瓜根系的促生效应[J]. 浙江农业学报, 2015, 27(5): 798–803. |
| [30] | 韩坤, 田曾元, 刘珂, 等. 具有ACC脱氨酶活性的海滨锦葵(Kosteletzkya pentacarpos)内生细菌对小麦耐盐性的影响[J]. 植物生理学报, 2015, 51(2): 212–220. |
| [31] | 鲁红学, 杨廷宪, 杨佩, 等. 内生枯草芽孢杆菌QZ-8对茄子的抗病促生作用[J]. 湖北农业科学, 2013, 52(21): 5199–5202. |
| [32] | 郝建华, 郑媛, 孙谧. 一株产溶菌酶海洋细菌S的鉴定及抑菌效果研究[J]. 食品科技, 2013, 38(6): 7–11. |