2. 上海海洋大学水产与生命学院,上海 201306
2. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai 201306
神经肽Y(neuropeptide Y,NPY)是一种含36个氨基酸的单链多肽,通过不同的受体将信号传入细胞内发挥生物作用,对脊椎动物的摄食起到重要的促进作用[1]。1982年,Tatemoto等首先从猪脑中提取一种多肽,结构与YY肽(PYY)、胰多肽(YY)相似,具有发卡样的三维结构,所以命名为神经肽Y。研究发现NPY在进化过程中非常保守,人、大鼠、小鼠以及家鸡NPY氨基酸序列完全一样,鱼类神经肽Y与哺乳动物神经肽Y也具有较高的同源性[2]。
NPY是已发现最强有力的摄食刺激因子,饥饿时下丘脑弓状核神经原合成NPY增多,传递给室旁核,作用于饱食中枢,进而刺激进食[3-5]。NPY在鱼类摄食中的研究已有相关报道,例如,金鱼脑室注射NPY可增加摄食量[6];禁食后的金鱼下丘脑有大量的NPY mRNA表达[7]。研究表明,食物缺乏将会使金鱼、银大麻哈鱼和印第安大马哈鱼下丘脑中NPY的mRNA表达含量增加,复投饵后产生相反的影响[6-9]。目前,已有草鱼、鳜鱼、欧洲狼鲈、斑马鱼[10]、鲤鱼、斑点叉尾鮰[11]、虹鳟[12]、褐牙鲆[13]及斜带石斑鱼[14]等的NPY cDNA序列或者NPY基因组序列被克隆。
本研究报道了大口黑鲈北方亚种和佛罗里达亚种NPY基因cDNA的克隆与序列分析,克隆得到两亚种NPY基因的全DNA序列;并采用生物信息学方法对其启动子上的作用元件进行分析,同时对大口黑鲈两亚种NPY基因的差异进行分析,旨在为进一步研究大口黑鲈的NPY基因奠定基础。
1 材料与方法 1.1 材料实验用大口黑鲈佛罗里达亚种和北方亚种成鱼体重约400 g,取自珠江水产研究所肇庆高要养殖基地;Trizol RNA提取试剂盒、RNA PCR Kit(AMV)Ver.3.0、胶回收试剂盒和pMD19-T vectors system 购自TaKaRa公司;RACE试剂盒和Genome Walker Universal Kit购自Clontech公司;DNA提取试剂盒购自天根生化科技有限公司,大肠杆菌DH5α由本实验室保存。
1.2 方法 1.2.1 脑组织总RNA的提取按照TaKaRa公司Trizol试剂盒提供的方法分别提取大口黑鲈北方亚种和佛罗里达亚种脑组织总RNA,并用1%琼脂糖凝胶电泳和分光光度计检测其质量和浓度。
1.2.2 基因组DNA的提取取大口黑鲈北方亚种和佛罗里达亚种背部肌肉30 mg,按照天根生化科技有限公司DNA提取试剂盒的方法进行。
1.2.3 大口黑鲈两亚种NPY基因cDNA序列的扩增和克隆参照GenBank中已登录的大黄鱼(Larimi-chthys crocea)、欧洲鲈(Dicentrarchus labrax)、翘嘴鳜(Siniperca chuatsi )、花鲈(Lateolabrax japonic-us)、褐牙鲆(Paralichthys olivaceus)等鱼的NPY基因的cDNA序列,在同源保守区内设计上游引物p1:5'-AGGGATACCCAGTGAAACCG-3',上游引物p2:5'-AGAGCTGCTGCTGAAGGA-3'和一个下游引物p3:5'-TCTTGACTGTGGAAGCGTGT-3';引物委托广州吉格生物科技有限公司合成,大口黑鲈两亚种NPY基因的cDNA和基因组克隆均使用相同的引物进行相关扩增。反转录过程按照TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒上的步骤进行,反应结束后采用p1和上述试剂盒中提供的下游引物M13 Primer M4:5'-GTTTTCCCAGTCACGAC-3'进行PCR扩增。反应体系为:Primer Star Mix:10 μL,上游引物0.5 μL,下游引物0.5 μL,模板DNA 0.5 μL,ddH2O 8.5 μL。反应程序为:94℃预变性2 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min。反应结束后,用引物p1和p3进行巢式扩增得到开放阅读框(ORF)序列,然后用p2和反转录试剂盒中的oligo dT Adaptor primer进行3'RACE,PCR反应程序同上。PCR产物经胶回收纯化后与pMD19-T载体连接,转化感受态大肠杆菌DH5α,挑选阳性克隆送上海英骏公司测序;使用Vector NTI 10.3软件将上述序列进行拼接得到ORF框和3'非编码区。
1.2.4 NPY基因内含子的扩增和克隆根据已获得的大口黑鲈NPY基因的cDNA序列,参照近源物种NPY基因内含子的位置设计3对引物:F1:5'-GCATTGTTATTTTACGGGTTTGTT-3',R1:5'-AGAGGTAGTCGCCTACTCTGTCTT-3';F2:5'-GGCGCCCTAACGGAGGGATACCC-3',R2:5'-CCTTCAGCAGCAGCTCTGAGACC-3';F3:5'-ATGGAAAGAGGTCTAGTCCTGAG-3',R3:5'-CAATTATACAATACAATCAACATGC-3'。分别以大口黑鲈两亚种基因组DNA为模板进行PCR扩增获取内含子序列;PCR体系同1.2.3中反应体系,反应程序为:94℃ 2 min;94℃ 35 s,57℃ 30 s,72℃ 32 s,共32个循环;72℃延伸10 min。扩增产物经回收后与pMD19-T载体连接并转化到感受态大肠杆菌DH5α,培养后挑选阳性克隆测序。
1.2.5 NPY基因5'侧翼调控区序列的扩增和克隆根据Genome Walker Universal Kit试剂盒的操作步骤,分别使用EcoR V酶切大口黑鲈北方亚种和佛罗里达亚种基因组DNA后,与试剂盒中的接头连接建库。为了扩增5'侧翼调控区序列,按要求进行两次递减PCR,第一次PCR的引物为AP1(试剂盒提供):5'-GTAATACGACTCACTATAGGGC-3'和NPYGSP1:5'-TAGTACTTGGCTAGCTCGTCCGC-3',先进行4个循环94℃ 15 s,72℃ 2 min,再进行30个循环,94℃ 25 s,65℃ 3 min,最后进行一个循环65℃ 10 min。取PCR产物稀释50倍后作为模板,以AP2(试剂盒提供):5'-ACTATAGGGCACGCGT-GGT-3'和NPYGSP2:5'- CAGGAACCCCAGAGTCCC-CAGCC-3'为引物进行巢式扩增,反应程序同1.2.4,PCR扩增产物胶回收纯化后经连接转化,再挑选阳性克隆菌株送生物公司测序。
1.2.6 生物信息学分析将上述获得的序列用Vector NTI软件进行比对拼接,得到大口黑鲈两亚种NPY基因的DNA序列,序列同源性分析采用NCBI数据库BLAST程序。使用Matlnspector在线软件对启动子上的调控元件进行预测。使用MEGA 5.0软件采用NJ法构建NPY的系统进化树。
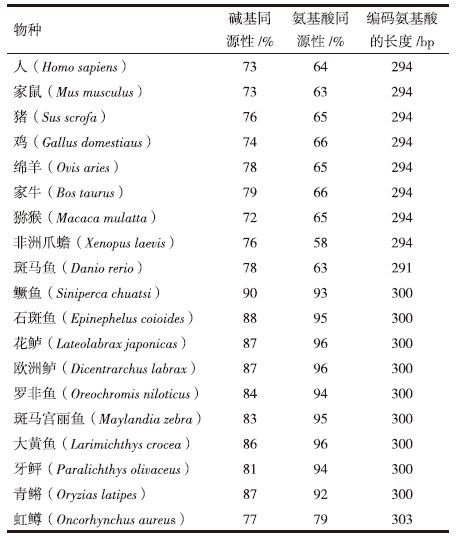
2 结果 2.1 脑组织总RNA的提取将从大口黑鲈两亚种脑部中提取的总RNA进行电泳检测,结果(图 1)显示28S、18S rRNA条带完整,浓度比约为2∶1,说明提取的总RNA完整性较好,符合RT-PCR和RACE-PCR扩增要求。
|
| 图 1 大口黑鲈脑部总RNA 1:北方亚种脑部总RNA;2:佛罗里达亚种脑部总RNA |
将扩增获得核心序列与3'端非编码区片段经Vector NTI软件比对拼接后,分析得到大口黑鲈两亚种NPY的cDNA序列,结果(图 2)表明两亚种NPY cDNA均包括ORF框和长52 bp的5'非编码区(5'-UTR)以及一个3'非编码区(3'-UTR);分析发现大口黑鲈两亚种NPY基因ORF框序列完全相同,长300 bp,编码99个氨基酸,即prepro-NPY。经在线软件预测,NPY前体包括28个氨基酸组成的信号肽、36个氨基酸组成的成熟 NPY以及 32个氨基酸组成的由 Gly-Lys-Arg指示的 NPY C 端肽。cDNA序列中没发现加尾信号(AATAAA),但在距3'-UTR末端13 bp处发现一段序列ATTAAA。

|
| 图 2 大口黑鲈NPY基因cDNA序列及氨基酸序列 划线部分为成熟NPY |
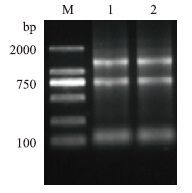
NPY基因的保守性较高,大口黑鲈NPY cDNA与GenBank中其他动物的NPY cDNA相比,Blast结果(表 1)显示与鳜鱼和石斑鱼NPY基因cDNA核苷酸同源性最高,达90%和88%,氨基酸同源性分别为93%和95%,与其他鱼类NPY基因cDNA的同源性为77%-87%,氨基酸的同源性为63%-96%,与两栖类非洲爪蟾的核苷酸同源性为76%,氨基酸同源性为58%,与哺乳动物(人、鼠、猪、鸡、 绵羊、家牛、猕猴)核苷酸同源性达72%-79%,氨基酸同源性为63%-66%。
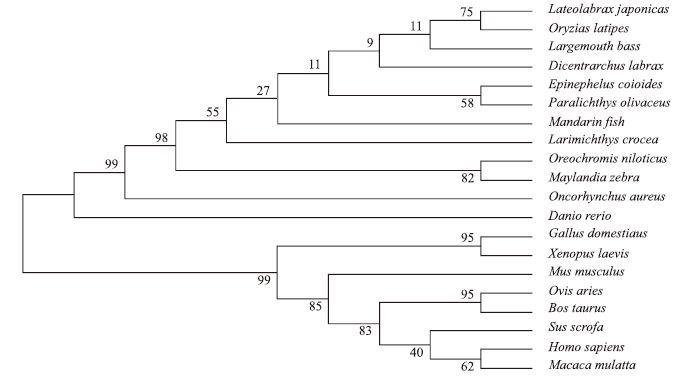
根据大口黑鲈NPY基因的ORF框序列推测的氨基酸序列与其他物种NPY基因编码的氨基酸序列,利用Mega5.0软件以NJ法构建氨基酸进化树。结果(图 3)显示,这20个不同物种分成两个大的分支,一支为鱼类;另一支为哺乳动物和两栖动物。大口黑鲈在鱼类分支中,与同为鲈形目的青鳉鱼和花鲈紧密结合为一个分支,进化树显示与欧洲狼鲈的亲缘关系也较近,这与传统分类学的观点相符。
|
| 图 3 依据不同动物NPY氨基酸序列构建的进化树 |
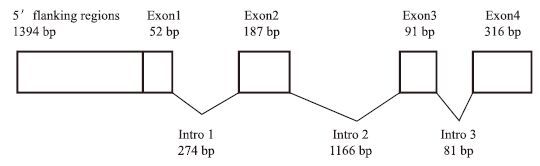
根据所获得的大口黑鲈NPY基因的cDNA序列设计引物扩增NPY基因的内含子,拼接得到大口黑鲈两亚种NPY基因的DNA序列(GenBank登录号分别为KR914669和KR914670),结果(图 4)显示大口黑鲈两亚种NPY基因包括4个外显子和3个内含子。内含子均以GT开始,以AG结束,符合内含子组成的GT-AG法则,其内含子位置与鳜鱼、花鲈等非常相似。与其他脊椎动物一样,大口黑鲈NPY基因的第2个内含子较长,第3个内含子较短(图 5)。
|
| 图 4 大口黑鲈NPY基因结构示意图 |

|
| 图 5 大口黑鲈北方亚种NPY基因序列 外显子用小写英文字母表示,内含子用大写英文字母表示。Oct-1、GATA-box用粗线标出,C/EBP、AP-1、TATA-box、AP-4用粗线加下划线标出,CCAAT-box、CREB、STAT以粗线斜体表示 |
大口黑鲈第1个外显子为一个5'非编码区(5'-UTR)。第2个外显子编码一个完整的信号肽和大部分的NPY主体。第3个外显子包含指示NPY C端肽的G-K-R氨基酸和C-末端将在加工阶段被剪切的氨基酸残基。第4个外显子包扩编码6个属于C侧翼肽段的氨基酸残基的片段以及3'非编码区(3'-UTR)。
大口黑鲈两亚种NPY基因的各外显子和内含子虽然长度相等,但测序结果表明两亚种NPY序列间存在一定的差异,北方亚种NPY基因第一个内含子的69 bp处为碱基G,第2内含子的325 bp处为碱基G,3'非编码区85 bp处为碱基A,而佛罗里达亚种NPY基因对应位置碱基分别为C、A和C。
2.5 大口黑鲈两亚种NPY基因5'侧翼调控区的分析根据特异引物NPYGSP1和NPYGSP2,采用Genome Walker技术扩增了大口黑鲈两亚种NPY基因5'侧翼调控区,测序结果显示获得北方亚种5'端片段1 394 bp,获得佛罗里达亚种5'端片段1 398 bp,其中佛罗里达亚种在距启动子上游814 bp处为碱基T,距启动子上游711 bp处为碱基C,距启动子上游184 bp处为碱基T,而北方亚种对应位置碱基分别为C、T和A;另外,南方亚种距启动子上游174 bp处其后有一GTTT的片段,而北方亚种对应位置则缺失该片段(图 6)。
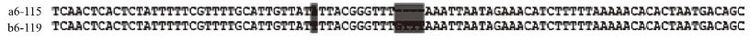
|
| 图 6 大口黑鲈两亚种NPY基因启动子序列差异比较 |
克隆得到的两亚种NPY基因的启动子经在线软件分析,结果(图 5)表明存在的基础转录调控原件有TATA框、AP-1(肌动蛋白)、CCAAT框、GATA框(GATA结合蛋白)、CCAAT蛋白增强因子、八聚体结合因子-1(Oct-1)。另外,在大口黑鲈5'侧翼调控区还发现了cAMP反应元件结合蛋白(cAMP response element binding,CREB),两个与瘦素基因有关元件(STAT binding site)及5个糖皮质激素受体转录元件(GRE)。
3 讨论本研究首次报道了大口黑鲈北方亚种和佛罗里达亚种NPY的DNA序列,实验获得3 561 bp大口黑鲈北方亚种NPY基因的DNA序列和3 565 bp佛罗里达亚种NPY基因的DNA序列;同时克隆获得了大口黑鲈两亚种NPY基因的cDNA序列。序列分析表明两cDNA所编码氨基酸完全一样,这与NPY基因的结构在进化中的高度保守性相符;此外,Blomqvist等[15]研究表明,金鱼与大鼠的蛋白质序列有3个氨基酸不同,电鳗与大鼠的蛋白质序列有5个氨基酸不同,人与鲨鱼亦只有3个氨基酸不同;因此本实验结果中大口黑鲈两亚种NPY编码氨基酸序列完全一致符合该基因氨基酸序列组成特性。与其他物种NPY基因的结构相同,大口黑鲈NPY基因也含有4个外显子以及3个内含子,且起始密码子在外显子2上。
NPY与Y肽(PYY)、胰多肽(PY)序列最大的差别在于它们成熟肽中的第14个氨基酸残基。研究表明除鳟鱼的NPY成熟肽中第14个是苏氨酸残基外,其余都是丙氨酸残基;而PYY和YY一般都是脯氨酸残基[16, 17];本实验结果显示大口黑鲈两亚种NPY成熟肽中第14个为丙氨酸残基。另外,大口黑鲈两亚种NPY基因第2个内含子(1 166 bp)与第3个内含子(78 bp)长度之比为14,鳜鱼NPY基因的该比值也为14,石斑鱼、青鳉鱼、大黄鱼、斑马宫丽鱼等其他鲈形目的鱼该比值也均在4.5-11之间,而在斑马鱼和脊椎动物的NPY基因第2个内含子与第3个内含子长度之比一般小于4[12],提示了大口黑鲈NPY基因的结构与鳜鱼最为接近,这同它们都是鲈形目鱼类相符,同时也说明了大口黑鲈NPY的结构与斑马鱼或人类的不同。
瘦素是一种肽类激素,作为一种饱食信号,可抑制下丘脑弓状核中NPY基因的表达[18, 19],从而引起食欲减退;在大鼠NPY序列中,发现了两个与瘦素基因有关序列(STAT binding site-like element),研究证实这两个结合位点样组件对小鼠NPY基因调控瘦素的翻译与表达、以及神经中枢的调控例如食物的吸收具有关键作用[20, 21]。我们在大口黑鲈两亚种NPY基因的5'侧翼调控区找到了3个瘦素起始结合位点STAT,说明瘦素基因可能在转录水平上调节大口黑鲈NPY基因的表达。研究表明,在虹鳟的视前区[22],皮质醇对CRF及NPY mRNA的表达起调节作用,而CRF mRNA的表达也受到促糖皮质激素受体的调节[23];我们在大口黑鲈NPY的5'侧翼找到5个糖皮质激素受体转录元件GRE,说明通过GRE,糖皮质激素可直接介导NPY的转录,揭示了糖皮质激素对NPY mRNA的表达起调节作用。本实验在大口黑鲈两亚种5'侧翼调控区发现了3个瘦素表达相关元件及5个糖皮质激素受体转录元件,进一步证明了通过瘦素及皮质醇对下丘脑NPY基因的调控可介导鱼类的食欲。
本实验结果表明大口黑鲈两亚种NPY基因序列间存在一定的差异。差异位点处均不直接编码氨基酸,但有可能通过调控基因的前期转录而影响其在两亚种中的表达量。北方亚种启动子1 224 bp处存在一个八聚体结合因子,而佛罗里达亚种该处由于多出一个GTTT的片段,形成了一段叉头蛋白区域,叉头蛋白在胚胎发育、细胞周期调控、糖类和脂类代谢、生物老化和免疫调节等多种生物学过程中发挥作用[24],因此推测大口黑鲈两亚种间NPY基因启动子的该位置突变可能影响到两亚种对于人工饲料的摄食以及利用;大口黑鲈佛罗里达亚种相对于北方亚种更易受外界环境影响,表现出摄食行为较为谨慎,易受惊吓等,推测可能是由于两亚种序列上的部分差异对NPY基因表达量的影响所致。另外,两亚种间NPY基因启动子上长度为4 bp的插入缺失部分经扩大群体验证发现只存在于种间,种内不具多态性,因此该片段的插入缺失具有作为鉴别大口黑鲈两亚种的分子标记的潜在价值。
4 结论本研究采用RT-PCR和RACE技术,克隆了大口黑鲈北方亚种和佛罗里达亚种NPY基因的cDNA序列;并在此基础上,结合基因组步移技术获得了长度分别为3 561 bp和3 565 bp的大口黑鲈北方亚种和佛罗里达亚种NPY基因的DNA序列。序列分析表明大口黑鲈两亚种NPY基因都有4个外显子和3个内含子,两亚种NPY 的DNA序列间存在6处单个碱基差异,与大口黑鲈北方亚种相比佛罗里达亚种启动子区域出现了一段长4 bp的插入。
| [1] | Larhammar D. Evolution of neuropeptide Y, peptide YY and pancreatic polypeptide[J]. Regulatory Peptides, 1996, 62(1): 1–11. |
| [2] | Jessica EM, Jansen M, Lyerly D, et al. Pharmacological characterization and selectivity of the NPY antagonist GR231118(1229U91)for different NPY receptors[J]. Regulatory Peptides, 1997, 72: 114–119. |
| [3] | Parker E, Van Heek M, Stamford A. Neuropeptide Y receptors as targets for anti-obesity drug development:perspective and current status[J]. Europe Jounal Pharmacol, 2002, 440(2-3): 173. |
| [4] | 郭秀兰, 王康宁, 唐仁勇. 神经肽Y的促摄食作用及其调控[J]. 中国畜牧兽医, 2005, (4): 6–9. |
| [5] | 田秀灵. 神经肤Y及其食欲促进作用[J]. 国外医学卫生学分册, 2003, (3): 134–137. |
| [6] | Lopez-Patino AI, Guijarro AI, et al. Neuropeptide Y has a stimulatory action on feeding behavior in goldfish(carassius auratus)[J]. European Jounal of Pharmacology, 1999, 377: 147–153. |
| [7] | Narnaware YK, Peter RE. Effects of food deprivation and refeeding on neuropeptide Y(NPY)mRNA levels in goldfish[J]. Comparative Biochemistry and Physiology, 2001, 129: 633–637. |
| [8] | Silverstein JT, Breininger J, Baskin DG, et al. Neuropeptide Y-like gene expression in the salmon brain increases with fasting[J]. General and Comparative Endocrinology, 1998, 110: 157–165. |
| [9] | Silverstein JT, Shearer K, et al. Regulation of nutrient intake and energy balance in salm[J]. Aquaculture, 1999, 177: 161–169. |
| [10] | Soderberg C, Wraith A, Ringvall M, et al. Zebrafish genes for neuropeptide Y and peptide YY reveal origin by chromosome duplication from an ancestral gene linked to the homeobox cluster[J]. Journal of Neurochemistry, 2000, 75(3): 908–918. |
| [11] | Leonard JB, Waldbieser GC, Silverstein JT. Neuropeptide Y seque-nce and messenger RNA distribution in channel catfish(Ictalurus punctatus)[J]. Marine Biotechnology, 2001, 3(2): 111–118. |
| [12] | Doyon C, Gilmour KM, Trudeau VL, et al. Corticotropin-releasing factor and neuropeptide Y mRNA levels are elevated in the preoptic area of socially subordinate rainbow trout[J]. General and Comparative Endocrinology, 2003, 133(2): 260–271. |
| [13] | Kurokawa T, Suzuki T. Development of neuropeptide Y related peptides in the digestive organs during the larval stage of japanese flounder paralichthys olivaceus[J]. General and Comparative Endocrinology, 2002, 126(1): 30–38. |
| [14] | Chen R, Li W, Lin H. cDNA cloning and mRNA expression of neuropeptide y of orange spotted grouper(Epinephelus coioides)[J]. Comparative Biochemistry and Physiology, 2005, 142(1): 79–89. |
| [15] | Blomqvist AG, Soderberg C, Lundell I, et al. Strong evolutionary conservation of neuropeptide Y:Sequences of chicken, goldfish, and Torpedo marmorata DNA clones[J]. Proceedings of the National Academy of Science, 1992, 3(89): 2350–2354. |
| [16] | Larhammar D, Blomqvist AG, Soderberga C. Evolution of neuropeptide Y and its related peptides[J]. Comparative Biochemistry and Physiology, 1993, 106(3): 743–752. |
| [17] | Cerda-Reverter JM, Martínez-Rodríguez G, Zanuy S, et al. Molecu-lar evolution of the neuropeptide Y(PY)family of peptides:clo-ning of three NPY-related peptides from the sea bass(Dicentrarchus labrax)[J]. Regulatory Peptides, 2000, 95: 25–34. |
| [18] | Morishita T, Hidaka T, Sugasara T, et al. Leptin changes Ca2+/calmodulin-dependent response and up-regulates the gene expression of calcineurin in rat hypothalamus[J]. Life Science, 1998, 63: 311–315. |
| [19] | Dryden S, King P, Pcikavance L, et al. Divergent effects of intracerebroventricular and peripheral leptin administration on feeding and hypothalamic neuropeptide Y in lean and obese(fa/fa)Zucker rats[J]. Clinicl Science, 1999, 96: 307–312. |
| [20] | Muraoko O, Xu B, Tsurumaki T, et al. Leptin-induced transactivation of NPY gene promoter mediated by JAKI, JAK2 and STAT3 in the neural cell lines[J]. Neurochemistry International, 2003, 42: 591–601. |
| [21] | Higuchi H, Hasegawa A, Yamaguchi T. Transcriptional regulation of neuronal genes and its effect on neural functions:transcriptional regulation of neuropeptide y gene by leptin and its effect on feeding[J]. Journal of Pharmacological Sciences, 2005, 98(3): 225–231. |
| [22] | Doyon C, Jason L, Vance LT, et al. Corticotropin-releasing factor and neuropeptide Y mRNA levels aremodified by glucocorticoids in rainbow trout Oncorhynchus mykiss[J]. General and Comparative Endocrinology, 2006, 146(2): 126–135. |
| [23] | Bernier NJ, Lin X, Peter RE. Differential expression of corticotropin-releasing factor(CRF)and Urotensin I precursor genes, and evidence of CRF gene expression regulated by Cortisol in Goldfish Brain[J]. General and Comparative Endocrinology, 1999, 116(3): 461–477. |
| [24] | 曹冬梅.卢建. 叉头框(Fox)转录因子家族的结构与功能[J]. 生命科学, 2006, 10(18): 491–496. |