骨骼肌发育的负调控因子肌生成抑制素(myostatin,MSTN)基因突变,是产生双肌表型动物主要原因之一。双肌牛即MSTN基因突变造成,加之MSTN基因敲除“超级鼠”的成功,为改造MSTN基因增加肌肉产量提供了现实可行性。
在许多动物如牛、猪、鸡、斑马鱼和绵羊中都检测到MSTN的存在。Ostbye证实[1],在大西洋鲑鱼的很多器官中都检测到了MSTN的表达,并且MSTN基因表达受发育时间调控。Hosoyama等[2]报道MSTN在血清中也有一定的表达,且表达量随年龄的增加而下降,对动物出生早期的肌肉生长起负调节作用。欧阳红生等[3, 4]成功对猪的肌肉中MSTN进行表达载体的构建以及转录水平的检测。本小组[5]对绵羊MSTN基因进行了原核表达研究。家畜肌肉生长性状是多基因座控制的,传统选育法对家畜遗传改良的进程相对缓慢,而利用现代分子生物学技术,对控制数量性状的主效基因加以改造,可以快速定向改良家畜的生产性状,因而被大多数研究小组所采用。Huang等[6]成功的用锌指核酶敲除了MSTN基因的外显子1。Hu等[7]利用RNA干扰技术使MSTN沉默,所生产的转基因绵羊肌纤维直径比野生型要粗。Arounlent等[8]检测表明MSTN抑制剂能够增加成年小鼠的肌肉量和肌纤维量,但并不能增加骨密度和强度。Boman等[9]观察了MSTN突变后的Norwegian白羊发现,2种突变都造成了肌肉量明显增加和脂肪量的下降。
本研究旨在构建新疆南部地方品种绵羊(平原型和田羊、山区型和田羊、卡拉库尔羊与多浪羊)MSTN基因与EGFP的融合表达载体,对其MSTN基因进行真核表达,探索不同品种绵羊MSTN基因的差异与蛋白表达的差异与各品种产肉量之间的关联,为抑制MSTN基因的功能,提高地方品种绵羊的产肉量奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 试验材料平原型和田羊(HP)采自和田地区洛浦县,山区型和田羊(HS)采自和田地区策勒县,卡拉库尔羊(KL)采自新疆生产建设兵团农一师十三团,多浪羊(DL)采自喀什地区莎车县。
1.1.2 菌株与细胞新疆南部地方品种绵羊的MSTN质粒由本小组制备。CHO细胞由华中科技大学医学院基础医学教研室田代石博士惠赠。
1.1.3 主要试剂逆转录酶M-MLV为TaKaRa公司产品;Trizol、DNA胶回收试剂盒、内切酶Xho Ⅰ、Pst Ⅰ、T4 DNA连接酶均为宝生物工程(大连)有限公司产品;Ex Taq DNA聚合酶为上海生工生物工程技术服务有限公司产品;脂质体转染试剂LipofectamineTM 2000购自Invitrogen公司;胎牛血清购自杭州四季青工程材料有限公司,DMEM培养液和 HEPES购自GIBCO公司;G418、多聚Lys和琼脂糖购自MERCK公司;DMSO和胰酶购自Sigma公司;其他相关试剂均为国产分析纯。
1.2 方法 1.2.1 新疆南部地方品种绵羊MSTN基因的克隆 1.2.1.1 绵羊肌肉总RNA 的提取 将和田羊(HP、HS)、卡拉库尔羊与多浪羊臀部局部麻醉后,取约0.5 cm2的肌肉于冻存管中,保存在液氮中备用。缝合伤口并上消炎药直至痊愈。取50 mg左右用Trizol法提取总RNA。
1.2.1.2 设计引物根据GenBank中登录号为No. NM-001009428.1的绵羊MSTN基因序列设计引物。上游引物序列为008F:5'-CCGCTCGAGATGCAAAAA-CTGCAAATCT-3',下游引物序列为 008R:5'-AAC-TGCAGTGAGCACCCACAGCGATCTAC-3',预期扩增片段大小为1 125 bp。
1.2.1.3 扩增MSTN基因将4种地方品种(品系)绵羊肌肉组织总RNA 逆转录成 cDNA,再进行PCR 扩增MSTN。PCR体系为25 μL:其中cDNA 2 μL,上、下游引物各 0.5 μL,2.5 mmol/μL dNTP 2 μL,Ex Taq DNA 聚合酶(5 U/μL)0.1 μL,10×buffer 2.5 μL,ddH2O 18.9 μL。PCR过程为:94℃预热11.5 min;94℃变性45 s,55℃退火45 s,72℃延伸60 s,35个循环;最后72℃延伸10 min。用1%琼脂糖凝胶电泳检测目的条带。
1.2.1.4 重组质粒的鉴定及序列分析回收MSTN 目的片段的PCR产物,与pMD18-T 载体 16℃连接过夜,转化入感受态E. coli DH5α细胞中,37℃恒温培养箱过夜培养。对阳性质粒pMD18-T-MSTN(HS、HP、KL、DL)采用PCR、双酶切鉴定、测序后,利用DNA Star软件分析MSTN基因序列。
1.2.2 新疆南部地方品种绵羊真核表达质粒pEGFP-N1-MSTN 的构建及鉴定
1.2.2.1 构建绵羊真核表达重组质粒pEGFP-N1-MSTN 提取pMD18-T-MSTN(HP、HS、KL和DL)重组质粒,采用限制性内切酶Xho Ⅰ 和 Pst Ⅰ分别对pMD18-T-MSTN和pEGFP-N1进行双酶切,回收绵羊MSTN及pEGFP-N1空载体,用T4 DNA 连接酶16℃连接过夜,构建pEGFP-N1-MSTN(HS、HP、KL和DL)重组质粒。
1.2.2.2 重组质粒的PCR、酶切鉴定及序列分析将重组质粒pEGFP-N1-MSTN(HS、HP、KL和DL)转化大肠杆菌DH5α感受态细胞,将阳性重组质粒进行PCR、双酶切鉴定及测序分析。
1.2.3 新疆南部地方品种绵羊MSTN基因在CHO中表达 1.2.3.1 CHO细胞的准备将冻存的CHO细胞放入含双抗和10%胎牛血清的DMEM培养液中,在5% CO2的培养箱中37℃培养活化,当贴壁CHO细胞铺满时,进行传代培养。
1.2.3.2 pEGFP-N1-MSTN重组质粒转染CHO细胞将CHO细胞用0.25%(W/V)胰酶消化后置于含10%胎牛血清DMEM 培养液中培养(约6×104 个),在细胞铺满70%-80%时转染。将0.8-1.0 μg pEGFP-N1-MSTN重组质粒用100 μL加双抗的无血清DMEM培养液稀释,同时稀释转染试剂脂质体2-5 μL,在5 min内将重组质粒与脂质体稀释液混合,室温下放置孵育大约15 min后,加入含10%胎牛血清DMEM培养液,将该混合物稀释至总体积为1 mL/管,加入到准备好的CHO细胞中,转染后的细胞在5%的CO2培养箱中37℃保温5 h后,再加入适量的含10%胎牛血清的DMEM培养液继续培养。
1.2.3.3 MSTN基因的真核表达检测每隔12 h,将转染后的CHO细胞置于倒置荧光显微镜下,观察pEGFP-Nl-MSTN(HP、HS、KL和DL)质粒转染组与CHO空白对照中绿色荧光蛋白的表达情况。
2 结果 2.1 RT-PCR扩增新疆南部地方品种绵羊MSTN基因以从绵羊肌肉提取的总RNA为模板,逆转录获得cDNA后,以008F和008R为引物,PCR扩增MSTN编码基因序列,获得1 125 bp 的片段,大小与预期结果相符(图 1)。
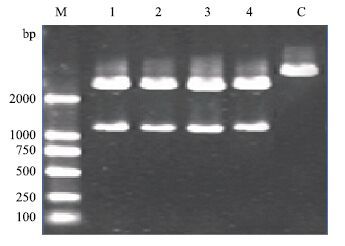
|
| 图 1 新疆南部地方品种绵羊MSTN编码序列RT-PCR扩增图 M:DL2000 DNA marker;1:和田羊山区型;2:和田羊平原型;3:卡拉库尔羊;4:多浪羊;C:阴性对照 |
回收和田羊(HP和HS)、卡拉库尔羊及多浪羊MSTN目的片段与pMD18-T载体连接构建重组质粒。提取pMD18-T-MSTN(HP、HS、KL和DL)重组质粒进行PCR鉴定,在1 125 bp处有目的片段,条带大小与理论相符(图 2)。
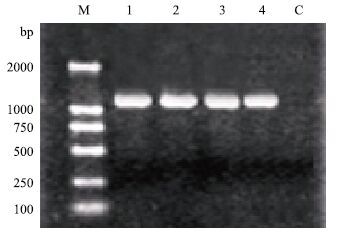
|
| 图 2 新疆南部地方品种绵羊MSTN重组质粒 PCR鉴定图 M:DL2000 DNA marker;1:和田羊山区型;2:和田羊平原型;3:卡拉库尔羊;4:多浪羊;C:阴性对照 |
选取pMD18-T-MSTN(HS、HP、KL和DL)重组质粒进行双酶切(Xho Ⅰ 和 Pst Ⅰ)鉴定,经检测在凝胶成像系统的紫外光下分别有一条2 700 bp左右的片段和一条1 125 bp的片段,pMD18-T载体的大小和MSTN目的片段的大小都符合理论分子量大小(图 3)。显示构建重组质粒成功。
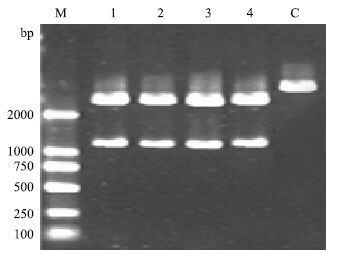
|
| 图 3 新疆南部地方品种绵羊MSTN编码序列重组质粒酶切鉴定 M:DL2000 DNA marker;1:和田羊山区型;2:和田羊平原型;3:卡拉库尔羊;4:多浪羊;C:空载体 |
新疆南部4个地方品种(品系)绵羊的MSTN基因与GenBank中序列(NM_001009428)比对分析结果(省略相同部分,只罗列有差异部分片段)(图 4)。表明,新疆南部4个地方品种绵羊骨骼肌MSTN基因的开放阅读框均由1 125 bp组成(不含终止密码子TGA)。山区型和田羊与平原型和田羊的MSTN与GenBank中的新西兰罗姆尼羊的序列同源性为100%。卡拉库尔羊与罗姆尼羊的序列同源性为99.82%,只有2 处碱基不同,即第412 位碱基由T 突变为A,第883 位碱基由T 突变为A。多浪羊与罗姆尼羊MSTN基因同源性为99.47%,共有6处碱基有差异,分别是188 bp(A突变为G)、215 bp(T突变为C)、294 bp(A突变为G)、495 bp(T突变为C)、832 bp(G突变为A)、891 bp(G突变为T)处。
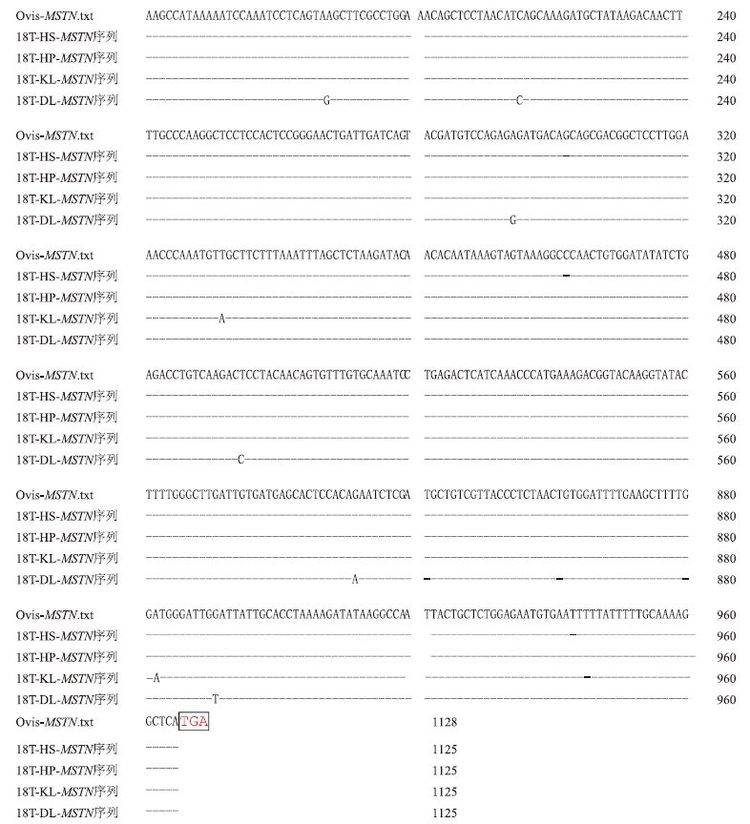
|
| 图 4 新疆南部地方品种绵羊MSTN成熟蛋白编码序列比对结果 18T-HS:山区型和田羊;18T-HP:平原型和田羊;18T-KL:卡拉库尔羊;18T-DL:多浪羊 |
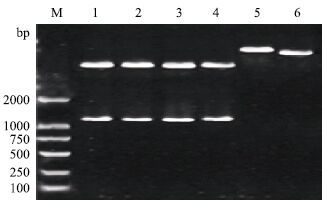
将重组质粒pMD18T-HS-MSTN、pMD18T-HP-MSTN、pMD18T-KL-MSTN、pMD18T-DL-MSTN以及pEGFP-N1载体用Xho Ⅰ和Pst Ⅰ双酶切,出现了预期为1 125 bp的目的条带,pEGFP-N1大小约为4 700 bp(图 5)。
|
| 图 5 南疆地方品种绵羊重组质粒与真核表达载体双酶切图 M:DL2000 DNA marker;1:山区型和田羊;2:平原型和田羊;3:卡拉库尔羊;4:多浪羊;5:pEGFP-N1对照;6:酶切pEGFP-N1 |
回收目的片段及空载体,将两者连接构建重组真核表达质粒pEGFP-N1-MSTN(HP、HS、KL和DL),接着进行PCR、双酶切(Xho Ⅰ和Pst Ⅰ)鉴定。在设计引物时,去除MSTN基因的终止密码子,并在酶切位点前加入碱基使其读码框与下游EGFP基因的读码框一致。
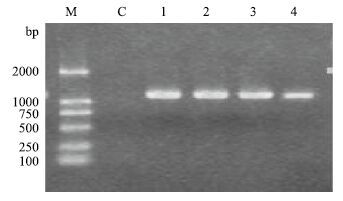
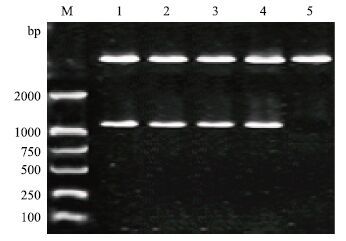
对新疆南部4个地方品种(品系)绵羊MSTN成熟蛋白编码序列真核表达重组质粒进行PCR鉴定,在1 125 bp处有特异条带,如图 6所示。用Xho Ⅰ和Pst Ⅰ双酶切重组真核表达质粒,酶切鉴定结果,见图 7。
|
| 图 6 新疆南部地方品种绵羊pEGFP-N1-MSTN 的PCR鉴定 M:DL2000 DNA marker;C:阴性对照;1:山区型和田羊;2:平原型和田羊;3:卡拉库尔羊;4:多浪羊 |
|
| 图 7 新疆南部地方品种绵羊pEGFP-N1-MSTN的双酶切鉴定 M:DL2000 DNA marker;1:山区型和田羊;2:平原型和田羊;3:卡拉库尔羊;4:多浪羊;5:pEGFP-N1 |
双酶切鉴定结果在4 700 bp处和1 125 bp处分别有融合表达载体pEGFP-N1和目的片段绵羊MSTN的特异条带,表明新疆4个地方品种(品系)绵羊(HP、HS、KL和DL)的MSTN已成功插入融合表达载体pEGFP-N1中,真核表达重组质粒pEGFP-N1-MSTN构建成功,可以将重组质粒转染到CHO细胞中进行真核表达。
2.5 重组真核表达质粒测序鉴定将鉴定阳性的pEGFP-Nl-MSTN(HP、HS、KL和DL)质粒送公司测序。测序结果显示,MSTN基因序列正确,且位于EGFP之前,连接方向及读码框均正确。
将其与 GenBank 中新西兰罗姆尼羊的MSTN成熟蛋白序列比较,几个品种具有很高的同源性。4个新疆地方品种(品系)的绵羊MSTN成熟蛋白同样也编码375个氨基酸,推测几个品种(品系)MSTN成熟蛋白的氨基酸序列并进行比对。结果(图 8)显示:山区型和田羊与平原型和田羊的MSTN氨基酸序列与GenBank中新西兰罗姆尼羊的同源性达到100%;卡拉库尔羊与罗姆尼羊的MSTN氨基酸序列同源性为99.47%,其2处碱基差异均导致2处的氨基酸序列发生改变,即138位由Cys变为Ser,295位Trp改变为Arg;多浪羊与罗姆尼羊的MSTN同源性为98.93%,多浪羊MSTN 的6处碱基差异中,有2处(第98、165位)为简并密码并没有导致氨基酸的改变,其余4处导致了氨基酸的改变,即63位由Arg改变为Lys,72位由Ile改变为Thr,278位由Glu变为Lys,297位由Trp改变为Cys。

|
| 图 8 新疆南部地方品种绵羊MSTN成熟蛋白氨基酸序列比对结果 18T-HS-MSTN氨基酸序列:山区型和田羊;18T-HP-MSTN氨基酸序列:平原型和田羊;18T-KL-MSTN氨基酸序列:卡拉库尔羊;18T-DL-MSTN氨基酸序列:多浪羊 |
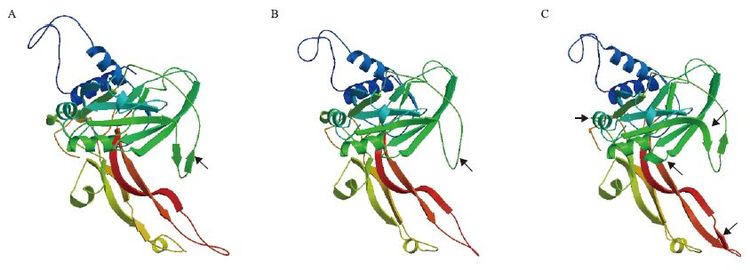
将新疆4个地方品种(品系)绵羊的MSTN利用SWISS-MODEL在线软件分析其蛋白三维空间结构,结果如图 9所示。
|
| 图 9 南疆地方品种绵羊MSTN成熟蛋白三维结构比对结果 A:山区型、平原型和田羊;B:卡拉库尔羊;C:多浪羊 |
对于新疆4个品种绵羊的MSTN成熟蛋白三维结构分析表明:平原型、山区型和田羊的三维结构与罗姆尼羊的一致;卡拉库尔羊的三维结构由于2个碱基的差异造成2个氨基酸的改变,所以在图 9-B图箭头所指部位的结构已经与图 9-A图有所不同,在图 9-A图中的两个短的反平行β-折叠片,在图 9-B图中变成了无规则卷曲;多浪羊由于6个碱基的差异造成了4处氨基酸的改变,所以在图 9-C图箭头所指部位的结构也与图 9-A和图 9-B有所不同,约有4个部位发生了结构变化,主要表现在多浪羊(图 9-C)中2处箭头所指处β-折叠片的长度比较长一些,而在和田羊(图 9-A)中和卡拉库尔羊(图 9-B)中都是无规则卷曲;多浪羊(图 9-C)中1处β-转角消失,同时1处又出现不完全α-螺旋。
2.7 绵羊MSTN重组质粒在CHO细胞中的融合表达将新疆4个地方品种(品系)绵羊的MSTN真核表达重组质粒pEGFP-Nl-MSTN(HP、HS、KL、DL)分别转染CHO细胞,EGPF将与MSTN融合表达使CHO细胞呈现绿色荧光。在重组质粒转染细胞24 h后,只有少量细胞中表达MSTN,随转染时间的延长,绿色荧光的细胞数目逐渐增加。在重组质粒转染细胞48 h后,将细胞放在荧光显微镜下观察,结果大约60%-70%的细胞发出明亮的绿色荧光,并且主要集中在细胞质内,阴性对照组细胞没有表达,阳性样本组表达量都比较高,结果(图 10)显示,重组质粒pEGFP-N1-MSTN 能够在CHO细胞中表达。
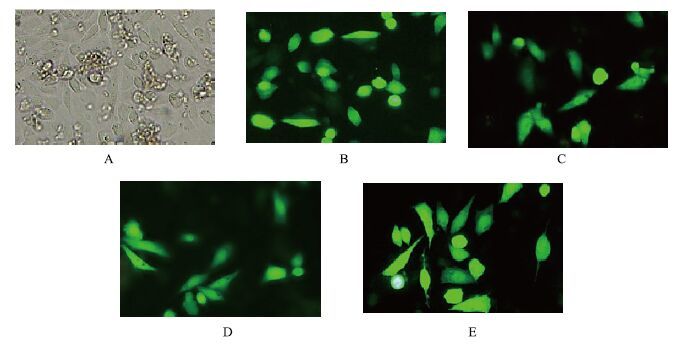
|
| 图 10 南疆地方品种绵羊pEGFP-N1-MSTN转染48 h后在CHO细胞中的表达 A:CHO 细胞;B:pEGFP-N1-HS-MSTN;C:pEGFP-N1-HP-MSTN;D:pEGFP-N1-KL-MSTN;E:pEGFP-N1-DL-MSTN;放大倍数:10×25 |
构建新疆南部4个地方品种(品系)绵羊(山区型和田羊、平原型和田羊、卡拉库尔羊、多浪羊)的 pMD18-T-MSTN 基因克隆载体,并进行PCR和酶切鉴定。结果表明山区型和田羊、平原型和田羊与GenBank中新西兰罗姆尼羊的MSTN基因编码序列完全一致,但卡拉库尔羊、多浪羊有差异。
新疆4个地方品种(品系)绵羊的MSTN与其他动物一样具有TGF-β家族的特征,都有RSRR(第263-266位)蛋白酶水解位点,并且在C端都有9个Cys残基。据报道,有双肌牛MSTN基因突变自然灭活的现象,即突变造成提前终止密码子的产生,使MSTN基因失去其生物学活性;也有在C端突变造成其活性构像形成障碍而失去生物学活性的现象。新疆4个品种(品系)绵羊的MSTN氨基酸序列分析表明,基因的变异并没有产生提前终止密码子使蛋白失活,但有可能产生第2种情况,即基因变异造成活性构象形成障碍而使蛋白失活的现象。卡拉库尔羊138位由Cys变为Ser,但这个Cys位于N端前肽区,并没有位于9个保守Cys组成的C端功能区,对卡拉库尔羊MSTN生物活性的影响有限。在多浪羊的4个氨基酸差异中,以297位由Trp改变为Cys尤为值得关注,这个变异位于9个保守Cys组成的C端功能区,增加了一个Cys可能会影响成熟蛋白由二硫键连接形成同源二聚体活性构象,从而影响多浪羊MSTN蛋白的生物学活性。以成年公羊体重比较,和田羊(38.95±1.3)kg,卡拉库尔羊(76.9±0.5)kg,多浪羊(98.85±1.77)kg[10],MSTN基因的变异或许是这几种绵羊体重差异的影响因素之一。
对新疆4个品种(品系)绵羊MSTN蛋白三维结构的分析表明,不同品种绵羊MSTN蛋白中个别氨基酸的改变,造成了新疆4个地方品种(品系)绵羊MSTN的三维空间结构某些部位有差异,三维结构的改变是否对其功能有影响,尚有待于进一步研究探讨。
MSTN在不同绵羊品种中间还是比较保守,MSTN基因与蛋白序列比对结果都表明和田羊(山区型、平原型)与新西兰罗姆尼羊同源,都属于毛、肉兼用羊,推测是由于罗姆尼羊与和田羊在育成过程中都导入过边区莱斯特羊血液的缘故。卡拉库尔羊属于黑色羔皮、肉兼用羊,与其亲缘关系远一点。多浪羊属于肉用羊与其亲缘关系更远一些。
已有研究表明,许多与EGFP 融合的蛋白质仍能保留其活性,并且EGFP 能在真核细胞中顺利高效表达,无论在体内还是体外,其均可有效抵御蛋白酶的水解,使全长多肽的合成得以顺利进行。本研究以EGFP 基因为报告基因,检测了MSTN在CHO细胞中的表达,结果表明,EGFP 的融合并不影响MSTN的功能,因此构建的融合质粒及表达的融合蛋白可用于对MSTN的进一步研究。
4 结论和田羊(山区型与平原型)、卡拉库尔羊与多浪羊的编码成熟蛋白MSTN基因序列与GenBank中新西兰罗姆尼羊比较:和田羊与其同源;卡拉库尔羊2个碱基有差异,造成2个氨基酸变异;多浪羊6个碱基有差异,造成4个氨基酸变异。
构建的融合表达重组质粒pEGFP-Nl-MSTN(HP、HS、KL和DL)中的绵羊MSTN基因能够在真核细胞CHO中表达。
| [1] | Ostbye TK, Galloway TF, Nielsen C, et al. The two myostatin genes of Atlantie salmon(Salmo salar)are expressed in a variety of tissues[J]. Eur J Biochem, 2001, 268(20): 5249–5257. |
| [2] | Hosoyama T, Yamanouchi K, Nishihara M. Role of serum myostatin during the Lactation period[J]. J Reprod Dev, 2006, 52(4): 469–478. |
| [3] | 欧阳红生, 孙燕. 猪肌生成抑制素基因的克隆和序列测定[J]. 中国兽医学报, 2001, 21(5): 479–481. |
| [4] | 李树伟, 欧阳红生, 吕文发, 等. 猪肌生成抑制素成熟蛋白编码序列在COS-7细胞中的表达[J].动物医学进展, 2005, 26(9): 59–61. |
| [5] | 姜仁军, 李树伟, 邓芳. 和田羊Myostatin蛋白成熟肽的基因克隆与原核表达研究[J]. 黑龙江畜牧兽医, 2013, (3): 42–46. |
| [6] | Huang XJ, Zhang HX, Wang H, et al. Disruption of the myostatin gene in porcine primary fibroblasts and embryos using zinc-finger nucleases[J]. Mol Cells, 2014, 37(4): 302–306. |
| [7] | Hu S, Ni W, Sai W, et al. Knockdown of myostatin expression by RNAi enhan- ces muscle growth in transgenic sheep[J]. PLoS One, 2013, 8(3): e58521. |
| [8] | Arounleut P, Bialek P, Liang LF, et al. A myostatin inhibitor(propeptide-Fc)increases muscle mass and muscle fiber size in aged mice but does not increase bone density or bone strength[J]. Exp Gerontol, 2013, 48(9): 898–904. |
| [9] | Boman IA, Klemetsdal G, Nafstad O, et al. Impact of two myostatin(MSTN)mutations on weight gain and lamb carcass classification in Norwegian White Sheep(Ovis aries)[J]. Genetics Selec-tion Evolution, 2010, 42: 4. |
| [10] | 刘大同, 崔玉珍, 许宗运, 等. 南疆养羊实用技术[M]. 乌鲁木齐: 新疆大学出版社, 1997. |




