C-Src蛋白酪氨酸激酶(C-Src tyrosine kinase,Csk)是Src激酶家族(SFKs)的成员,为SFKs的负调节蛋白[1]。Csk分子量为51 kD,属于非受体酪氨酸激酶,其N末端有SH3和SH2结构域,C末端含有激酶结构域[2]。目前对于Csk的研究,多集中于Csk对SFKs的作用机制及其在免疫系统中的作用。研究发现,SFKs参与多种重要的生理过程,如细胞生长分化及黏附、蛋白的转录等[3],同时在多种肿瘤如胃癌、非小细胞肺癌、前列腺癌等的发生发展中起到重要作用。据文献[4, 5]报道,通过抑制SFKs可以抑制肺癌的迁移。已有实验表明,作为SFKs的负调节蛋白,Csk可以通过抑制SFKs激酶的磷酸化发挥抑制肿瘤的作用[6, 7]。但Csk如何调控SFKs的具体机制尚不确定。Csk是非受体酪氨酸激酶,需跨膜受体如IGF1受体、EGF受体、T细胞受体[8, 9]或跨膜衔接蛋白如CBP[10]等的帮助完成信号传递。推测Csk发挥功能与其同这些蛋白的相互作用有关。
为获得有生物活性的Csk蛋白,进而研究Csk调控SFKs的分子机制,本研究从HeLa细胞中通过RT-PCR方法获得目的基因,连接到高效真核表达载体pENTER上,构建重组真核表达质粒。将重组质粒转染到293T细胞中进行蛋白表达,并用SDS-PAGE、Western blot、his-pulldown及CO-IP等方法观察和鉴定重组Csk蛋白表达情况和生物活性,旨在为进一步研究Csk蛋白通路及其对SFKs的调控作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株、细胞与载体HeLa、293T细胞由南方医科大学抗体工程研究所保存;TOP10感受态细胞购自TIANGEN天根生化科技(北京)有限公司;pENTER载体购自ViGene Biosciences。
1.1.2 主要试剂胎牛血清(FBS),DMEM培养基购自Gibco公司;RNA提取试剂盒,逆转录酶Reverse Transcriptase M-MLV购自Invitrogen公司;Prime STAR Max酶,限制性内切酶Mlu I,限制性内切酶AsiSⅠ,T4连接酶,DNA Marker DL5000购自TaKaRa公司;割胶回收试剂盒购自TIANGEN天根生化科技(北京)有限公司;质粒小提取试剂盒购自美国OMEGA公司;PolyJet DNA In Vitro Tranfection Reagent 购自Polyplus。兔源Csk、IGF1R抗体,鼠源抗His抗体,兔源GAPDH抗体,羊抗兔IgG-HRP,羊抗鼠IgG-HRP购自Bioworld公司。螯合镍的磁珠购自海狸生物科技有限公司。
1.2 方法 1.2.1 引物设计与合成从GenBank中获取Csk基因序列(NM_004383),根据cDNA中的序列,利用Primer 5.0软件进行引物设计,并在引物上游加入限制性内切酶位点以及保护碱基,上游引物:5'-CGCGATCGCATGTCAGCAATACAGGCCG-3'(下划线部分为AsiSⅠ酶切位点),下游引物:5'-TACGCGTTCAGGTGCAGCTCGTGGGTTT-3'(下划线部分为MluⅠ酶切位点),扩增片段大小为1 367 bp。所有引物由艾基生物公司合成。
1.2.2 获取目的基因Csk用10% FBS的DMEM培养液常规培养HeLa细胞,利用Trizol试剂盒提取细胞总RNA,按照MLV逆转录试剂盒说明书进行逆转录合成cDNA,PCR体系为:cDNA模板5 μL,上、下游引物各1 μL,总体积50 μL。PCR反应条件:98℃ 5 min;98℃ 10 s,65℃ 5 s,72℃ 20 s,34个循环;72℃ 10 min,4℃保存。PCR产物经1.0%琼脂糖凝胶电泳鉴定并使用割胶回收试剂盒回收。
1.2.3 构建重组真核表达载体pENTER-Csk-his将获得的Csk基因片段与pENTER质粒进行Mlu Ⅰ和 AsiSⅠ双酶切12 h,产物分别经1.0%琼脂糖凝胶电泳分离并使用割胶回收试剂盒回收。用T4连接酶在16℃条件下连接Csk基因片段回收产物与pENTER回收产物6 h。连接产物转化TOP10感受态细胞,转化液涂板培养37℃ 16 h,挑取菌落摇菌培养,利用质粒提取试剂盒提取质粒。经Mlu Ⅰ和 AsiSⅠ双酶切鉴定为阳性克隆后,送到艾基生物测序鉴定。
1.2.4 细胞培养与重组质粒转染将293T细胞用含10% FBS的DMEM培养液在37℃,5% CO2条件下培养。当293T细胞生长状态良好后,消化分板,细胞接种到6孔板中,每孔4×105细胞,培养24 h后细胞达到生长期,按照PolyJet DNA In Vitro Tranfection Reagent转染试剂说明书,严格操作进行真核表达质粒转染,每孔转染操作如下,200 μL JetBuffer中加入1 μg pENTER-Csk-his重组质粒,轻柔混合后,按照比例1∶1、1∶2和1∶3分别加入1 μL、2 μL和3 μL PolyJet转染试剂,轻柔混合,静置15 min后,逐滴缓慢加入细胞中,轻轻摇匀,进行转染。转染后4 h更换新的含10%FBS的DMEM培养液,37℃,5% CO2条件下培养48 h。
1.2.5 Westernblot鉴定Csk蛋白在细胞中的表达 分别收集加入1∶1、1∶2和1∶3不同比例的PolyJet转染试剂转染的293T细胞,弃去上清培养基后,每孔使用100 μL SDS-loading buffer直接加入细胞中,收集蛋白样品,沸水中煮15 min,取出14 000 r/min室温离心15 min。经12% SDS-PAGE进行蛋白电泳。用全湿法电转移到0.22 μm的PVDF膜上,配置5%脱脂奶粉室温封闭2 h,去除封闭液后,加入1∶10 000的抗His抗体、1∶1 000的Csk抗体和1∶10 000的内参GAPDH抗体,4℃过夜;次日,去掉一抗后,用TBST工作液洗涤3次,每次10 min,加入1∶10 000的羊抗鼠二抗与1∶10 000的羊抗兔二抗,室温孵育1 h;TBST工作液洗涤4次,每次10 min。使用GENE GNOME SYNGENE BIO IMAGING 仪器进行ECL显影。
1.2.6 间接免疫荧光检测Csk蛋白定位按照上述最佳转染方案,铺板前在六孔板中放入高压灭菌的玻璃片。将六孔板中已转染48 h的转染pENTER-Csk-his的293T和转染了pENTER空载体的293T细胞,用0.01 mol/L,pH7.4的PBS小心清洗3次每次3 min;4%的多聚甲醛固定爬片15 min后用PBS浸洗玻片3次,每次3 min;0.5%Triton X-100(PBS配制)室温通透20 min,之后用PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS;在玻片上滴加血清,室温封闭1 h;吸水纸吸掉封闭液,不洗,每张玻片滴加入1∶2 000稀释的His一抗并放入湿盒,4℃孵育过夜;PBST 浸洗爬片3次,每次3 min,吸水纸吸干爬片上多余液体后滴加1∶10 000稀释的羊抗鼠荧光二抗,湿盒中室温孵育1 h最后再用PBST洗3次,每次3 min。滴加DAPI避光孵育5 min,对标本进行染核,使用PBST洗涤4次每次5 min;用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.2.7 SDS-PAGE鉴定293T细胞表达的重组蛋白Csk将免疫印迹鉴定表达量比较高的样品进行SDS-PAGE蛋白电泳,SDS-PAGE胶进行考马斯亮蓝染色,室温条件下摇床上缓慢染色2 h。用考马斯亮蓝脱色液进行脱色处理至胶上蛋白条带清晰,然后将胶片进行存照。
1.2.8 重组Csk-his蛋白的纯化按照上述转染比例及转染时间,进行10 cm皿转染,分别收集4个转染pENTER-Csk-his和pENTER空载体的293T细胞10 cm皿细胞,用4 mL细胞裂解液进行充分裂解,裂解后与4 mL Bingding Buffer(20 mmol NaH2PO4,0.5 mol NaCl,pH7.4)混合,各加入400 μL用Bingding Buffer 洗涤3次后的镍离子螯合的磁珠,在4℃垂直旋转仪上反应1 h;使用Washing Buffer(20 mmol NaH2PO4,50 mmol咪唑,0.5 mol NaCl,pH7.4)及磁力架进行洗涤,洗涤4次后将磁珠转入新的1.5 mL EP管中,使用400 μL 含有100 mmol 咪唑的Elution Buffer(20 mmol NaH2PO4,100 mmol咪唑,0.5 mol NaCl,pH7.4)洗脱并收集纯化的蛋白,再用含250 mmol咪唑的Elution Buffer洗脱并收集纯化的蛋白。将收集的纯化蛋白进行SDS-PAGE,用考马斯亮蓝进行染色鉴定纯化结果。
1.2.9 His-pulldown及CO-IP检测Csk的活性据文献报道,Csk与IGF1R相互作用[11],与SHC1也有相互作用,为了检测Csk的生物活性,进行his-pull down检测IGF1R,运用CO-IP检测SHC1[12]。
将0、1和2 mg纯化的Csk蛋白(含有his-tag)分别与4×107的293T细胞裂解液混合反应4℃过夜,按照磁珠说明书进行his-pull down试验,将收集的蛋白样品按照1.2.5的步骤进行免疫印迹,其中一抗按照蛋白Marker大小在45-70 kD段孵育1∶1 000的Csk抗体,在70-130 kD处孵育1∶1 000的IGF1R抗体。
按照上述步骤构建pENTER-SHC1-his重组质粒。将细胞分别进行pENTER-Csk-his单转293T、pENTER-Csk-his和pENTER-SHC1-his共转293T,48 h后收集细胞裂解液。用1 mL细胞裂解液进行充分裂解后,10 000×g,4℃离心30 min;取离心后上清各加入2 μg抗Csk的抗体,在4℃垂直旋转仪上反应过夜;每管中加入40 μL用细胞裂解液洗涤5次的proteinG填料,在4℃垂直旋转仪上反应1 h;再次用细胞裂解液将吸附蛋白的填料洗涤5次,转入新的1.5 mL EP管中,离心后去掉上清,向填料内加入50 μL的2×SDS-loading buffer,按照1.2.5的步骤进行免疫印迹,其中一抗为1∶10 000的His-tag抗体。
2 结果 2.1 Csk基因PCR产物的鉴定利用设计的引物以cDNA为模板PCR扩增Csk目的基因全长,PCR产物经1.0%琼脂糖凝胶电泳分析,可见约1 367 bp的特异性单一条带,大小与预期相符(图 1)。
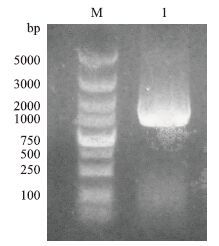
|
| 图 1 Csk基因PCR产物电泳图 M:DNA 分子量标准;1:Csk基因PCR产物 |
将Csk基因克隆进入pENTER载体后,转化感受态TOP细胞,用限制性内切酶对重组质粒进行双酶切鉴定(图 2)。在约1 367 bp和7 510 bp处分别可见Csk基因与pENTER质粒的条带。测序结果比对正确,不存在突变。
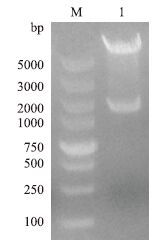
|
| 图 2 重组质粒pENTER-Csk-his的双酶切鉴定结果 M:DNA分子量标准;1:pENTER-Csk-his的双酶切产物 |
收集PolyJet与重组pENTER-Csk-his载体不同比例转染293T 48 h后的细胞,Western blot鉴定结果(图 3-A)显示,转染了重组质粒pENTER-Csk-his的细胞中可见到51 kD左右的带有his标签的目的条带,而转染空载体的对照组细胞中未能检测到特异性条带,表明重组真核表达质粒pENTER-Csk-his在293T细胞中成功表达,使用Csk抗体的Western blot结果(图 3-B)也显示表达的重组蛋白为Csk蛋白。而转染试剂与载体的比例会影响蛋白表达的量,pENTER-Csk-his∶PolyJet为1∶3时,Western blot条带最明显,因此1∶3为最佳转染试剂比例。
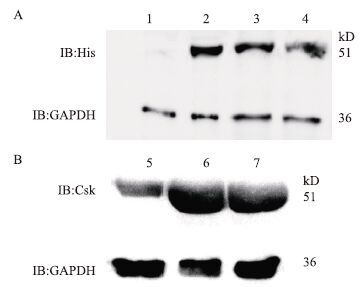
|
| 图 3 Western blot检测转染pENTER-Csk-his的表达情况 1:空细胞293T;2:1 μg pENTER-Csk-his+3 μL转染试剂(1∶3)转染的293T;3:1 μg pENTER-Csk-his+2 μL转染试剂(1∶2)转染的293T;4:1 μg pENTER-Csk-his+1 μL转染试剂(1∶1)转染的293T;5:空细胞293T;6:1 μg pENTER-Csk-his+3 μL转染试剂(1∶3)转染的293T;7:1 μg pENTER-Csk-his+2 μL转染试剂(1∶2)转染的293T |
通过使用his-tag抗体进行间接免疫荧光检测可以定位融合表达的Csk-his在细胞内的位置,结果(图 4)显示Csk-his表达成功且主要在细胞质中表达。
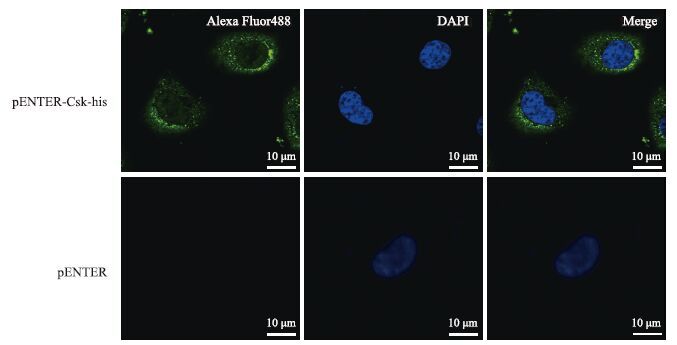
|
| 图 4 Csk蛋白间接免疫荧光检测定位 |
将经Western blot鉴定表达量较高的样品进行SDS-PAGE电泳,经考马斯亮蓝染色、脱色后,可明显看到蛋白表达(图 5-A),说明pENTER-Csk-his重组载体能够在293T中高效表达重组蛋白。使用镍螯合的磁珠进行纯化,纯化后的蛋白样品进行SDS-PAGE电泳,可看到蛋白获得有效纯化(图 5-B)。
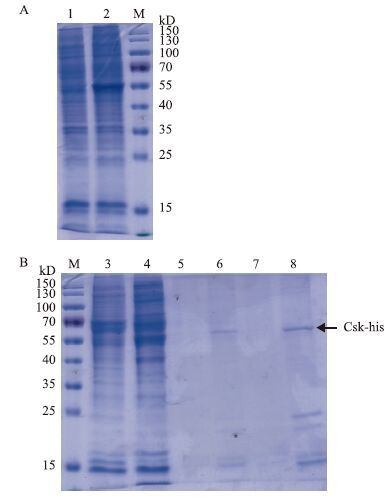
|
| 图 5 考马斯亮蓝染检测转染pENTER-Csk-his的表达(A)及纯化(B)情况 M:Protein Marker;1:空细胞293T;2:1 μg pENTER-Csk-his+3 μL转染试剂(1∶3)转染的293T;3:空细胞293T;4:pENTER-Csk-his转染的293T;5:空细胞样品100 mmol咪唑洗脱的蛋白;6:pENTER-Csk-his转染样品100 mmol咪唑洗脱的蛋白;7:空细胞样品250 mmol咪唑洗脱的蛋白;8:pENTER-Csk-his转染样品250 mmol咪唑洗脱的蛋白 |
将纯化的Csk蛋白(含his标签)与293T细胞裂解液(固有表达IGF1R)共孵育进行his-pull down实验,收获蛋白进行Westblot分析,Csk抗体检测到分子量在45-70 kD段的Csk蛋白,IGF1R抗体检测到分子量在70-130 kD处的IGF1R蛋白,说明重组表达的Csk蛋白能够与细胞裂解液中的IGF1R相互作用(图 6-A)。单转Csk和共转Csk、SHC1的蛋白样品通过使用Csk抗体进行IP后,再使用his-tag抗体进行Western blot(图 6-B)分析,可见共转染组中Csk抗体能够拉下Csk和SHC1两条带,说明细胞共转染的Csk与SHC1能够相互作用。
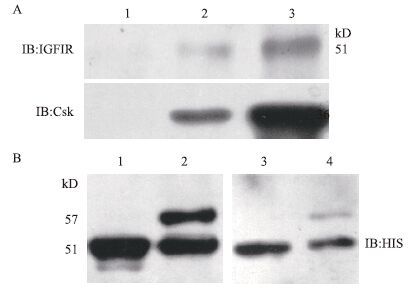
|
| 图 6 Csk生物活性的检测 A:his-pull down检测Csk和IGF1R的相互作用;1:加入0 mg纯化蛋白Csk的空细胞his-pull down;2:加入1 mg纯化蛋白Csk的空细胞his-pull down;3:加入2 mg纯化蛋白的空细胞his-pull down。B:CO-IP检测Csk和SHC1的相互作用;1:转染Csk的细胞裂解液;2:共转染Csk和SHC1的细胞裂解液;3:IP转染Csk样品;4:IP共转染Csk和SHC1样品 |
Src酪氨酸激酶家族与细胞内多条信号传导途径有关,其相关基因参与多种重要的生理过程如生长、分化、黏附、转录[3]以及某些病理过程如肿瘤的EMT[13]等。目前已有多种酪氨酸激酶抑制剂被尝试用于疾病治疗,如nintedanib[14]、FB2[15]和TKI[16]等,其中有些药物已经进入临床试验阶段。Csk作为SFKs的天然抑制剂,在细胞的增殖、凋亡、转移等过程中起到重要作用,可以通过抑制SFKs的致癌活性发挥抑制肿瘤的作用。Nada等的实验证明Csk缺失会导致鼠胚胎发育停滞,生长缓慢,还会因神经管缺陷使鼠胚胎死亡。Csk的过表达能抑制人结肠癌细胞的肿瘤生长[17];使用慢病毒高表达Csk能够抑制SRC激酶的活性从而降低结肠癌的转移[18],Csk的过表达通过与V-Crk的相互作用抑制成纤维细胞的转化,起到负调控SFKs的作用[19];Csk的减少会引起急性炎症反应功能障碍[20]和T细胞分化[9],还会引起表皮增生[21]、细胞黏附缺陷和迁移[22]等的增加。因此,Csk可能成为一种潜在的抗肿瘤候选蛋白,有必要对其功能及其抑制SFKs的机制进行深入研究。
目前对于Csk抑制SFKs的作用机制尚不明确,一种观点认Csk和活化的SFKs同时结合到同一蛋白如CBP、Caveolin-1、Paxillin等[24]表明,SFKs是膜相关蛋白,而Csk是一个细胞质蛋白,因此需要与膜上的配体如Cbp或Cav-1结合,才能聚集到膜上来介导SFK的抑制。
获得有活性的Csk蛋白是进一步研究其功能和作用机制的前提。本研究利用RT-PCR技术得到Csk基因,并将Csk基因连接到真核表达载体pENTER上,通过酶切鉴定和质粒测序结果证明融合蛋白真核表达载体成功。再利用瞬时转染技术、免疫印迹的方法及考马斯亮蓝染色验证Csk在真核细胞293T中正确表达。通过间接免疫荧光定位了表达的Csk蛋白,通过his-pulldown及CO-IP的方法鉴定出Csk与IGF1R、SHC1的相互作用,从而确定表达的Csk蛋白能够参与到细胞的信号通路中,具有生物学活性,为后续研究Csk的作用机制奠定基础。
4 结论成功构建真核表达载体pENTER-Csk-his,并且重组蛋白在293T中得到高效表达。鉴定了Csk与IGF1R、SHC1的相互作用,说明表达的Csk蛋白具有生物学活性。
| [1] | Okada M. Regulation of the Src family kinases by Csk[J]. International Journal of Biological Sciences, 2012, 8(10): 1385–1397. |
| [2] | Nada S, Okada M, Macauley A, et al. Cloning of a complementary DNA for a protein-tyrosine kinase that specifically phosphorylates a negative regulatory site of p60c-src[J]. Nature, 1991, 351(6321): 69–72. |
| [3] | Roskoski R. Src protein-tyrosine kinase structure, mechanism, and small molecule inhibitors[J]. Pharmacological Research, 2015, 94: 9–25. |
| [4] | Zheng R, Yano S, Matsumori Y, et al. Src inase nhibitor, M475271, uppresses ubcutaneous rowth and roduction of ung etastasis ia nhibition of roliferation, nvasion, and ascularization of uman ung denocarcinoma ells[J]. Clinical & Experimental Metastasis, 2005, 22(3): 195–204. |
| [5] | Shin HK, Ryu BJ, Choi S, et al. Inactivation of rc-to-zrin athway:A ossible echanism in the uabain-ediated nhibition of A549 ell igration[J]. BioMed Research International, 2015, 2015: 1–10. |
| [6] | Yang CC, Fazli L, Loguercio S, et al. Downregulation of c-SRC kinase CSK promotes castration resistant prostate cancer and pinpoints a novel disease subclass[J]. Oncotarget, 2015, 6(26): 22060–22071. |
| [7] | Jeon BK, Kwon K, Kang JL, et al. Csk-nduced hosphorylation of rc at yrosine 530 is ssential for H2O2-ediated uppression of ERK1/2 in uman mbilical ein ndothelial ells[J]. Scientific Reports, 2015, 5: 12725. |
| [8] | Hakam A, Fang Q, Karl R, et al. Coexpression of IGF-1R and c-Src proteins in human pancreatic ductal adenocarcinoma[J]. Dig Dis Sci, 2003, 48(10): 1972–1978. |
| [9] | Manz BN, Tan YX, Courtney AH, et al. Small molecule inhibition of Csk alters affinity recognition by T cells[J]. ELife, 2015, 4. |
| [10] | Zhou D. Overexpression of Csk-binding protein decreases growth, invasion, and migration of esophageal carcinoma cells by controlling Src activation[J]. World Journal of Gastroenterology, 2015, 21(6): 1814. |
| [11] | Arbet-Engels C, Tartare-Deckert S, Eckhart W. C-terminal Src kinase associates with ligand-stimulated insulin-like growth factor-I receptor[J]. J Biol Chem, 1999, 274(9): 5422–5428. |
| [12] | Brehme M, Hantschel O, Colinge J, et al. Charting the molecular network of the drug target Bcr-Abl[J]. Proc Natl Acad Sci USA, 2009, 106(18): 7414–7419. |
| [13] | Taliaferro-Smith L, Oberlick E, Liu T, et al. FAK activation is required for IGF1R-mediated regulation of EMT, migration, and invasion in mesenchymal triple negative breast cancer cells[J]. Oncotarget, 2015, 6(7): 4757–4772. |
| [14] | Wollin L, Maillet I, Quesniaux V, et al. Antifibrotic and nti-inflammatory ctivity of the yrosine inase nhibitor intedanib in xperimental odels of ung ibrosis[J]. Journal of Pharmacology and Experimental Therapeutics, 2014, 349(2): 209–220. |
| [15] | Huang K, Hu J, Li X, et al. Role of P-glycoprotein in intestinal absorption of FB2, a promising Abl/Src dual tyrosine kinase inhibitor[J]. Drug Metab Pharmacokinet, 2012, 27(5): 486–494. |
| [16] | 瞿紫微, 王晓燕, 魏欣, 等. SRC激酶抑制剂对前列腺癌细胞侵袭与增殖的影响[J]. 现代肿瘤医学, 2011, (11): 2178–2180. |
| [17] | Oneyama C, Hikita T, Enya K, et al. The lipid raft-anchored adaptor protein Cbp controls the oncogenic potential of c-Src[J]. Mol Cell, 2008, 30(4): 426–436. |
| [18] | Nakagawa T, Tanaka S, Suzuki H, et al. Overexpression of the csk gene suppresses tumor metastasis in vivo[J]. Int J Cancer, 2000, 88(3): 384–391. |
| [19] | Sabe H, Knudsen B, Okada M, et al. Molecular cloning and expression of chicken C-terminal Src kinase:lack of stable association with c-Src protein[J]. Proc Natl Acad Sci USA, 1992, 89(6): 2190–2194. |
| [20] | Thomas RM, Schmedt C, Novelli M, et al. C-terminal SRC kinase controls acute inflammation and granulocyte adhesion[J]. Immunity, 2004, 20(2): 181–191. |
| [21] | Yagi R, Waguri S, Sumikawa Y, et al. C-terminal Src kinase controls development and maintenance of mouse squamous epithelia[J]. Embo J, 2007, 26(5): 1234–1244. |
| [22] | Nada S, Okada M, Aizawa S, et al. Identification of major tyrosine-phosphorylated proteins in Csk-deficient cells[J]. Oncogene, 1994, 9(12): 3571–3578. |
| [23] | Jamros MA, Oliveira LC, Whitford PC, et al. Substrate-specific reorganization of the conformational ensemble of CSK implicates novel modes of kinase function[J]. PLoS Comput Biol, 2012, 8(9): e1002695. |
| [24] | Place AT, Chen Z, Bakhshi FR, et al. Cooperative ole of Caveolin-1 and C-erminal Src inase inding rotein in C-erminal Src inase-ediated egative egulation of c-Src[J]. Molecular Pharmacology, 2011, 80(4): 665–672. |




