钙调素(calmodulin,CaM)作为一类细胞内Ca2+的受体,绝大多数无酶活性,也无转录因子活性,更不是结构蛋白,只有通过其下游的钙调素结合蛋白(calmodulin-binding protein,CaMBP)来调节细胞的生理功能[1-3]。因此,研究CaBMP对揭示CaM的功能至关重要,将有助于解析CaM信号通路的特异性、复杂性和多样性。CaM与CaMBP的结合可分为Ca2+依赖和不依赖两种类型。其中,Ca2+不依赖型的CaMBP含有IQ基序,完整IQ基序的氨基酸序列为IQXXXRGXXXR或[I/L/V]QXXXRXXXX[R/K][4, 5],但是,极少数含IQ基序的蛋白质与CaM的结合也依赖Ca2+[6, 7]。在植物中已经发现了5个含IQ基序的蛋白质家族[8]:myosin家族[9-11]、CAMTA家族[12, 13]、CNGC家族[14, 15]、IQD家族[6, 7, 16]和IQM家族[17-19],分别由17个、6个、20个、33个和6个成员组成。在拟南芥中,IQM家族共有6个成员,均只含有1个能与钙调素结合的IQ基序[20]。IQM1(IQ motif containing 1)是IQM家族的1个成员,由At4g33050编码,IQM1在体内外均能与CaM结合,并通过蛋白截短实验证明IQ基序是其钙调素结合所必需的结构域[17];本研究组将克隆得到的全长cDNA进行生物信息学分析发现,IQM2也是1个钙调素结合蛋白[21];IQM3的启动子中存在多种光、非生物胁迫和植物激素反应的顺式作用元件,IQM3基因与种子萌发及幼苗子叶膨大有密切关系[22]。IQM5是该家族的第5个成员,由At5g57010编码,其功能尚待研究。检索生物学文献和数据库发现IQM5基因存在一种剪切方式,即IQM5.1。已知,IQM1存在4种不同的剪切方式(见www.arabidopsis.org)。鉴于此,本研究对不同生长发育时期的RNA样本进行RT-PCR扩增和测序,以探究IQM5是否也存在不同的剪切方式,并对因不同的剪切方式所产生的转录本进行定量RT-PCR分析,旨为进一步解析该基因的功能奠定必要的基础。
1 材料与方法 1.1 材料植物材料:拟南芥(Arabidopsis thaliana)生态型为Columbia(Col);大肠杆菌菌株为E. coli DH5α;T-A克隆载体为pMD19-T Simple vector,购自TaKaRa公司;总RNA提取试剂盒(RNAiso Plus)、PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR®PrimeSc riptTM RT-PCR kit(Perfect Real Time)、琼脂糖凝胶回收试剂盒、DNA片段回收试剂盒、DNA Ligation Kit和PCR相关的试剂及Taq酶均为宝生物工程(大连)有限公司产品;氨苄青霉素钠、硫酸卡那霉素、蛋白胨、酵母抽提物、蔗糖、琼脂粉、各种氨基酸、NaCl等试剂均为生工生物工程上海股份有限公司产品。
1.2 方法 1.2.1 总RNA的提取采用 Trizol 法,从7d幼苗、成熟植株不同器官中提取总 RNA。
1.2.2 不同转录本的克隆以7 d幼苗和成熟莲座叶的总RNA为模板,以5'-atggctttatcttttggttactta-3'和5'-ttagtgccttgggcttggaagacc-3'为引物进行RT-PCR扩增,得到IQM5CDS。RT-PCR参数为:50℃反转录30 min,94℃变性2 min;94℃变性30 s,64℃退火30 s,72℃延伸2 min,共 33个循环;72℃延伸5 min。反应结束后电泳,并用凝胶成像系统(AlphamagerTM)观察、拍照,切取目的片段所在的凝胶,用胶回收试剂盒回收扩增产品,与pMD19-T载体连接,转化大肠杆菌,筛选出阳性菌落,进行菌落PCR,选择阳性菌落摇菌,菌液外送测序,并用生物信息学的方法分析测序结果。
1.2.3 基因表达分析 1.2.3.1 cDNA的获得参考PrimeScriptTM RT reagent Kit(Perfect Real Time)的操作手册进行。先用其中的gDNA Eraser除去RNA中的基因组DNA后,再进行反转录获得cDNA,最后进行PCR 检测,以确认 DNA是否除尽。
1.2.3.2 半定量RT-PCR以1.2.3.1所获得的cDNA为模板,进行PCR扩增。所用引物为IQM5.1-F1:5'-AAGTTTACCAGCACCGAC-3';IQM5.1-R1:5'-GCA-GCAAGATTTCTACGC-3';IQM5.2-F2:5'-CGTATG-TACACATGGTCTTC-3',IQM5.2-R2:5'-ACACTTCG-TAAGCTTGTCTC-3';Actin2-F:5'-TGACTACGAGC-AGGAGATGGAA-3',Actin2-R:5'-CAAACGAGGGC-TGGAACAA-3'。扩增程序为:94℃变性2 min;94℃变性30 s,62℃(Actin2)或51.5(IQM5.1IQM5.2)退火30 s,72℃延伸10 s,共28个循环;72℃延伸5 min。反应结束后,用浓度为2%的琼脂糖凝胶进行电泳,用凝胶成像系统观察并拍照。
1.2.3.3 实时定量RT-PCR用SYBR®PrimeSc riptTM RT-PCR kit(Perfect Real Time),相关耗材为Applied Biosystems(ABI7000)公司产品。所用基因专一引物同半定量RT-PCR,模板(1.2.3.1所获cDNA)浓度为0.5 ng·L- 1,每个样品设3次重复。选用表达相对稳定的Actin2作为内参基因,以IQM5.2的相对表达量作为参照因子(即1倍)。采用△△Ct法进行基因表达的相对定量分析,即利用 2-△△Ct公式计算IQM5.1基因与IQM5.2基因的相对比例(样品的△Ct=IQM5.1基因/IQM5.2基因的Ct -Actin2Ct,△△Ct=IQM5.2基因△Ct - IQM5.1基因的△Ct)。
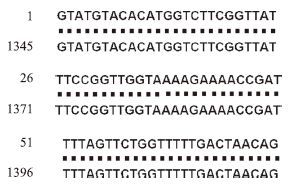
2 结果 2.1 IQM5.2的发现以7 d幼苗总RNA为模板进行RT-PCR,将扩增产物克隆进测序载体,转化大肠杆菌,随机选送5个菌落直接PCR呈阳性的菌落外送测序。测序结果显示,全部为IQM5.1。而在以成熟莲座叶总RNA为模板进行的RT-PCR所获得 9个序列中,3个与IQM5.1完全匹配,另外6个序列都存在1个长75 bp的与IQM5.1不匹配的片段。进一步分析发现,这个75 bp的片段与IQM5.1的基因组序列的第6个内含子(1 345-1 419 bp)完全匹配(图 1)。说明IQM5基因至少存在2种不同的剪切方式,其转录本分别为IQM5.1和IQM5.2。
|
| 图 1 所得75 bp片段与IQM5基因的第6个内含子的比对 |
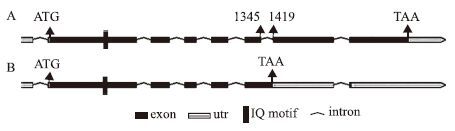
如上所述,在成熟植株的莲座叶中发现了一个新的IQM5基因的mRNA——IQM5.2。经过生物信息学分析得知,IQM5.2源于IQM5.1的第6个内含子未被剪切。该内含子两端的碱基为“GT-AG”(图 1),属于第二类“GT-AG”内含子。据此,IQM5基因由IQM5.1的8个外显子拼接为IQM5.2的7个外显子(图 2)。
|
| 图 2 IQM5.1(A)和IQM5.2(B)的剪切方式示意图 |
IQM5.1基因的cDNA全长1 783 bp,编码1个由495个氨基酸残基组成的多肽链(NP_200511.1)。IQM5.2 的cDNA全长1 858 bp,编码1个由300个氨基酸残基组成的多肽链(KT851542)(图 3)。这是由于在多出的75 bp的第70-72位核苷酸残基为终止密码“TAA”(图 1-图 3)所致。

|
| 图 3 IQM5.2的cDNA及其编码蛋白 |
用ExPASy的ProtParam软件预测,IQM5.1的分子式为C2474H3925N723O736S18,相对分子质量约为56 kD,酸性氨基酸(Asp + Glu)残基58个,碱性氨基酸(Arg + Lys)残基77个,等电点(pⅠ)为9.44,半衰期为30 h,不稳定参数(the instability index,Ⅱ)是41.89,属于不稳定蛋白。该蛋白亲水性平均数(grand average of hydropathicity,GRAVY)为-0.676,预测为亲水蛋白。
2.4 IQM5.2的理化性质用ExPASy的ProtParam软件预测,其分子式为C1528H2427N443O444S9,相对分子质量约为34 kD,酸性氨基酸(Asp + Glu)残基37个,碱性氨基酸(Arg + Lys)残基51个,等电点(pⅠ)为9.50,半衰期为30 h,不稳定参数是46.11,属于不稳定蛋白。该蛋白亲水性平均数为-0.688,预测为亲水蛋白。
2.5 功能预测经序列比对发现,IQM5.1的 N端与豌豆重金属诱导蛋白6A(HMIP6A)[23]、C端与栝楼天花粉素(trichosanthin)的N端[24]具有较高的同源性,第130-152位氨基酸残基为IQ基序(图 4)。IQM5.2与豌豆重金属诱导蛋白6A(HMIP6A)[23]具有较高同源性,第130-152位氨基酸残基为IQ基序(图 5)。HMIP6 A是在用汞、镉和铝处理的豌豆根中被发现的,具有一个含IQ基序的重复序列[23],而IQM5.1和IQM5.2均具有其中一段。提示,IQM5.2可能具有与HMIP6A相似的特性。天花粉素是从葫芦科植物栝楼(Trichosanthes kirilowii)新鲜块根中提取的植物蛋白质,属于Ⅰ型核糖体失活蛋白[24]。与IQM5.1相比,IQM5.2缺少了天花粉素同源区段。

|
| 图 4 IQM5.1与豌豆重金属诱导蛋白6A(HMIP 6A)及栝楼天花粉蛋白(Trichosanthin)的序列比对 *氨基酸相同;+氨基酸功能相似;▲/♠IQ motif关键氨基酸残基/天花粉蛋白的关键氨基酸残基 |

|
| 图 5 IQM5.2与豌豆重金属诱导蛋白6A(HMIP 6A)的序列比对 *氨基酸相同;+氨基酸功能相似;▲ IQ motif关键氨基酸残基 |
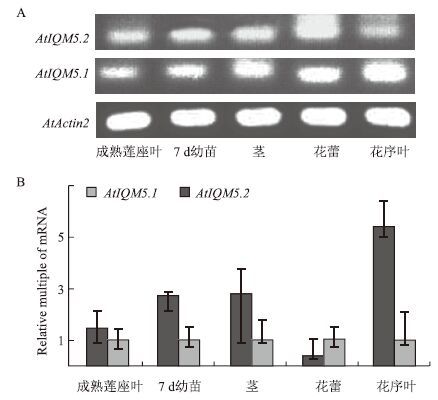
为了进一步分析IQM5.1和IQM5.2在不同器官中的表达比例,选取了7d幼苗、成熟植物的莲座叶、花序叶、茎和花蕾等5种不同材料进行半定量和定量RT-PCR分析。定量RT-PCR分析结果显示:若以同一材料中的IQM5.1的表达量作为1个单位,除花蕾中AtIQM5.2比IQM5.1的相对表达量低外,其他4种材料中IQM5.2比IQM5.1的表达量高(图 6-B)。半定量RT-PCR分析结果(图 6-A)印证了定量RT-PCR分析的结果。
|
| 图 6 AtIQM5.1和AtIQM5.2转录本的半定量(A)和定量(B)RT-PCR分析 |
本研究在生态型为Columbia(Col)的拟南芥中发现了一种IQM5基因的新的剪切方式,由IQM5.1的第6个内含子未被剪切所致,所产生的mRNA被命名为IQM5.2。与IQM5.1蛋白相比,IQM5.2蛋白缺少了天花粉素同源区段,但IQM5.2蛋白仍然保留了与HMIP6A同源的含IQ基序的区段,可能具有与HMIP6A相似但不同于IQM5.1的功能。本研究组多年从事拟南芥IQM家族的研究,利用截短蛋白所进行的实验发现IQ基序是IQM1与CaM结合的位点[17];进一步发现,若将IQ基序中的Ⅰ突变成S,IQM1同样不能与CaM结合[25];在IQM2的钙调素结合活性的研究中,本研究组得到了相同的结果(待发表)。因此,推断IQM5.2蛋白可以与CaM结合,并且很可能是不依赖Ca2+的CaM结合蛋白,具体特性还有待进一步研究。半定量和定量RT-PCR分析结果显示,5种不同材料中都存在IQM5.1和IQM5.2的转录本,且二者的比例在不同的材料中不尽相同。因此推测,二者的比例可能与发育调节有关,其间的具体关系则有待深入研究。
4 结论发现AtIQM5基因的一种新的转录本IQM5.2,并在拟南芥生态型为Columbia(Col)的幼苗、莲座叶、花序叶、茎和花蕾中均存在IQM5.1和IQM5.2两种转录本,且二者的比例在不同器官中不尽相同。
| [1] | McAinsh RM, Pittman JK. Shaping the calcium signature[J]. New Phytol, 2009, 181(2): 275–294. |
| [2] | Sanders D, Pelloux J, Brownlee C, et al. Calcium at the crossroads of signaling[J]. Plant Cell, 2002, 14(Suppl): S401–S417. |
| [3] | O'Day DH. CaMBOT:profiling and characterizing calmodulin-binding protein[J]. Cell Signal, 2003, 15: 347–354. |
| [4] | Rhoads AR, Freiedberg F. Sequence motif and calmodulin recognition[J]. FASEB J, 1997, 11: 331–340. |
| [5] | Jurado LA, Chockalingam PS, Jarrett HW. Apocalmodulin[J]. Physiol Rev, 1999, 79(3): 661–682. |
| [6] | 韦慧彦, 郭振清, 崔素娟. 钙不依赖性钙调素结合蛋白的研究进展[J]. 生物化学与生物物理进展, 2007, 34(2): 124–131. |
| [7] | Abel S, Savchenko T, Levy M. Genome-wide comparative analysis of the IQD gene families in Arabbidopsis thaliana and Oryza sativa[J]. BMC Evol Biol, 2005, 5: 72–89. |
| [8] | 田长恩, 周玉萍. 植物具IQ基序的钙调素结合蛋白的研究进展[J]. 植物学报, 2013, 48(4): 447–480. |
| [9] | Reddy AS, Day IS. Analysis of the myosins encoded in the recently completed Arabidopsis thaliana genome sequence[J]. Genome Biol, 2001, 2(7): RESEARCH0024. |
| [10] | Holweg C, Nick P. Arabidopsis myosin XI mutant is defective inorganelle movement and polar auxin transport[J]. Proc Natl Acad Sci USA, 2004, 101: 10488–10493. |
| [11] | Ojangu EL, Järve K, Paves H, et al. Arabidopsis thaliana myosin XIK is involved in root hair as well as trichome morphogenesis on stems and leaves[J]. Protoplasma, 2007, 230(3-4): 193–202. |
| [12] | Bouché N, Scharlat A, Snedden W, et al. A novel family of calmodulin-binding transcription activators in multicellular organisms[J]. J Biol Chem, 2002, 277(24): 21851–21861. |
| [13] | Bouché N, Yellin A, Snedden WA, et al. Plant-specific calmodulin-binding proteins[J]. Annu Rev Plant Biol, 2005, 56: 435–466. |
| [14] | Köhler C, Merkle T, Neuhaus G. Characterisation of a novel gene family of putative cyclic nucleotide and calmodulin-regulated ion channels in Arabidopsis thaliana[J]. Plant J, 1999, 18(1): 97–104. |
| [15] | Talke IN, Blaudez D, Maathuis FJ, et al. CNGCs:prime targets of plant cyclic nucleotide signalling?[J]. Trends Plant Sci, 2003, 8(6): 286–293. |
| [16] | Levy M, Wang Q, Kaspi R, et al. Arabidopsis IQD1, a novel calmo-dulin-binding nuclear protein, stimulates glucosinolate accumula-tion and plant defense[J]. Plant J, 2005, 1: 79–96. |
| [17] | Zhou YP, Duan J, Yamamoto KT, et al. AtIQM1, a novel calmodulin-binding protein, is involved in stomatal movement in Arabidopsis[J]. Plant Mol Biol, 2012, 79(4-5): 333–346. |
| [18] | Zhou YP, Fujibe T, Wang XL, et al. Initial characterization of Arabidopsis T-DNA insertion mutants of the iqm1 gene that encodes an IQ motif-containing protein[J]. Plant Cell Physiol, 2007, 48(Suppl): s197. |
| [19] | Zhou YP, Chen YZ, Duan J, et al. Sequence and expression analysis of the Arabidopsis IQM family[J]. Acta Physiol Plant, 2010, 1: 191–198. |
| [20] | Bähler M, Rhoads A. Calmodulin signaling via the IQ motif[J]. FEBS Lett, 2002, 513: 107–113. |
| [21] | 陈羽中, 周玉萍, 叶蕙, 等. 拟南芥IQM2 cDNA的克隆与生物信息学分析[J]. 武汉植物学研究, 2010, 28(3): 353–358. |
| [22] | 周玉萍, 赵军, 何滔, 等. 拟南芥IQM3基因的表达分析及其突变体的鉴定[J]. 热带亚热带植物学报, 2009, 17(4): 365–370. |
| [23] | Sävenstrand H, Strid A. Six genes strongly regulated by mercury in Pisum sativum roots[J]. Plant Physiol Biochem, 2004, 42: 135–142. |
| [24] | Chow TP, Feldman RA, Lovett M, et al. Isolation and DNA sequence of a gene encoding alpha-trichosanthin, a type I ribosome-inactivating protein[J]. J Biol Chem, 1990, 265: 8670–8674. |
| [25] | 黄章科, 张艺能, 莫忠臻, 等. IQ基序突变对AtIQM1的钙调素结合活性的影响[J]. 生物技术通报, 2014, 12: 128–132. |




