2. 北京农业生物技术研究中心,北京 100097;
3. 南京农业大学生命科学学院,南京 210095;
4. 河北省邯郸市农业科学院,邯郸 056001;
5. 河北省高校冀南太行山区野生资源植物应用技术研发中心,邯郸 056005
2. Beijing Research Center of Agro-Biotechnology, Beijing 100097;;
3. College of Life Sciences, Nanjing Agricultural University, Nanjing 210095;;
4. Handan Academy of Agricultural Sciences in Hebei Province, Handan 056001;;
5. Application Technology Research and Development Center of Wild Resource Plants in Taihang Mountain Area of Southern Hebei for Hebei Institutions of Higher Education, Handan 056005
水分缺乏是世界范围内限制作物产量的一个主要因素,提高农作物产量需要培育耐旱种质[1]。为了减轻干旱对农业生产造成的损失,人们一方面采用改良土壤、合理灌溉等农业措施;另一方面通过培育作物抗旱品种来提高作物的抗旱能力。植物体内存在许多与干旱相关的信号转导通路,植物通过激活许多信号通路响应干旱胁迫,使植物抵御或适应胁迫[2]。
干旱胁迫诱导所表达的基因主要包括起单一功能作用的基因和调控基因。第一类单一功能作用的基因主要是指编码产物可在逆境下直接起保护作用的相关基因。(1)抗氧化基因。编码产物如超氧化物歧化酶、过氧化物酶和过氧化氢酶。(2)合成渗透调节物质的基因。该类基因的过表达增加了细胞渗透保护物质,如脯氨酸、甜菜碱、海藻糖、果聚糖的合成能力,使其在细胞中积累,以维持细胞较高的渗透压,从而增强植株的抗旱性。(3)其他胁迫相关基因,其编码产物参与保护生物大分子及膜结构。第二类是具有调控功能的基因,主要是参与信号转导或转录调控相关的基因,其编码产物可在逆境胁迫下起调节作用。如转录因子和参与植物细胞信号转导的基因[3]。
目前,用于玉米的抗旱基因工程育种也主要是这两类基因。在抗旱功能基因转化玉米方面,主要有甜菜碱合成酶基因betA[4],蛋白激酶基因NPK1[5],玉米磷脂酶C基因(ZmPLC1)[6],小盐芥(Thellungiella halophila)液泡H+ 焦磷酸酶(vac-uolar H+-pyrophosphatase,TsVP)[7],AtGPX3基因[8],隣脂酰肌醇合成酶ZmPIS基因[9],枯草杆菌cspB基因[3],编码胆碱脱氢酶的BADH 基因[10]。
高等植物中,Δ1-吡咯啉-5-羧酸合成酶(P5CS)是由谷氨酸生物合成脯氨酸的限速酶。在干旱胁迫下许多植物体会积累大量的脯氨酸,脯氨酸在细胞内可作为渗透调节剂降低细胞质的水势,维持胞质的水分状况,使植物适应干旱胁迫[11, 12]。脯氨酸累积与植物对干旱和盐胁迫的适应性呈正相关性关系[7]。脯氨酸的生物合成途径首先在大肠杆菌中被发现[13]。在植物体内,脯氨酸的合成是通过谷氨酸途径和鸟氨酸途径进行的,其中谷氨酸途径在渗透胁迫条件下占主要地位[14]。Δ1-吡咯啉-5-羧酸合成酶(P5CS)由P5CS基因编码。在高等植物中,第一个P5CS基因是从豇豆(Vigna aconitifolia)中克隆的[15]。基因表达分析表明,P5CS 基因能够在豇豆叶片中高水平表达,且在根中的表达受盐胁迫诱导,暗示其在脯氨酸生物合成中发挥重要作用,在植物中表达可引起渗透调节[15]。研究证明,转P5CS基因的高羊茅[16]和白三叶[17]的抗旱性有一定程度的增强。
1987年,Klein等[18]利用基因枪转化洋葱(Allium cepa)表皮细胞获得成功,使这一技术在单子叶植物的遗传转化中得到应用。而利用基因枪法对玉米开展基于P5CS基因的遗传转化还未见报道。本研究利用基因枪法将豇豆P5CS基因的突变型P5CS-F129A基因导入玉米自交系京501中,经草丁膦筛选获得转化体,对草丁膦抗性植株进行PCR检测和Northern blot鉴定,同时,对转基因植株进行脯氨酸和丙二醛(MDA)含量的测定。
1 材料与方法 1.1 材料供试的玉米(Zea mays L.)为自交系京501,由北京市农林科学院玉米中心提供。
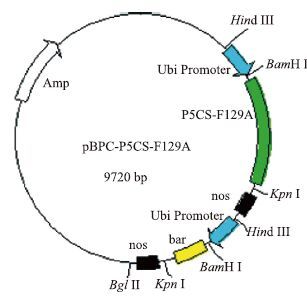
1.2 方法 1.2.1 植物表达载体质粒pBPC-P5CS-F129A由北京农业生物技术研究中心提供,该基因上游为Ubi(玉米泛醌素)启动子,下游为 nos终止子,选择标记基因是bar基因(图 1)。
|
| 图 1 pBPC-P5CS-F129A质粒图谱 |
取授粉后 10-13 d、幼胚大小为 1-2 mm的玉米果穗,去苞叶后在70%的酒精中浸泡5-10 min,取出后用解剖刀削去种皮及部分胚乳,挑出幼胚,接种于诱导培养基上。
1.2.3 培养基基本培养基:N6大量、B5微量、N6 有机、Fe盐、脯氨酸690 mg/L、水解酪蛋白200 mg/L、肌醇100 mg/L、蔗糖30 mg/L、植物凝胶2.6 mg/L或琼脂粉6 mg/L;愈伤组织诱导及继代培养基:基本培养基附加 2,4-D 2 mg/L和10 mg/L AgNO3;选择培养基:愈伤组织诱导或继代培养基附加不同浓度草丁膦和10 mg/L AgNO3;胚状体诱导培养基:基本培养基附加1.5 mg/L KT;分化培养基:同基本培养基;生根壮苗培养基:基本培养基附加0.5 mg/L NAA。
1.2.4 基因枪轰击方法与参数参见文献[16]的方法进行。
1.2.5 胚性愈伤组织的筛选 1.2.5.1 胚性愈伤组织的恢复培养将用基因枪轰击后的胚性愈伤组织,在原培养皿中、暗处恢复培养3-5 d以便修复由微弹复合体对受体细胞造成的损伤。
1.2.5.2 胚性愈伤组织的继代筛选将恢复培养后的胚性愈伤组织接种在附加草丁膦6 mg/L筛选继代培养基筛选15 d。然后,将存活的抗性愈伤转接到草丁膦10 mg/L的筛选继代培养基上进行第2次筛选15 d。
1.2.6 植株的再生及移栽抗性愈伤组织在附加1.5 mg/L KT的胚状体诱导培养基上培养一周后,转移至分化培养基进行绿苗分化。分化的绿苗长出主茎后,将其移至生根壮苗培养基上生根壮苗。待幼苗长出 2片新叶、3-4条主根后,移至装有营养土(2/3 蛭石+1/3腐殖质)的小花盆中。当幼苗在小花盆中长出 1-2片新叶,带土移栽到大田。
1.2.7 再生植株的分子检测选取草丁膦抗性的植株,用CTAB法提取叶片总DNA,利用PCR对P5CS基因进行检测。根据P5CS基因的序列设计引物为:上游引物:22 bp 5'-CTCTCTACGATACGCTGTTCAC-3';下游引物:20 bp 5'-CTTCTTTGCCACCTTTCAAG-3';阳性转基因植株可扩增出1 008 bp的片段。PCR采用由东盛公司生产的扩增仪。
1.2.7.2 PCR阳性植株的Northern blot 鉴定取经PCR检测呈阳性的植株进行Northern blot 分析,以未转基因的野生型植株的RNA为阴性对照。探针标记和杂交检测按照Roche公司的地高辛试剂盒的方法进行,杂交温度为41℃。具体参见文献[19]的方法进行。
1.2.8 脯氨酸含量测定对部分转基因玉米植株和对照植株进行干旱处理,测定幼苗叶片脯氨酸含量。叶片脯氨酸含量的测定按Bates和张殿忠等[20, 21]的方法进行。数据为3次独立实验的平均值。
1.2.9 叶片丙二醛(MDA)含量测定丙二醛(MDA)含量通过与硫代巴比妥酸的颜色反应来测定[22, 23]。
2 结果 2.1 胚性愈伤组织的筛选和植株再生用不同浓度的草丁膦对幼胚愈伤组织进行两次筛选。第1次是在附加草丁膦6 mg/L筛选继代培养基筛选15 d,愈伤组织的成活率在30%左右。然后,将存活的抗性愈伤转接到草丁膦10 mg/L的筛选继代培养基上进行第2次筛选15 d。在愈伤组织筛选过程中,非抗性愈伤组织块会逐渐褐化变黑而死亡,25-35 d后,大部分(90%-95%)愈伤组织被杀死,只有少部分(5%-10%)愈伤组织能够存活下来(抗性愈伤组织)并逐渐长出绿色的小芽点,再经过10-20 d后,发育成具有茎和叶的小植株,最后在生根培养基上发育成完整的植株(图 2)。

|
| 图 2 玉米植株再生体系的建立 A:玉米幼胚;B:玉米幼胚诱导的愈伤组织;C:抗性愈伤组织分化成小绿点;D:再生植株 |
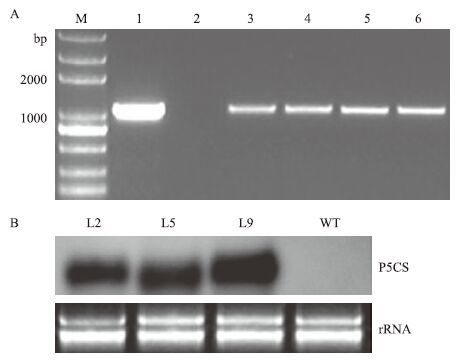
用设计好的引物对草丁膦抗性植株进行P5CS基因的PCR检测,转基因植株的P5CS基因扩增带位置与质粒阳性对照扩增带位置相同,而阴性对照及其他植株无扩增带(图 3-A)。经检测,共得到11株PCR阳性植株,阳性率70%。
|
| 图 3 转基因玉米植株的分子鉴定 A:部分草丁膦抗性植株的PCR 检测 M:DNA标准分子量;1:阳性对照;2. 阴性对照;3-6:转基因植株。B:转基因玉米植株的Northern blot分析 总RNA从三叶期对照植株和转基因植株的叶片中提取,每个泳道RNA上样量为15 μg,探针为地高辛标记的P5CS cDNA特异探针,溴化乙锭染色的rRNA作内参。WT:野生型植株;L2,L5,L9:转基因植株 |
为了检测目的基因在转基因植株中是否表达,从野生型和3个转基因植株叶片中提取总RNA,进行Northern blot分析。每个泳道RNA上样量为15 μg,探针为地高辛标记的P5CS cDNA特异探针,溴化乙锭染色的rRNA作内参,Northern杂交检测结果如图 3-B所示。在未转基因的对照植株中未出现扩增产物,而在各转基因植株株系中目的基因均有不同程度的表达。根据目的基因表达强度,选择株系L2、L9进行抗旱性实验。
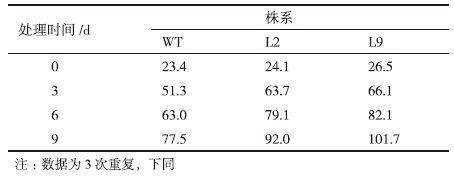
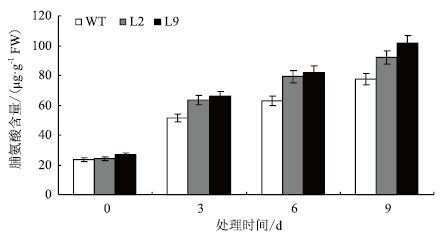
2.3 转基因植株的脯氨酸含量增加为了解在干旱胁迫处理条件下转基因植株脯氨酸积累的变化,测定了转基因植株和对照植株叶片脯氨酸的含量。在干旱胁迫处理之前,叶片脯氨酸含量在转基因植株和对照植株之间没有显著差异,含量都较低。干旱胁迫引起转基因植株叶片脯氨酸含量有不同程度的上升。在干旱胁迫处理过程中,转基因植株叶片脯氨酸的含量都显著高于其对照植株。如在正常条件下,WT、L2和L9植株的脯氨酸含量分别为23.4、24.1和26.5 μg/g·FW,没有显著差异。干旱胁迫处理3 d后,L2和L9植株脯氨酸含量分别上升为63.7和66.1 μg/g·FW,显著高于WT植株的51.3 μg/g·FW,转基因植株叶片脯氨酸含量比对照株高24.2%-28.8%(图 4,表 1)。这些结果表明转基因植株细胞可以积累更多的脯氨酸,使细胞能够维持较低的溶质势,从而能够更好地保持水分,减少或免受干旱胁迫的伤害。与对照相比,转基因植株对干旱胁迫具有较强的耐性。
|
| 图 4 干旱胁迫引起的玉米幼苗脯氨酸含量的变化 L2,L9:转基因株系;WT:对照株系 |
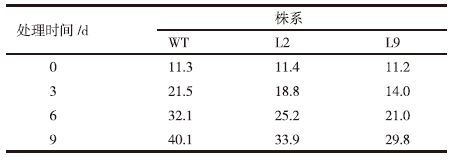
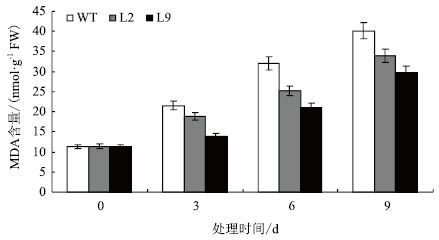
干旱胁迫条件下,玉米叶片失水萎蔫,叶片细胞内活性氧含量上升,使细胞膜脂成分发生氧化,脂质过氧化产物为丙二醛(MDA),MDA能与蛋白质等交联导致酶失活或膜系统受损,因此,植物体内MDA含量的高低可在一定程度上反映玉米植株在干旱胁迫条件下膜脂过氧化的程度的大小。结果表明:在干旱胁迫处理前,各株系的丙二醛含量差别较小,且随着干旱胁迫处理时间的延长而升高(图 5,表 2)。相同处理时间下转基因株系与对照株系相比测定值要低。如在干旱胁迫处理第3天时,L2和L9的MDA含量分别为18.8 nmol/g FW,14.0 nmol/g FW,而WT的测定值达到了21.5 nmol/g FW。这些结果表明,在干旱胁迫下转P5CS基因植株的细胞膜损伤较轻,有利于植株的生长,使转基因植株抗旱性得到提高。
|
| 图 5 干旱胁迫引起的玉米幼苗丙二醛含量的变化 L2,L9:转基因株系;WT:对照株系 |
环境中,植物常常遭受干旱胁迫。植物通过激活一系列信号途径来响应胁迫,使植物能抵御或适应干旱胁迫。干旱可以产生细胞伤害和次生胁迫,如渗透和氧化胁迫。通过信号感知和转导,启动下游信号程序和转录调控机制,激活胁迫响应机制(如脯氨酸参与的渗透保护)以重建平衡,保护和修复受伤害蛋白和各种膜,从而赋予植物胁迫耐性[24]。
干旱是影响植物生长发育的重要因素,通过渗透胁迫影响植物细胞膨压从而导致植物的不良生长。在渗透胁迫下,植物将产生一些渗透调节物质抵抗该胁迫,包括脯氨酸和甜菜碱。脯氨酸主要来源于谷氨酸合成途径[25]。研究表明,由P5CS基因编码的Δ1-吡咯琳-5-羧酸合成酶是渗透胁迫时植物体内合成脯氨酸的关键酶,单独转化P5CS基因的植株可以提高脯氨酸的含量,起到抗旱的作用[26]。
自从1992年第一个高等植物的P5CS基因从豇豆中克隆以来,在许多植物中克隆出该基因。据不完全统计,仅从2010年以来就从20多种植物中成功克隆了P5CS基因[27-53]。同时,利用豇豆P5CS基因转化高羊茅[16]、冰草[54]、白三叶[17],多年生黑麦草P5CS基因转化拟南芥[55],普通菜豆PvP5CS1基因转化拟南芥[56]、PvP5CS2基因转化烟草[56],朝鲜碱茅P5CS基因转化紫花苜蓿[57],新牧一号苜蓿MvP5CS基因转化棉花[58],拟南芥P5CS1基因转化羽衣甘蓝[47]和马铃薯[59]均获得成功。
实验证实,转化P5CS基因可显著提高多种植物的脯氨酸水平[60-63]。转基因植株比对照植株最低也高达20.0%[17],有的高达12倍[61],耐旱性也有不同程度的提高。研究还发现,脯氨酸在调控植物体内蛋白合成和细胞周期转换中起重要作用,脯氨酸可以保护遭受渗透伤害的发育中的细胞[49]。脯氨酸合成不足会导致周期蛋白基因和其他细胞周期相关基因的表达下调,暗示脯氨酸可以作为植物发育中的信号分子参与细胞信号转导过程[64]。
为进一步探讨植物抗旱的生理机制,Singh等[65]比较了两种棉花的干旱耐性相关基因的差异表达谱和生理表现。结果显示,在干旱条件下,生理指标诸如净光合速率、蒸腾、气孔导度、叶绿素荧光、相对含水量(RWC)和水势都会发生变化,而脯氨酸、丙二醛(MDA)、谷胱甘肽-S-转移酶(GST)含量会随着其相关基因表达改变而增加。中度胁迫下,耐旱品种保持较低的水势可能是由于与敏感品种相比具有的较高脯氨酸含量。基因表达分析显示,耐旱品种通过上调天冬酰胺合成酶调节(AS)、谷胱甘肽-S-转移酶(GST)和甲基乙二醛(glyⅠ)基因表达增强解毒机制,同时,耐旱品种通过上调Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因增强脯氨酸,一种渗透调节物质的积累[65]。研究也发现,玉米在长期遭受非生物逆境胁迫尤其是干旱胁迫条件下,细胞内离子平衡遭到破坏,从而影响一系列代谢通路,导致多种生理活动出现紊乱,最终对植物生长发育产生抑制作用[3]。
为了提高玉米对干旱胁迫的适应能力,将来自豇豆的P5CS基因转化玉米。首先通过不同植物生长调节剂组合,建立了基于玉米幼胚的遗传转化体系;其次采用基因枪转化法将P5CS基因转化到玉米基因组中,并通过PCR和Northern blot检测,验证了目的基因已转入到玉米基因组中并得到表达。
另外,通过探讨转基因植株在干旱胁迫条件下的生理生化变化对其抗旱性进行了初步研究。测定了转基因植株和对照植株的脯氨酸含量。从本实验的结果来看,干旱胁迫下,转基因玉米植株中脯氨酸含量的增加明显高于对照植株,如干旱胁迫处理3 d后,转基因株系L9植株脯氨酸含量为66.1 μg/g·FW,显著高于WT植株的51.3 μg/g·FW(图 4,表 1),说明转基因植株的细胞能够维持较低的溶质势,抵御干旱胁迫能力较强。
水分胁迫会造成植物细胞原生质膜的损伤,破坏质膜的结构,使其稳定性降低,透性增大,干旱胁迫也会使细胞膜脂成分发生氧化,脂质过氧化产物主要是丙二醛(MDA)。MDA(丙二醛)含量越高,反映植物抗旱性越弱,反之,则植物抗旱性强。质膜伤害度增值与抗旱性为显著负相关[66]。转基因植株和对照植株的MDA含量测定结果显示,相同处理时间下转基因株系的MDA比对照株系的要低。在干旱胁迫处理第3天时,L9的MDA含量分别为14.0 nmol/g·FW,而WT的测定值达到了21.5 nmol/g·FW。表明干旱胁迫下,与对照植株相比,转基因植株的膜脂过氧化程度较轻,细胞膜稳定性较高,抗旱性较强(图 5,表 2)。在干旱胁迫下转P5CS基因植株可以通过降低细胞膜损伤提高干旱耐性。以上实验结果表明转P5CS基因玉米的抗旱性得到了一定提高。后续将对转基因植株进行田间抗旱性分析,筛选抗旱性较强的转基因玉米新材料,为玉米抗旱育种提供中间材料。
近年来,P5CS基因对提高植物抗旱能力在抗逆基因工程上的应用不断得到研究探讨与证实,这些研究应用将为抗旱植物的培育及真正运用于大田生产奠定坚实的基础。目前,我国玉米产量和品质虽有一定提高但仍继续进行改良,考虑到目前转基因玉米的应用主要集中在抗虫、抗除草剂方面,而对于中国北方大面积的缺水现状而言,利用不同遗传背景的P5CS基因转化玉米,增加玉米的抗旱性,获得具有优良性状并能稳定遗传的耐旱玉米新品种将具有重要的经济和实践意义,因而具有广阔的应用前景。
4 结论本实验的研究表明,豇豆P5CS基因已整合进转基因玉米基因组中并能够在植株中表达。干旱胁迫下,转P5CS基因玉米植株的脯氨酸含量比对照高,而丙二醛含量比对照要低,转基因玉米植株的抗旱性得到提高。
| [1] | Shi J, Habben JE, Archilbald RL, et al. Over-expression of ARGOS genes modifies plant sensitivity to ethylene, leading to improved drought tolerance in both Arabidopsis and maize[J]. Plant Physiology, 2015, 169(1): 266–282. |
| [2] | Pandey GK. Emergence of a novel calcium signaling pathway in plants:CBL-CIPK signaling network[J]. Physiology and Molecular Biology of Plants, 2008, 14: 51–68. |
| [3] | 孙越. 抗玉米螟、抗草甘膦、抗旱的转基因复合性状玉米种质的创制[D]. 济南:山东大学, 2014. |
| [4] | Quan R, Shang M, Zhang H, et al. Engineering of enhanced glyeine betaine synthesis improves drought tolerance in maize[J]. Plant Biotechnology Journal, 2004, 2(6): 477–486. |
| [5] | Shou H, Bordallo P, Wang K. Expression of the Nicotiana protein kinase(NPKI)enhanced drought tolerance in transgenic maize[J]. J Exp Bot, 2004, 55(399): 1013–1019. |
| [6] | Wang CR, Yang AF, Yue GD, et al. Enhanced expression of phospholipase C1(ZmPLC1)improves drought tolerance in transgenic maize[J]. Planta, 2008, 227(5): 1127–1140. |
| [7] | Li B, Wei AY, Song CX, et al. Heterologous expression of the TsVP gene improves the drought resistance of maize[J]. Plant Biotechnology Journal, 2008, 6: 146–159. |
| [8] | 陆宝石. AtGPX3和AtCHX23玉米转基因植株的获得[D]. 开封:河南大学, 2011. |
| [9] | 刘秀霞. 磷脂酰肌醇合成酶基因、磷脂酶A2基因表达水平的改变对玉米抗旱性的影响[D]. 济南:山东大学, 2012. |
| [10] | 罗安才, 李利霞, 党辉, 等. 转基因玉米(36Ba3C42-1-3)大喇叭口期抗旱性的研究[J]. 重庆师范大学学报:自然科学版, 2015, 32(4): 1–5. |
| [11] | Yoshiba Y, Kiyosue T, Katagiri T, et al. Correlation between the induction of a gene for Δ1-pyrroline-5-carboxylate synthetase and the accumulation of proline in Arabidopsis thaliana under osmotic stress[J]. The Plant Journal, 1995, 7(5): 751–760. |
| [12] | Verslues PE, Agarwal M, Katiyar-Agarwal S, et al. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status[J]. The Plant Journal, 2006, 45(4): 523–539. |
| [13] | Kishor PBK, Hong Z, Miao GH, et al. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants[J]. Plant Physiology, 1995, 108: 1387–1394. |
| [14] | Zhang CS, Lu Q, Verma DPS. Removal of feedback inhibition of Δ1-pyrroline- 5-carboxylate synthetase, a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants[J]. J Biol Chem, 1995, 270(35): 20491–20496. |
| [15] | Hu CA, Delauney AJ, Verma DPS. A bifunctional enzyme(△1- pyrroline-5-carboxylate synthetase)catalyzes the first two steps in proline biosynthesis in plants[J]. Proc Natl Acad Sci USA, 1992, 89: 9354–9358. |
| [16] | 李志亮, 黄丛林, 张秀海, 等. 利用基因枪法向高羊茅导入P5CS基因的研究[J]. 园艺学报, 2005, 32(4): 653–657. |
| [17] | 李志亮, 杨清, 叶嘉, 等. 利用P5CS基因转化白三叶的研究[J]. 生物技术通报, 2012, (5): 61–65. |
| [18] | Klein TM, Wolf ED, Wu R, et al. High-velocity microprojectiles for delivering nucleic acids into living cells[J]. Nature, 1987, (327): 70–73. |
| [19] | Li ZL, Bian MD, Wu ZY, et al. Isolation and drought-tolerant function analysis of ZmPti1-1, a homologue to Pti1, from maize(Zea mays L.)[J]. African Journal of Biotechnology, 2011, 10: 5327–5336. |
| [20] | Bates LS, Waldren RP, Teare ID. Rapid determination of free proline for water-stress studies[J]. Plant Soil, 1973, 39: 205–207. |
| [21] | 张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法[J]. 植物生理学通讯, 1990, (4): 62–65. |
| [22] | Heath RL, Packer L. Photoperoxidation in isolated chloroplast. I. Kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biochem Biophys, 1968, 125: 189–198. |
| [23] | 赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 1994, 30(3): 207–210. |
| [24] | Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures:towards genetic engineering for stress tolerance[J]. Planta, 2003, 218: 1–14. |
| [25] | 高亚迪. 农杆菌介导的P5CS-基因转化东农303马铃薯的研究[D]. 哈尔滨:东北林业大学, 2010. |
| [26] | 王忠华, 李旭晨, 夏英武. 作物抗旱的作用机制及其基因工程改良研究进展[J]. 生物技术通报, 2002, (1): 16–19. |
| [27] | 曹丽, 孙振元, 义鸣放, 等. 多年生黑麦草P5CS基因的cDNA克隆、表达及亚细胞定位[J]. 园艺学报, 2010, 37(9): 1477–1484. |
| [28] | 曾光, 石庆华, 张博, 等. 黄花苜蓿MfNHX基因和MfP5CS基因的克隆和序列分析[J]. 新疆农业科学, 2010, 47(6): 1231–1235. |
| [29] | 黄志, 邹志荣, 黄焕焕, 等. 甜瓜抗旱性相关基因MeP5CS的克隆、序列分析及表达[J]. 园艺学报, 2010, (8): 1279–1286. |
| [30] | Chen J, Zhang X, Jing R, et al. Cloning and genetic diversity analy-sis of a new P5CS gene from common bean(Phaseolus vulgaris L.)[J]. Theor Appl Genet, 2010, 120(7): 1393–1404. |
| [31] | Chen JB, Yang JW, Zhang ZY, et al. Two P5CS genes from common bean exhibiting different tolerance to salt stress in transgenic Arabi-dopsis[J]. J Genet, 2013, 92(3): 461–469. |
| [32] | 徐博, 任伟, 徐安凯, 等. 朝鲜碱茅Δ'-吡咯啉-5-羧酸合成酶(P5CS)基因的克隆及表达分析[J]. 华北农学报, 2011, 26(6): 20–26. |
| [33] | Su M, Li XF, Ma XY, et al. Cloning two P5CS genes from bioenergy sorghum and their expression profiles under abiotic stresses and MeJA treatment[J]. Plant Sci, 2011, 6: 652–659. |
| [34] | 焦蓉, 刘贯山, 刘好宝, 等. 普通烟草抗渗透胁迫基因NtP5CS的克隆与表达分析[J]. 中国烟草学报, 2012, (2): 49–57. |
| [35] | 丛丽丽. 虉草耐盐性鉴定及P5CS基因克隆[D]. 雅安:四川农业大学, 2012. |
| [36] | Cong LL, Zhang XQ, Yang FY, et al. Isolation of the P5CS gene from reed canary grass and its expression under salt stress[J]. Genetics and Molecular Research, 2014, 13(4): 9122–9133. |
| [37] | 张桦, 张富春, 曾光, 等. 新牧一号苜蓿MvP5CS基因的克隆和功能分析[J]. 草业学报, 2012, 29(1): 51–58. |
| [38] | 童伟. 桑树干旱胁迫转录组测序和P5CS基因的克隆及表达分析[D]. 镇江:江苏科技大学, 2013. |
| [39] | 冯远航. 枸杞LmP5CS基因克隆及表达分析[D]. 天津:天津大学, 2013. |
| [40] | 郑琳琳. 唐古特白刺NtP5CS和NtCIPK2基因的克隆及功能分析[D]. 呼和浩特:内蒙古大学, 2013. |
| [41] | Zheng L, Dang Z, Li H, et al. Isolation and characterization of a Δ1-pyrroline-5-carboxylate synthetase(NtP5CS)from Nitraria tangutorum Bobr. and functional comparison with its Arabidopsis homologue[J]. Mol Biol Rep, 2014, 41(1): 563–572. |
| [42] | 张乐新, 苏蔓, 马甜, 等. 羊草Δ1-吡咯啉-5-羧酸合成酶(LcP5CS1)基因的克隆与分析[J]. 草业学报, 2013, 22(4): 197–204. |
| [43] | An Y, Zhang M, Liu G, et al. Proline accumulation in leaves of Periploca sepium via both biosynthesis up-regulation and transport during recovery from severe drought[J]. PLoS One, 2013, 7: 1–10. |
| [44] | Kim GB, Nam YW. A novel Δ(1)-pyrroline-5-carboxylate synthetase gene of Medicago truncatula plays a predominant role in stress-induced proline accumulation during symbiotic nitrogen fixation[J]. J Plant Physiol, 2013, 170(3): 291–302. |
| [45] | 张霞, 唐维, 刘嘉, 等. 过量表达水稻OsP5CS1和OsP5CS2基因提高烟草脯氨酸的生物合成及其非生物胁迫抗性[J]. 应用与环境生物学报, 2014, 20(4): 717–722. |
| [46] | 马玉花, 冶贵生, 刘宝尧, 等. 青海野生中国沙棘P5CS基因的扩增及序列分析[J]. 西北林学院学报, 2014, (5): 88–91. |
| [47] | 李鸿雁, 李大红. 转拟南芥P5CS1基因增强羽衣甘蓝的耐旱性[J]. 植物生理学报, 2014, 50(7): 1009–1013. |
| [48] | 张兆元, 陈吉宝, 宋佳璘, 等. 野生大豆P5CS基因的克隆及对盐胁迫反应[J]. 植物遗传资源学报, 2014, (4): 844–849. |
| [49] | Wang G, Zhang JS, Wang GF, et al. Proline responding1 plays a critical role in regulating general protein synthesis and the cell cycle in maize[J]. The Plant Cell, 2014, 26(6): 2582–2600. |
| [50] | Ramadan AM, Hassanein SE. Characterization of P5CS gene in Calotropis procera plant from the de novo assembled transcriptome contigs of the high-throughput sequencing dataset[J]. Comptes Rendus Biologies, 2014, 337(12): 683–690. |
| [51] | 钟浩, 高贵宾, 潘雁红, 等. 绿竹P5CS基因的扩增及序列分析[J]. 安徽农业科学, 2015, 43(19): 25–29. |
| [52] | 刘静静, 曲延英, 姚正培, 等. 大蒜芥Δ'-吡咯啉-5-羧酸合成酶基因(P5CS)的克隆及表达分析[J]. 草业科学, 2015, 32(2): 210–216. |
| [53] | 王丽珊, 林清凡, 陈兰平, 等. 茶树P5CS基因克隆及其在渗透和高盐胁迫下的表达分析[J]. 热带作物学报, 2015, 36(1): 68–75. |
| [54] | 杨慧. 转P5CS基因冰草后代植株生物学特性观察与分子检测研究[D]. 呼和浩特:内蒙古农业大学, 2012. |
| [55] | 曹丽, 义鸣放, 孙振元, 等. 多年生黑麦草P5CS基因的定点突变及其在拟南芥中的转化[J]. 草业学报, 2011, 20(1): 242–247. |
| [56] | 陈吉宝, 赵丽英, 毛新国, 等. 转PvP5CS1基因拟南芥植株对干旱和盐胁迫的反应[J]. 作物学报, 2010, (1): 147–153. |
| [57] | 徐博, 任伟, 王英哲, 等. 农杆菌介导的朝鲜碱茅PuP5CS基因转化紫花苜蓿的研究[J]. 草业学报, 2015, (6): 895–901. |
| [58] | 杨云尧. 转MvP5CS和MvNHX1基因提高棉花抗旱性的研究[D]. 乌鲁木齐:新疆农业大学, 2012. |
| [59] | 李葵花, 高玉亮, 吴京姬. 转P5CS基因马铃薯“东农303"耐盐、抗旱性研究[J] 江苏农业科学, 2014, 42(11): 131–133. |
| [60] | Zhu B, Su J, Chang M, et al. Overexpression of a △1-pyrroline-5-carboxylate synthetase gene and analysis of tolerance to water- and salt-stress in transgenic rice[J]. Plant Sci, 1998, 139: 41–48. |
| [61] | Sawahel WA, Hassan AH. Generation of transgenic wheat plants producing high levels of the osmoprotectant proline[J]. Biotechnology Letters, 2002, 24(9): 721–725. |
| [62] | 韩素英, 张守攻, 汪泉, 等. 小叶杨Δ1-吡咯琳-5-羧酸合成酶(P5CS)基因克隆及在杂种落叶松中的转化[J]. 生物技术通报, 2006, (3): 88–92. |
| [63] | Dibax R, Deschamps C, Filho JCB, et al. Organogenesis and Agrobacterium tumefaciens-mediated transformation of Eucalyptus saligna with P5CS gene[J]. Biologia Plantarum, 2010, 1: 6–12. |
| [64] | Szabados L, Savouré A. Proline:a multifunctional amino acid[J]. Trends in Plant Science, 2010, 15: 89–97. |
| [65] | Singh R, Pandey N, Naskar J, et al. Physiological performance and differential expression profiling of genes associated with drought tolerance in contrasting varieties of two Gossypium species[J]. Protoplasma, 2015, 252(2): 423–438. |
| [66] | 陈志辉, 邹学校. 玉米抗旱机理与育种研究现状及发展趋势[J]. 湖南农业科学, 2007, (5): 63–66. |