2. 北京星航机电装备有限公司,北京 100074
2. Beijing Xinghang Mechanical-electrical Equipment Co., Ltd., Beijing 100074
微胶囊技术是一种利用成壁材料形成特定结构以隔离囊内外空间的技术,能够高效保护囊内物质免于外界不良环境的侵扰,被认为是目前最好的控制释放的载体工具之一。随着科学研究的不断发展,微胶囊技术的应用范围越来越广泛,包括药物控释、食品、环境、农业等领域[1]。近年来,蛋白质作为一种生物活性物质有越来越多的应用价值,尤其在生物医药领域,以蛋白质为基础的药物在诊断、治疗各种疾病中扮演重要角色。然而,蛋白质易降解、易失活的特点大大阻碍其发展。微胶囊技术可以将蛋白质(如牛血清白蛋白、胰岛素、杀虫晶体蛋白等)包埋于微胶囊内以保护蛋白活性,使其在特定环境发挥重要作用。本文综述了几种蛋白质微胶囊的制备方法,归纳了近年来利用微胶囊技术包封蛋白质的研究进展,为提高蛋白质的生物活性提供新思路。
1 利用层层自组装法制备蛋白质微胶囊层层自组装法(layer by layer,LbL)即利用带正、负电荷的物质通过静电相互作用层层交替沉积制备薄膜或胶囊的自组装技术,起源于1966年。后来,科学家们不断将这种技术拓展延伸,发展为利用分子间各种相互作用的自组装技术,如氢键[2]、共价键[3]和碱基互补作用[4]等。LbL技术的优点在于能够在纳米尺度上对胶囊的大小、形状、组成、厚度及结构形态等进行准确控制[5]。
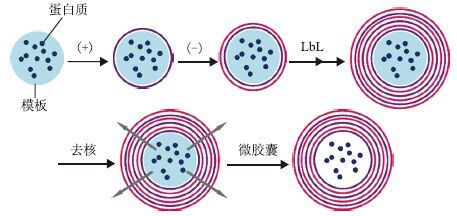
1.1 以蛋白质为核心的微胶囊 1.1.1 蛋白质与无机颗粒混合构成核心制备微胶囊许多研究者在微胶囊模板制备过程中将蛋白质与无机颗粒混合共同构成核心,然后利用带相反电荷的聚电解质进行层层沉积,去核后形成包封蛋白质的微胶囊(图 1)。
|
| 图 1 以蛋白质与无机颗粒混合为核心的微胶囊制备示意图 |
牛血清白蛋白(BSA)在微胶囊包封中是一种模式蛋白质药物,许多研究者都利用BSA来研究具有保护和控释性能的微胶囊。Shen等[1]在CaCO3与BSA共沉淀得到的模板上进行聚烯丙胺盐酸盐(PAH)和聚苯乙烯磺酸钠(PSS)层层自组装,去核并经热处理后得到包封BSA凝胶的微胶囊。BSA的等电点为pI4.8,在不同pH条件下能带相反电荷以吸引抗癌药物阿霉素(DOX)进入囊内,并且对DOX进行pH控释,实现了药物在胶囊内的积累和良好的pH控释性能。Wang等[6]在蛋白质(BSA、CAT)与CaCO3共沉淀得到的模板上包裹含有儿茶酚的海藻酸钠(AlgDA),去核过程中发生迈克尔加成和希夫碱反应形成超薄坚固的蛋白质微胶囊。CAT-AlgDA微胶囊具有耐酸、耐高温的优良特性,能够保护囊内蛋白质活性稳定。Volodkin等[7, 8]利用CaCO3多孔的特点通过物理吸附法使蛋白质自发聚集,制备聚电解质PAH/PSS微胶囊网络。因等电点和结构稳定性的不同,不同蛋白质在相同pH条件下的吸附量不同,该特点为操纵吸附-解吸附动力学提供工具,也为pH控释研究提供新方法。Endo等[9]以掺杂PSS-抗生物素蛋白的CaCO3为模板,去核后制备包封抗生物素蛋白的微胶囊。该微胶囊能够释放抗生物素蛋白,也能利用抗生物素蛋白吸引生物素进入囊内,并且在外界环境中加入生物素后而释放被装载的生物素,pH9.0时释放率最高。
Petrov等[10]分别利用物理吸附法和共沉淀法制备含不同蛋白质(BSA、α-胰凝乳蛋白酶、溶菌酶)的CaCO3模板并利用PAH和PSS制备微胶囊。研究发现,共沉淀法制备的模板更光滑,对蛋白质的吸附效率更高。同时,Labala等[11]也发现,共沉淀法制备的微胶囊更稳定,对BSA的包封率是物理吸附法的4倍。
壳聚糖是自然界中唯一大量存在的碱性多糖,天然无毒、具有生物相容性和生物可降解性且价格低廉,在造纸、材料、医药、食品等领域具有潜在的应用价值[12]。其 pKa大约为6.3[13],可以与多种天然阴离子生物材料形成聚电解质复合物。Shu等[14]以β-环糊精共轭的SiO2微球为模板来吸附BSA,而后利用硫酸葡聚糖和半胱胺共轭的壳聚糖进行层层沉积,氯胺T处理得到二硫键梯度交联的囊壁,去核后形成装载BSA的微胶囊。该微胶囊中每层壳聚糖上的巯基(SH)成递增趋势。模拟胃液(pH1.4)和细胞外环境(pH6.8)中的释放研究发现,BSA释放率很低,而加入谷胱甘肽(GSH)还原二硫键以破坏囊壁结构对于BSA的释放具有显著提升作用,同时二硫键还原后的微胶囊仍具有一定pH响应性。研究表明,该交联微胶囊能够增强蛋白质药物在酸性和生理pH环境中的稳定性,减少胃腔引起的蛋白质药物的损失,并在细胞内经GSH处理而释放药物。
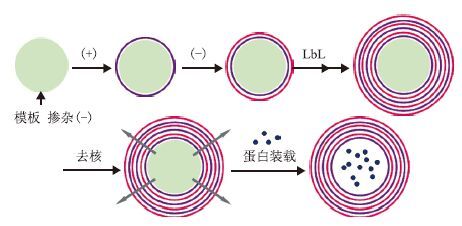
1.1.2 无机模板去除后装载蛋白质制备微胶囊另一种以蛋白质为核心的微胶囊制备方法即为将外部蛋白质装载进入中空微胶囊(图 2)。在药物控释领域,选择生物相容性和生物可降解性物质作为载药材料对研究者而言具有重要意义[15]。羧甲基纤维素钠(CMC)是一种廉价的纤维素多阴离子聚多糖衍生物,在制药和化妆品行业有广泛应用。Tripathy等[15]在掺杂CMC的CaCO3模板上通过LbL技术制备(PAH/CMC)2中空微胶囊,研究其对BSA的装载与释放能力。研究发现,微胶囊在pH3.5的酸性环境中能够大量装载BSA,而在pH7.4的中性环境因电荷排斥而大量释放BSA,实现了pH控制的装载与释放,使该微胶囊有望成为一种生物相容性智能药物载体。Shutava等[16]利用单宁酸和壳聚糖制备的包封蛋白质的纳米微胶囊也能够在pH驱动下对BSA进行装载与释放,这一特点利于药物封装与运输。
|
| 图 2 无机模板去除后装载蛋白质的微胶囊制备示意图 |
Studer等[17]利用聚二烯丙基二甲基氯化铵(PDADMAC)和PSS制备中空微胶囊装载抗生物素蛋白和抗生蛋白链菌素,通过电穿孔法导入细胞,在细胞内通过溶酶体释放胶囊内容物,构成一种蛋白质进入细胞的自动运输系统。Zheng等[18]利用PAH和Fe3O4制备控释胰岛素的高磁响应性多层微胶囊。该微胶囊对胰岛素的包封率达到92.08%±5.57%,能够在外部连续交变磁场中提高微胶囊透过性而大量释放胰岛素,而在无磁场情况下只有低于10%的释放量。本课题组的杨文慧(Yang)等[19]以掺杂PSS的CaCO3为模板制备(PAH/PSS)2-PAH中空微胶囊,在pH3.0时装载具有杀虫活性的苏云金芽胞杆菌Cry1Ac蛋白,在与靶标昆虫中肠环境相似的pH10.2环境中有效释放Cry1Ac蛋白,而该pH值在正常环境中极少存在。同时,该胶囊剂型能够有效抵抗环境压力,使囊内蛋白免于受到使其降解甚至失活的高温和干燥环境的影响,为蛋白质提供保护作用。
1.2 以蛋白质为壁材的微胶囊近年来,研究者不仅将蛋白质作为核心制备包封蛋白质的微胶囊,还将关注点放到了利用蛋白质、多糖、多肽等物质作为壁材包封在无机模板上制备聚电解质微胶囊的研究上[20]。
Endo等[21]以掺杂PSS的CaCO3为模板制备PAH/PSS-(抗生物素蛋白/PSS)5-PAH/PSS微胶囊,去核后利用生物素与抗生物素蛋白之间的相互作用高效装载生物素,并且固定小分子物质和功能性蛋白质。当外界环境中存在生物素时,被添加的生物素能够竞争性结合抗生物素蛋白的结合位点,因而释放囊内生物素。这种基于生物素-抗生物素蛋白相互作用的微胶囊能够推动功能型微胶囊的发展。An等[22]制备装载布洛芬的人血清白蛋白(HSA)/L-α-二肉豆蔻酰磷脂酸(DMPA)微胶囊。未包裹的药物在pH7.4环境中很快完全溶解,而微胶囊内的药物在相同环境中的溶解时间显著延长,并且随包封层数的增加而延长,表明微胶囊能够对布洛芬药物起到缓释作用。
1.3 核心与壁材均为蛋白质的微胶囊利用蛋白质或多肽作为壁材制备微胶囊来装载蛋白质可以提高微胶囊的生物相容性和生物可降解性。Zheng等[23]以载胰岛素的SiO2-NH2微球为模板利用壳聚糖与聚(L-天冬氨酸)间的二硫键制备的微胶囊能够在GSH存在的情况下释放囊内蛋白质,且释放量随GSH浓度升高而升高。该胶囊无细胞毒性,可以通过黏膜给药(如鼻、肠黏膜)改善糖尿病治疗。Zhao等[20]以具有生物降解性的聚(L-赖氨酸)和硫酸软骨素为壁材制备微胶囊,后用戊二醛对微胶囊进行共价交联以提高微胶囊稳定性。研究发现,在pH3.8时,微胶囊对BSA的装载量最大,而在pH7.4时释放60%BSA,且随时间延长,释放量增加。这种微胶囊可用于控制局部药物输送,在减少全身副作用和增加药物疗效方面有一定优势。Balabushevich等[24]制备硫酸葡聚糖/鱼精蛋白微胶囊,通过改变pH来调节过氧化物酶的装载与释放量,在生物分离系统具有潜在应用价值。本课题组的李峰(Li)等[25]以PAH与苏云金芽胞杆菌杀虫蛋白Cry8Ca2为壁材制备微胶囊,去核后进一步装载Cry8Ca2蛋白。该方法提高了杀虫蛋白的包封率,延长了活性蛋白的持效期,并且能够有效抵抗蛋白酶K对Cry8Ca2蛋白的降解。
Zhi等[26]以掺杂葡萄糖氧化酶(GOx)的CaCO3为模板,以多肽聚(L-赖氨酸)和聚(L-谷氨酸)为壁材制备的新型微胶囊在加入PEG300后能够有效提高胶囊对GOx的包封率,这种固有的具有生物相容性的微胶囊在生物医学领域的应用前景更加广阔。Yu等[27]也利用多孔SiO2微球吸附过氧化氢酶(CAT)作为模板,制备聚(L-赖氨酸)/聚(L-谷氨酸)微胶囊。研究发现,CAT在胶囊内能够保持56%的活性,并且改变pH条件和增加盐分能够改变胶囊透过性,从而释放蛋白质。
2 利用乳化法制备蛋白质微胶囊一种基于水相与油相结合的制备微胶囊的方法名为乳化法。蛋白质和多肽对环境非常敏感,易酶解、聚集、吸附和变性。其他物理因素包括大小、电荷和溶解度等也会对蛋白质和多肽吸附产生影响[28]。乳化法能够利用生物相容性材料对蛋白质实现有效包封,并防止囊内蛋白质失活。
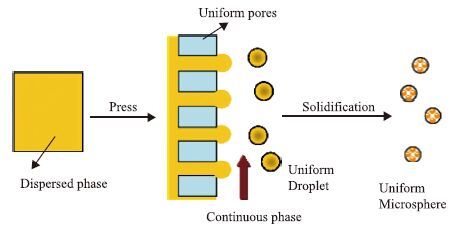
2.1 膜乳化法与复相乳化法膜乳化法是一种基于水/油乳液体系的膜乳化工艺(图 3)。Zhou等[30]以BSA为不连续相,以含有2wt%乳化剂Span 80的对苯二甲酰氯饱和甲苯溶液为连续相进行交联反应,蛋白质在水油界面交联而生成半透膜表面屏障,制备出包封BSA的微胶囊。囊内BSA无法从表面屏障渗出,而当引入胃蛋白酶后,胶囊表面因酰胺键断裂而被破坏,封装的BSA得以快速释放。Pessi等[28]通过双相流动制备水-油-水(W/O/W)双乳胶液滴微胶囊包封BSA。这种利用微流体技术制备的微胶囊对BSA的包封量能够达到84%±10.5%,这个值相比之前报道的包封量要高得多。同时,该胶囊也具有单分散性,孔隙率低,稳定性高的特点,在治疗性蛋白质的药物输送系统中具有很大潜力。Chen等[31]采用复相乳化法(双乳溶剂提取法)制备多氨基酸共聚物微胶囊包封BSA。研究表明,乳化剂Span 80与Tween 80的比例与浓度、外部水相中苯甲醇的加入、聚合物的浓度等都明显影响微胶囊的尺寸、形态和BSA包封率。阮传清等[32]以pH依赖的羟丙基甲基纤维素苯二甲酸酯(HPMCP)为壁材制备包封苏云金芽胞杆菌杀虫晶体蛋白的W/O/W肠溶性微胶囊。该微胶囊能够在与靶标昆虫中肠相似的pH8.5环境中快速崩解而释放杀虫晶体蛋白。黄珊珊等[33]以具有生物相容性的聚乳酸(PLA)和聚(乳酸-羟基乙酸)(PLGA)共聚物为材料,利用膜乳化与复相乳化结合的方法制备包封溶菌酶的微胶囊。制备过程中,溶菌酶在水油界面容易产生吸附变性而失活。加入添加剂PEG400等可以明显提高溶菌酶的包封率,并且有效减少活性损失,防止蛋白失活。
利用乳化法包封蛋白质药物的一大挑战是蛋白质/多肽在微胶囊制备、储存、释放过程中容易失活。究其原因是由于当接触油相、油/水界面或疏水性表面时,蛋白质容易发生折叠和聚集而失活[34]。此外,在乳液制备过程中,剪切力对蛋白质变性的影响也很大[35]。而这些变性的蛋白质很可能会造成不可预知的危害,包括毒性和免疫原性等[29]。为了防止蛋白质失活,研究者总结了一些策略[29]。对PLA/PLGA微胶囊而言,在W/O/W乳剂的水相中加入添加剂能够防止溶菌酶失活,这与黄珊珊的研究结果相一致;乙酸乙酯快速凝固技术可以有效缩短蛋白质在水油界面的接触时间,防止牛血红蛋白(BHb)失活;在疏水性PLA序列中引入亲水性序列聚乙二醇(PEG)构成PLA-PEG(PLEA)能够防止重组人生长激素(rhGH)接触疏水性材料,有效提高包封率和蛋白活性。对壳聚糖微胶囊而言,采用分步交联法可以防止蛋白质在制备过程中产生聚集,提高胰岛素释放量;温敏型的自固化系统可以替代化学交联而通过升温使壳聚糖交联成微胶囊,减少蛋白质聚集对BSA活性产生的影响;制备多孔壳聚糖微球吸附BSA可以提高蛋白质包封率,并且使蛋白质持续释放。
2.2 乳化/内部凝胶法乳化/内部凝胶法制备微胶囊使用的材料通常为海藻酸钠。海藻酸钠是一种具有生物相容性和生物可降解性的线性阴离子天然多糖类化合物,由古洛糖醛酸(G段)与其立体异构体甘露糖醛酸(M段)两种结构单元构成。其分子链上含有大量羧基,能与多种二价阳离子相互作用形成凝胶[12]。微胶囊制备过程中,包含目标蛋白的海藻酸钠溶液通过挤压形成液滴,然后进入二价交联溶液中,如Ca2+、Sr2+和Ba2+,诱导形成海藻酸钠凝胶微球[36];或者在海藻酸钠溶液中引入不溶性钙盐分散在油相中形成W/O乳液,而后通过油溶性酸进行酸化处理而使钙离子解离,最终与海藻酸钠反应形成凝胶[37]。
Silva等[37]利用乳化/内部凝胶法制备海藻酸钠凝胶微胶囊装载胰岛素,通过添加聚阴离子聚合物添加剂(硫酸纤维素、硫酸葡聚糖和多聚磷酸盐等)和在微胶囊表面增加壳聚糖涂层来加固微胶囊,提高胰岛素包封率,增强胰岛素对胃环境(pH 1.2)的抵抗力,并实现在肠道环境(pH 6.8)的持续释放。García-Gutiérrez等[38]将乳化/内部凝胶法应用于对苏云金芽胞杆菌杀虫晶体蛋白与芽胞集合体的包封,实现其对紫外辐射的有效抵抗。研究发现,微胶囊对UV-C短期照射有良好抵抗作用,能够使芽胞活性保持在90%以上;对于潮湿微胶囊样品,芽胞活性可在UV-B长期照射后保持在50%以上,而晶体活性也可保持在43%;但是干燥后再经UV-B长期照射会明显降低胞晶集合体的活性。
3 利用静电液滴生成法制备蛋白质微胶囊静电液滴生成技术是另一种利用海藻酸钠制备微胶囊的新型技术,即利用静电引力破坏毛细管和针尖之间的丝状液体,使之形成带电小液滴,制备凝胶珠。其优点在于操作可控可重复、粒径均一、在应力状态下制备,且不使用任何破坏蛋白活性的有机溶剂[39]。
Mi等[40]利用静电液滴生成技术成功制备N,O-羧甲基壳聚糖包裹的海藻酸钠微胶囊。即将含有BSA的海藻酸钠溶液注入到连接高电压直流装置的注射器内,而后挤压到CaCl2溶液中,促使Ca2+交联的海藻酸钠液滴形成包含BSA的海藻酸钙微粒。研究表明,N,O-羧甲基壳聚糖包裹的海藻酸钠微胶囊对pH的响应性优于原始的海藻酸钠微胶囊和壳聚糖包裹的海藻酸钠微胶囊。
4 利用其他方法制备蛋白质微胶囊王春蕾、崔学军(Cui)等[41, 42]采用声化学法,将BSA水相与含有磁性Fe3O4纳米粒子的油相结合,在水相和油相界面进行快速超声辐射,制备具有生物相容性和生物可降解性的磁性蛋白质微胶囊。该微胶囊能随磁铁方向发生定向移动,具有良好的磁性,并且可以继续装载疏水性药物,在磁性靶向药物运输方面将得到广泛应用。
5 结语蛋白质是一种具有生物活性的大分子物质,对生物体生长发育起重要作用。基于其具有的多种生理功能,近年来科学家越来越关注于对蛋白质药物的研究,无论是生物医药领域,还是生物农药领域。然而,蛋白质活性的保持对环境的pH值要求很严格,强酸或强碱都会引起变性失活。聚电解质微胶囊因其良好的基于pH控制的装载与释放性能而迅速发展,将其运用于对蛋白质药物的保护不仅具有高效包封率、提高了蛋白质的活性,更扩大了蛋白质的应用范围,使其可以与其他药物在微胶囊内结合,释放后共同发挥作用。另外,在生物农药领域,包封在微胶囊内的蛋白类农药能够有效抵抗外界多种不良环境,促进了生物农药的扩大发展。
现研究的蛋白质微胶囊也存在一定技术性问题,如有些制备方法较繁琐[6]、有机溶剂的参与和去核时的pH变化易导致蛋白质变性[6-8, 20, 31]、静电吸引制备的微胶囊由于结合力弱易造成模板破裂[23]等。因此,有效解决微胶囊制备过程中所面临的技术性难题,在更加温和的条件下采用生物相容性和生物可降解性材料封装蛋白质等生物活性材料可以保证蛋白质结构稳定,最大限度减少蛋白质变性、暴露等[6, 7, 31, 37],同时,采用共价键、氢键等键键结合的方式进行微胶囊制备可以提高胶囊稳定性,实现有效控释[23]。
蛋白质微胶囊因其高效的蛋白质包封率和良好的pH控释性能而得到飞速发展,在理论研究方面成果丰硕,在商业应用方面也初露锋芒。相信随着科学技术的不断发展,蛋白质微胶囊一定会向产业化方向高速进军。
| [1] | Shen HJ, Shi H, Ma K, et al. Polyelectrolyte capsules packaging BSA gels for pH-controlled drug loading and release and their antitumor activity[J]. Acta Biomater, 2013, 9(4): 6123–6133. |
| [2] | Kozlovskaya V, Sukhishvili SA. Amphoteric hydrogel capsules:multiple encapsulation and release routes[J]. Macromolecules, 2006, 39(18): 6191–6199. |
| [3] | Saurer EM, Flessner RM, Buck ME, et al. Fabrication of covalently crosslinked and amine-reactive microcapsules by reactive layer-by-layer assembly of azlactone-containing polymer multilayers on sacrificial microparticle templates[J]. J Mater Chem, 2011, 21(6): 1736–1745. |
| [4] | Cavalieri F, Postma A, Lee L, et al. Assembly and functionalization of DNA-polymer microcapsules[J]. ACS Nano, 2009, 3(1): 234–240. |
| [5] | Caruso F. Hollow capsule processing through colloidal templating and self-assembly[J]. Chem Eur J, 2000, 6(3): 413–419. |
| [6] | Wang XL, Shi JF, Jiang ZY, et al. Preparation of ultrathin, robust protein microcapsules through template-mediated interfacial reaction between amine and catechol groups[J]. Biomacromolecules, 2013, 14(11): 3861–3869. |
| [7] | Volodkin DV, Larionova NI, Sukhorukov GB. Protein encapsulation via porous CaCO3 microparticles templating[J]. Biomacromolecu-les, 2004, 5(5): 1962–1972. |
| [8] | Volodkin DV, Petrov AI, Prevot M, et al. Matrix polyelectrolyte microcapsules:new system for macromolecule encapsulation[J]. Langmuir, 2004, 20(8): 3398–3406. |
| [9] | Endo Y, Sato K, Anzai J. Preparation of avidin-containing polyelectrolyte microcapsules and their uptake and release properties[J]. Polym Bull, 2011, 66(5): 711–720. |
| [10] | Petrov AI, Volodkin DV, Sukhorukov GB. Protein-calcium carbonate coprecipitation:a tool for protein encapsulation[J]. Biotechnol Prog, 2005, 21(3): 918–925. |
| [11] | Labala S, Mandapalli PK, Bhatnagar S, et al. Encapsulation of albumin in self-assembled layer-by-layer microcapsules:comparison of co-precipitation and adsorption techniques[J]. Drug Dev Ind Pharm, 2015, 41(8): 1302–1310. |
| [12] | 占英英.可控制释放微胶囊的制备和释放性能研究[D].哈尔滨:东北农业大学, 2010. |
| [13] | Simsek-Ege FA, Bond GM, Stringer J. Polyelectrolyte complex formation between alginate and chitosan as a function of pH[J]. J Appl Polym Sci, 2003, 88(2): 346–351. |
| [14] | Shu SJ, Zhang XG, Wu ZM, et al. Gradient cross-linked biodegradable polyelectrolyte nanocapsules for intracellular protein drug delivery[J]. Biomaterials, 2010, 31(23): 6039–6049. |
| [15] | Tripathy J, Raichur AM. Designing carboxymethyl cellulose based layer-by-layer capsules as a carrier for protein delivery[J]. Colloids Surf B Biointerfaces, 2013, 101: 487–492. |
| [16] | Shutava TG, Lvov YM. Nano-engineered microcapsules of tannic acid and chitosan for protein encapsulation[J]. J Nanosci Nanotechnol, 2006, 6(6): 1655–1661. |
| [17] | Studer D, Palankar R, Bédard M, et al. Retrieval of a metabolite from cells with polyelectrolyte microcapsules[J]. Small, 2010, 6(21): 2412–2419. |
| [18] | Zheng C, Ding YJ, Liu XQ, et al. Highly magneto-responsive multilayer microcapsules for controlled release of insulin[J]. Int J Pharm, 2014, 475(1-2): 17–24. |
| [19] | Yang WH, He KL, Zhang J, et al. pH-controlled Bacillus thuringie-nsis Cry1Ac protoxin loading and release from polyelectrolyte microcapsules[J]. PLoS One, 2012, 7(9): e45233. |
| [20] | Zhao QH, Li BY. pH-controlled drug loading and release from biodegradable microcapsules[J]. Nanomed-Nanotechnol, 2008, 4(4): 302–310. |
| [21] | Endo Y, Sato K, Sugimoto K, et al. Avidin/PSS membrane microcapsules with biotin-binding activity[J]. J Colloid Interf Sci, 2011, 360(2): 519–524. |
| [22] | An ZH, Lu G, M?hwald H, et al. Self-assembly of human serum albumin(HAS)and L-α-dimyristoylphosphatidic acid(DMPA)microcapsules for controlled drug release[J]. Chem Eur J, 2004, 10(22): 5848–5852. |
| [23] | Zheng C, Zhang XG, Sun L, et al. Biodegradable and redox-responsive chitosan/poly(L-aspartic acid)submicron capsules for transmucosal delivery of proteins and peptides[J]. J Mater Sci:Mater Med, 2013, 24(4): 931–939. |
| [24] | Balabushevich NG, Tiourina OP, Volodkin DV, et al. Loading the multilayer dextran sulfate/protamine microsized capsules with peroxidase[J]. Biomacromolecules, 2003, 4(5): 1191–1197. |
| [25] | Li F, Yan Y, Wang DD, et al. Cry8Ca2-containing layer-by-layer microcapsules for the pH-controlled release of crystal protein[J]. J Microencapsul, 2014, 31(6): 567–572. |
| [26] | Zhi ZL, Haynie DT. High-capacity functional protein encapsulation in nanoengineered polypeptide microcapsules[J]. Chem Commun(Camb), 2006, 14(2): 147–149. |
| [27] | Yu AM, Wang YJ, Barlow E, et al. Mesoporous silica particles as templates for preparing enzyme-loaded biocompatible microcapsules[J]. Adv Mater, 2005, 17(14): 1737–1741. |
| [28] | Pessi J, Santos HA, Miroshnyk I, et al. Microfluidics-assisted engineering of polymeric microcapsules with high encapsulation efficiency for protein drug delivery[J]. Int J Pharm, 2014, 472(1-2): 82–87. |
| [29] | Ma GH. Microencapsulation of protein drugs for drug delivery:Strategy, preparation, and applications[J]. J Control Release, 2014, 193: 324–340. |
| [30] | Zhou JH, Hyun DC, Liu H, et al. Protein capsules with cross-linked, semipermeable, and enzyme-degradable surface barriers for controlled release[J]. Macromol Rapid Commun, 2014, 35(16): 1436–1442. |
| [31] | Chen XT, Lv GY, Zhang J, et al. Preparation and properties of BSA-loaded microspheres based on multi-(amino acid)copolymer for protein delivery[J]. Int J Nanomed, 2014, 9(1): 1957–1965. |
| [32] | 阮传清, 刘芸, 张明政, 等. Bt杀虫晶体蛋白-肠溶性微囊制备方法的初步研究[J]. 中国农学通报, 2008, 24(11): 374–378. |
| [33] | 黄珊珊, 刘荣, 马光辉, 等. 膜乳化法与复乳法结合制备粒径均一的载溶菌酶微胶囊[J]. 过程工程学报, 2006, 6(4): 603–607. |
| [34] | Morlock M, Koll H, Winter G, et al. Microencapsulation of rh-eryt-hropoietin, using biodegradable poly(d, l-lactide-co-glycolide):protein stability and the effects of stabilizing excipients[J]. Eur J Pharm Biopharm, 1997, 43(1): 29–36. |
| [35] | Meng FT, Zhang WZ, Ma GH, et al. The preparation and characterization of monomethoxy-poly(ethylene glycol)-b-poly-DL-lactide microcapsules containing bovine hemoglobin[J]. Artif Cells Blood Substit Immobil Biotechnol, 2003, 31(3): 279–292. |
| [36] | Gombotz WR, Wee SF. Protein release from alginate matrices[J]. Adv Drug Deliv Rev, 1998, 31(3): 267–285. |
| [37] | Silva CM, Ribeiro AJ, Ferreira D, et al. Insulin encapsulation in reinforced alginate microspheres prepared by internal gelation[J]. Eur J Pharm Sci, 2006, 29(2): 148–159. |
| [38] | García-Gutiérrez K, Poggi-Varaldo HM, Esparza-García F, et al. Small microcapsules of crystal proteins and spores of Bacillus thuringiensis by an emulsification/internal gelation method[J]. Bioprocess Biosyst Eng, 2011, 34(6): 701–708. |
| [39] | Manojlovic V, Djonlagic J, Obradovic B, et al. Immobilization of cells by electrostatic droplet generation:a model system for potential application in medicine[J]. Int J Nanomedicine, 2006, 1(2): 163–171. |
| [40] | Mi Y, Su R, Fan DD, et al. Preparation of N, O-carboxymethyl chitosan coated alginate microcapsules and their application to Bifidobacterium longum BIOMA 5920[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(5): 3047–3053. |
| [41] | 王春蕾, 闫俊涛, 钟双玲, 等. 磁性蛋白质微胶囊的声化学法构筑[J]. 高等学校化学学报, 2013, 34(2): 462–466. |
| [42] | Cui XJ, Li ZF, Zhong SL, et al. A facile sonochemical route for the fabrication of magnetic protein microcapsules for targeted delivery[J]. Chem Eur J, 2013, 19(29): 9485–9488. |