黑色素瘤是一类高转移性恶性肿瘤,严重威胁人类的生命安全。弱免疫原性及丰富的肿瘤外周血管生成是黑色素瘤的两大特征,也是实体肿瘤细胞逃避机体免疫监视及获取充足营养的两条重要途径[1]。因而设计新治疗策略同时增强对黑色素瘤的免疫杀伤效应及阻断肿瘤外周血管生成对治疗黑色素瘤有重要临床意义。
天花粉蛋白(Trichosanthin,TCS)是一种提取自栝楼块根中的碱性单链核糖体失活蛋白(Ribosome inactivating protein,RIP),其N-糖苷酶活性,能水解断裂真核细胞核糖体28S rRNA 腺苷酸的N-C 糖苷键,不可逆失活核糖体,从而抑制蛋白质的合成[2]。大量研究数据表明天花粉蛋白具有正向免疫调节作用,能促进多种肿瘤细胞凋亡[3-6]。YH-16,又名恩度,是一类来源于血管基底膜胶原的大分子膜蛋白,由基质金属蛋白酶水解释放得到,已被成功开发并应用于非小细胞肺癌的治疗,其作用机制是抑制肿瘤的血管生成,切断肿瘤细胞能量及营养供应,从而达到治疗肿瘤的效果[7, 8]。
据此,本研究借助基因工程方法重组表达天花粉蛋白并分析其对黑色素瘤细胞的增殖及体内成瘤的影响,同时考察天花粉蛋白与YH-16联合用药对黑色素瘤的治疗效果,以期为开发黑色素瘤治疗提供新的契机。
1 材料与方法 1.1 材料 1.1.1 细胞株、实验动物黑色素瘤细胞B16购自中科院上海细胞所;C57BL/6小鼠,雌性,6-8周龄购自南京医科大学动物中心。
1.1.2 主要试剂蛋白胨、酵母粉、氯化钠、诱导剂IPTG与双抗(100 μg/mL的链霉素、100 U/mL的青霉素)购自上海生工生物工程公司;YH-16购自烟台麦得津生物公司;抗TCS抗体购自Santa Cruz公司;RPMI-1640培养基、胎牛血清(Fetal bovine serum,FBS)购自美国Invitrogen公司;MTT(methylthiazolyl tetrazolium)购自美国Fluka公司;胰RNase购自美国Sigma公司;DH5α及BL21细胞购自南京天根生物有限公司;Taq酶购自大连宝生物公司。
1.2 方法 1.2.1 表达载体pET22b-rTCS的构建设计引物PF、PR,在其两端分别添加Nde Ⅰ及Nhe Ⅰ酶切位点,以本实验室保存的质粒pbs-rTCS为模板,PCR扩增rTCS基因片段并进行T-A克隆。经酶切鉴定及DNA测序得到正确质粒pMD18T-rTCS;然后用Nde Ⅰ及Nhe Ⅰ酶同时处理质粒pMD18T-rTCS与pET-22b,胶回收目的片段,并经T4 ligase连接过夜。转化BL21细胞,筛选阳性菌株。
1.2.2 重组rTCS的表达、纯化及Western blot鉴定随机挑选几个单克隆,分别以2 mL LB培养基37℃,250 r/min震荡培养过夜,然后按照1%转接至50 mL LB培养基中,继续培养至吸光度OD600达到0.6-0.8时加入诱导剂IPTG至终浓度0.42 mmol/L,继续诱导5 h取样1 mL离心、收集菌体。加入70 μL水及15 μL 5×上样缓冲液,沸水浴5 min,离心2 min,SDS-PAGE检测目的蛋白表达。
以镍柱纯化重组天花粉蛋白rTCS,具体如下:取3 mL镍柱填料装柱,以5倍柱体积去离子水冲洗,以5倍柱体积磷酸盐缓冲液平衡,进样,收集穿透液。再以10 mL含50、100和200 mmol/L咪唑的磷酸盐缓冲液依次线性过柱并收集洗脱液。最后以5倍柱体积去离子水洗脱柱并保存在20%乙醇溶液中,于4℃放置。
以抗天花粉蛋白抗体鉴定重组表达的rTCS。对rTCS进行SDS-PAGE电泳分析并剪下含rTCS的胶条,转膜250 mA恒流转30 min;电转完成后取下PVDF膜并作好标记置于含5%的脱脂奶粉(TBS配制)中封闭,37℃,1 h低速震荡。加入一抗(用封闭液稀释),4℃摇床孵育过夜。弃一抗溶液,用TB-ST洗涤5 min左右,3次。加入二抗(用TBS稀释),室温下于摇床孵育1 h。弃二抗溶液,用TBST洗涤5 min左右,3次。以ECL法检测特异结合的抗体,对照Marker记录实验结果,将X胶片晾干扫描保存。
1.2.3 MTT法检测细胞活力取对数生长期B16-F10细胞接种于96孔板中,接种密度为每孔100 μL含1×104个细胞,每组设置3个复孔。于37℃、5% CO2培养箱中培养12 h后分别加入不同浓度的重组rTCS继续培养48 h,对照组加等体积PBS。培养结束后,每孔加入10 μL浓度为5 mg/mL的 MTT,37℃继续温育4 h。吸去上清液,每孔加入100 μL DMSO,室温震荡溶解结晶10 min。于570 nm(吸收波长)和630 nm(参比波长)处测吸光光度值。计算细胞存活率,公式如下:
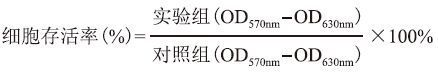
调整B16-F10细胞密度为1×107/mL,经小鼠腹部皮下注射0.1 mL细胞悬液,从第6天开始,小鼠随机分为3组(6只每组)给药:rTCS组(5 mg/kg/day,i.p.)、rTCS(5 mg/kg/day,i.p.)+YH-16组(1 mg/kg/day,i.p.)及等量PBS对照组,隔天给药7次,至第18天处死小鼠剥瘤,测量瘤体积V=ab2/2(a为长度,b为宽度)。
1.2.5 统计分析实验数据采用spss16.0处理,数据差异采用t检验,显著性差异P<0.05。
2 结果 2.1 构建重组表达质粒pET22b-rTCS经过PCR扩增、两步酶切、连接及验证,天花粉蛋白基因编码区(CDS区)被成功插入表达载体pET-22b(图 1-A),DNA测序进一步证明该克隆的rTCS序列与NCBI数据库中报道序列完全一致。
|
| 图 1 rTCS的表达、纯化及鉴定 A:Pst Ⅰ酶切阳性克隆,得到一个单一条带表示克隆含有TCS的CDS区,1,2:分别代表不同的DNA上样量;B:阳性菌的诱导表达,1,2:分别代表空载体转染、阳性质粒转染克隆的表达;C:亲和纯化rTCS,1-3:分别代表咪唑线性浓度;D:免疫印迹鉴定rTCS,1-3:分别代表3个克隆表达后的印迹< |
如图 1-B,重组天花粉蛋白rTCS在BL21工程菌中经过0.42 mmol/L IPTG诱导5 h后得到高效表达,表达量达到200 mg/L,而且rTCS是可溶性表达。与NCBI数据库中报道一致,rTCS分子量在30 kD左右,其电泳条带位于25-35 kD之间。
经0-200 mmol/L咪唑线性浓度洗脱,在120 mmol/L咪唑浓度处rTCS被成功洗脱,纯度达到电泳纯(图 1-C)。进一步免疫印迹实验(图 1-D)表明纯化的蛋白即是rTCS。
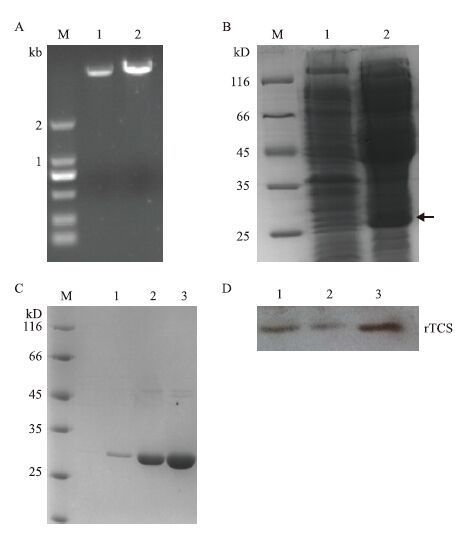
2.3 重组rTCS抑制黑色素瘤细胞B16-F10增殖研究报道天花粉蛋白能抑制肺癌细胞及乳腺癌细胞MCF-7的增殖、促进HeLa、HL-60细胞的凋亡[3-6,9,10]。如图 2-A,与对照PBS组相比,rTCS对黑色素瘤细胞B16-F10的生长有显著抑制作用。在120 µg/mL时,rTCS对B16-F10细胞的生长抑制率达到约60%,在480 µg/mL时,其抑制率为95.3%。因此,rTCS对B16-F10细胞的抑制效应呈现剂量依赖性。
|
| 图 2 rTCS与YH-16对黑色素瘤细胞B16-F10的抑制效应 A:rTCS抑制B16-F10细胞增殖并呈现剂量依赖性;B:120 µg/mL rTCS联合5 µg/mL YH-16对B16-F10细胞增殖的抑制率与rTCS单一处理并无显著性差异 |
YH-16已经被用于治疗小细胞肺癌患者。我们的体外实验数据发现120 µg/mL rTCS对B16-F10细胞的抑制率显著高于5 µg/mL YH-16单独处理组(54.7% vs 33.7%),但是120 µg/mL rTCS联合5 µg/mL YH-16处理组对B16-F10细胞的抑制率约60.4%,与rTCS单独处理组无显著性差异(图 2-B)。
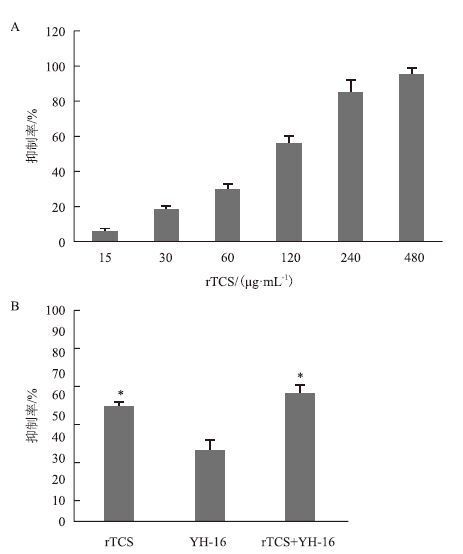
2.4 重组TCS联合YH-16对荷B16-F10瘤体生长的作用黑色素瘤细胞B16-F10移植瘤小鼠实验(图 3)显示,相对于PBS对照组,rTCS处理组及rTCS+YH-16联合处理组的肿瘤生长明显被阻滞。从接种第6天开始给药,第12天时,rTCS处理组及rTCS+YH-16联合处理组的肿瘤体积显著小于对照组,并且联合处理组比rTCS组瘤体积也明显减小。第18天时,处死小鼠后对瘤体称重发现,rTCS单独处理组瘤体仅15 mg左右,而联合处理组基本无肉眼可见瘤体。
|
| 图 3 rTCS抑制B16-F10细胞裸鼠体内成瘤 |
在给药第12天开始,rTCS单独处理组及与YH-16联合用药组显著抑制B16-F10细胞在裸鼠体内成瘤。而且联合处理组在第18天时基本无可触及的瘤体。
3 讨论黑色素瘤是一类转移性极高的恶性肿瘤,尽管历经几十年的治疗,人类对该病的治疗手段主要还是手术、放化疗。而这些传统方法虽然有一定疗效,但是其给患者带来痛苦的副作用。进入新世纪,人们发现肿瘤是一类高异质性疾病,多种因素都能引发肿瘤的发生、发展。其中肿瘤的免疫原性降低与大量的血管供应对促进肿瘤的发生、发展有重要作用。因此研究人员开发了一系列增强肿瘤患者免疫能力以及减少血管生成的药物,如白介素IL-2、GM-CSF、TCS、YH-16等[4, 7, 11, 12]。
针对肿瘤的多方面诱导因素,研究人员开展了联合治疗研究,该策略可以靶向肿瘤的多个靶点,从而达到更强效、更彻底治疗肿瘤的目的。研究数据也证实化疗与免疫治疗、两种免疫治疗、抗血管生成治疗与免疫治疗的联合策略显示了单一疗法没有的优势[12-14]。
本研究中的天花粉蛋白rTCS具有正向免疫调控的作用,对多种肿瘤细胞都显示了较强的抑制生长作用,而且天花粉蛋白能诱导多种肿瘤细胞的凋亡[6]。而YH-16已成功上市,其机理就是抑制肿瘤的血管生成[7]。因此本研究采用联合治疗策略,同时给药rTCS与YH-16,希望能促进肿瘤免疫杀伤与抑制血管生成。实验结果证实相对单一的治疗,联合用药组显示更强的抑制肿瘤生长的作用,并且能降低用药剂量,即降低rTCS剂量,这将有助于降低rTCS导致的毒性副作用。研究表明YH-16作用机制是阻断血管生成,切断肿瘤生长的营养供应,抑制肿瘤生长。因此在本研究中rTCS与YH-16联合处理组在细胞水平并没有显著的协同效应也是合理的。而体内实验表明YH-16与rTCS之间对肿瘤抑制具有协同效应。
然而,目前的数据仅表明联合用药对肿瘤生长的抑制作用,尚需要更多研究进行微血管密度的测定、免疫细胞类型的分析,从而为解释联合用药的机制提供信息以及为肿瘤治疗性研究提供更好的理论指导。
4 结论本研究以基因重组技术获得了电泳纯的天花粉蛋白,通过体外及体内实验发现其对黑色素瘤细胞B16-F10的增殖及小鼠体内成瘤均有很强的抑制作用,而且天花粉蛋白可以协同YH-16抑制黑色素瘤细胞增殖。
| [1] | Sanlorenzo M, Vujic I, Posch C, et al. Melanoma immunotherapy[J]. Cancer Biol Ther, 2014, 15(6): 85–92. |
| [2] | Shaw PC, Chan WL, Yeung HW, et al. Minireview:Trichosanthin-a protein with multiple pharmacological properties[J]. Life Sci, 1994, 55(4): 253–262. |
| [3] | Wang P, Xu J, Zhang C, et al. CREB, a possible upstream regulator of Bcl-2 in Trichosanthin -induced Hela cell apoptosis[J]. Mol Biol Rep, 2010, 37(4): 1891–1896. |
| [4] | 熊高准, 楼建国. 天花粉蛋白对结肠癌SW-620细胞株增殖、黏附和迁移的实验研究[J]. 中成药, 2012, 34(3): 434–439. |
| [5] | 赵爽, 郝雪峰. 根癌农杆菌介导天花粉蛋白基因TCS转化茎瘤芥的研究[J]. 生物技术通报, 2010, (3): 124–127. |
| [6] | 郭栋, 韩冰冰. 天花粉蛋白对黑色素瘤细胞黏附、迁移及侵袭能力的影响[J]. 辽宁中医杂志, 2013, 40(9): 1932–1935. |
| [7] | Rong B, Yang S, Li W, et al. Systematic review and meta-analysis of Endostar combined with chemotherapy versus chemotherapy alone for treating advanced non-small cell lung cancer[J]. World J Surg Oncol, 2012, 24(10): 170. |
| [8] | Rosca EV, Koskimaki JE, Rivera CG, et al. Anti-angiogenic peptides for cancer therapeutics[J]. Curr Pharm Biotechnol, 2011, 12(8): 1101–1116. |
| [9] | Fang EF, Zhang CZY, Zhang L, et al. Trichosanthin inhibits breast cancer cell proliferation in both cell lines and nude mice by promotion of apoptosis[J]. PLoS One, 2012, 7(9): e41592. |
| [10] | Cai YC, Xiong SD, Zheng YJ, et al. Trichosanthin enhances anti-tumor immune response in a murine Lewis lung cancer model by boosting the interaction between TSLC1 and CRTAM[J]. Cellular & Molecular Immunology, 2011, 8: 359–367. |
| [11] | Eisenberg S. Biologic therapy[J]. Journal of Infusion Nursing, 2012, 35(5): 301–314. |
| [12] | Kontermann RE. Antibody-cytokine fusion proteins[J]. Archives of Biochemistry and Biophysics, 2012, 526: 194–205. |
| [13] | Drake CG. Combination immunotherapy approaches[J]. Annals of Oncology, 2012, 23(8): 41–46. |
| [14] | Baxevanis CN, Perez SA, Papamichail M. Combinatorial treatments including vaccines, chemotherapy and monoclonal antibodies for cancer therapy[J]. Cancer Immunol Immunother, 2009, 58: 317–332. |



