黑皮质素受体家族成员(MCRs)均属于G蛋白偶联受体(GPCRs),具有经典的七跨膜结构,但家族成员间功能差异较大。其中MC1R主要作用是调节色素的合成和沉着,与动物皮毛的颜色相关,其突变体R160W与红发表型的发生具有较高相关性[1]。MC2R与家族性糖皮质激素缺乏症(FGD)的发生密切相关,但其功能性发挥必须依赖于辅助蛋白MRAP的帮助[2]。MC3R与能量代谢相关,其突变体I335S便是从肥胖表型的病人体内鉴定出来的[3]。MC4R的功能是调控食物摄取,其突变体是最常见的引发单基因肥胖的形式[4],如N62S[5]与P78L[6]。MC5R是一种与内分泌功能相关的跨膜受体,目前研究较少[7]。
研究显示胞内留存型突变受体是引起相关GPCRs疾病的主要形式,目前利用药学伴侣分子对缺陷型GPCRs进行功能拯救是一大研究热点且已有许多GPCRs药学伴侣分子被开发。值得一提的是SR49059,能够作为后叶加压素受体V2R特异性的药学伴侣分子拯救其内质网留存型突变受体[8],临床应用结果也清楚的显示其可显著性改善肾原性尿崩症(NDI)患者的肾功能[9]。而目前国内外对于MC4R突变受体的药理学伴侣分子的研究仍处于起步阶段。2004年Vos团队[10]首次合成了一种非肽类可穿膜小分子ML00253764,被证明是MC4R的反向激动剂。我们之前的研究结果显示ML00253764可以对MC4R内质网留存型突变受体(C84R和W174C)进行拯救[11],但其拯救MC4R突变受体的作用特性及其与黑皮质素受体其他成员间的关系仍不清楚。本研究通过构建细胞表达模型并结合流式细胞术探究ML00253764对黑皮质素受体的膜定位拯救及拯救后受体内化动力学的变化情况,并针对其作用方式与内源性配体进行比较,以详细的阐明药学伴侣分子ML00253764对MC4R突变受体专一靶向性拯救的作用特性,旨为潜在的抗肥胖药物前体分子的开发研究提供理论依据。
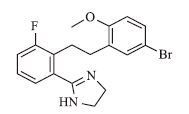
1 材料与方法 1.1 材料黑皮质素受体的cDNA均购于上海吉凯基因化学技术有限公司。药物分子ML00253764化学名称为(2-[2-[2-(5-溴-2-甲氧基苯基)-乙基]-3-氟苯基]-4,5-二氢-1H-咪唑),其结构通式见图 1,由天津科技大学中法食品营养与药物化学联合实验室合成。
|
| 图 1 ML00253764结构式 |
pcDNA3.1-HA-MCRs以质粒pcDNA3.1(+)为表达载体,上游添加EcoR I或Hind III限制性酶切位点,下游添加Xba Ⅰ或EcoR Ⅰ限制性酶切位点,并在其多克隆位点插入流感病毒血凝素(HA)序列和相应的人黑皮质素受体基因的编码区序列构建所得。突变型表达载体以pcDNA3.1-HA-MCRs为模板,通过PCR引入突变位点,产物去甲基化后转化进入大肠杆菌扩增,测序得到正确的突变表达载体,引物见表 1。
人源胚胎肾细胞HEK293采用10%胎牛血清,1%青链霉素及高糖DMEM培养基37℃,5% CO2条件下培养。细胞如Wang等[12]所述转染选择80%融合度,磷酸钙共沉淀法进行,随后用浓度为500 μg/mL的G418进行筛选,期间更换培养液,一个月左右获得包括阴性对照pcDNA3.1在内的各种稳定表达细胞系。
1.2.3 流式细胞术测定细胞膜表面表达贴壁细胞加入药物或空白缓冲液处理,PBS清洗3遍,5%BSA/PBS封闭1 h,终止非特异性反应,避光孵育FITC标记的Anti-HA抗体1 h,然后用PBS轻柔地冲洗5遍,进行流式细胞术实验测定,操作均在低温进行。以空载体pcDNA3.1的细胞系为阴性对照,以[MCRs-Mutant-pcDNA3.1]/[MCRs-WT-pcDNA3.1]×100%计算,实验中设定未加药处理的野生型受体细胞膜表达水平为100%,每个实验做3个平行重复。
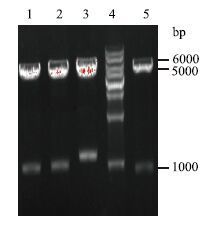
2 结果 2.1 表达载体构建结果鉴定表达载体构建完成后利用0.8%琼脂糖凝胶进行双酶切电泳验证,结果(图 2)显示,两条电泳条带分别为载体pcDNA3.1(5 400 bp)及黑皮质素受体目的片段大小,送样测序,结果分析表明载体构建正确。利用构建好的表达载体为模板进行点突变,PCR反应条件:95℃ 30 s;95℃ 30 s,55-58℃ 1 min,68℃ 13 min,15个循环;68℃ 10 min。PCR产物去甲基化转化扩增后送样测序,结果显示突变位点正确。
|
| 图 2 表达载体构建双酶切验证结果 1:MC4R-WT(1026 bp);2:MC5R-WT(1005 bp);3:MC3R-WT(1110 bp);4:TransGen 1 kb Marker;5:MC1R-WT(981 bp) |
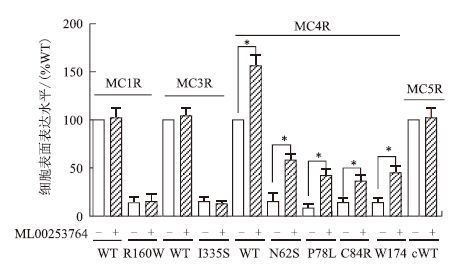
ML00253764介导的MCRs及其突变体细胞膜表面表达水平的结果(图 3)显示,在加入10-5mol/L ML00253764处理12 h后,MC4R-WT及其突变体的细胞膜表面表达水平都发生显著性提高(P<0.05)。其中MC4R-WT提高到156%,突变受体中MC4R-N62S从15%上升到58%,MC4R-P78L从8%上升到42%,而MC4R-C84R从14%上升到36%,MC4R-W174C从14%上升到45%,与未加药处理条件下相比分别提高了43%、34%、22%与31%。但其他野生型黑皮质素受体MC1R、MC3R、MC5R及突变体MC1R-R160W、MC3R-I335S在加药与不加药处理情况下细胞膜表面受体量均未发生明显变化,缺陷型突变体仍只有其相应野生型水平的15%左右。说明ML00253764只能特异性的作为MC4R的药学伴侣分子提高其突变受体的表面表达水平,并且其拯救能力具有突变受体特异性特征。
|
| 图 3 ML00253764介导的细胞膜表面表达水平的测定 *表示差异显著(P<0.05) |
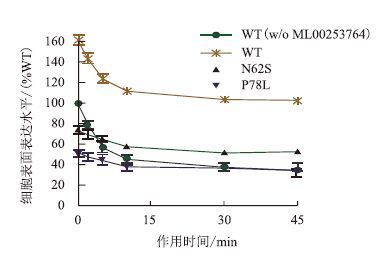
内化作用是受体自身的调节功能,是鉴定受体能否发挥正常功能的一大指标。研究中测定了ML00253764(10-4 mol/L)拯救处理24 h后MC4R-WT及其突变体在激动剂α-MSH(10-6 mol/L)作用0-45 min内膜表面受体随时间的变化情况,并以不加ML00253764处理的野生型受体(w/o)为对照,进行结果分析。如图 4所示,随着作用时间的增加,不管是野生型还是突变型受体均开始出现内化,其中MC4R-N62S的最大内化水平达到21%,MC4R-P78L为16%,而野生型受体在未加药条件下达到65%,加药处理后达到59%,由此看来不同突变受体的内化水平具有一定的突变体特异性特征。而且不同突变受体达到最大内化水平一半所需的时间t1/2也略有差异,MC4R-N62S(5.69 min)>MC4R-P78L(5.33 min)>MC4R-WT(3.47 min)>MC4R-WT(w/o)(3.27 min),但该差异并无显著性,说明经拯救到达细胞膜表面的缺陷型受体与野生型受体的内化作用基本相同。
|
| 图 4 ML00253764介导的MC4R及其突变体内化动力学分析 |
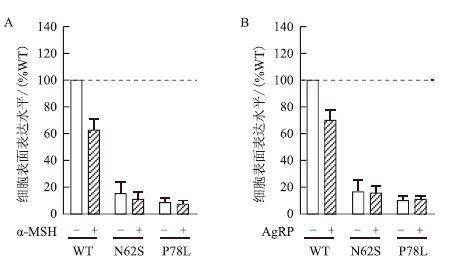
为证明MC4R胞内留存型突变体的细胞膜表面表达水平提高确实是小分子化合物ML00253764特定作用方式的结果,用MC4R天然的内源性激动剂α-MSH或逆激动剂AgRP 10-6 mol/L作用45 min,测定其细胞膜受体量。结果(图 5)显示,野生型MC4R-WT在内源性配体作用下的膜受体量均发生了降低,其中α-MSH处理后降低到62%,而AgRP作用下降低到70%左右。但是对另外两个胞内运送缺陷的突变受体来说,配体处理对受体的细胞膜表达水平无太大的影响,说明MC4R内源性配体包括反向激动剂多肽和正向激动剂都不能模仿ML00253764的作用方式,即MC4R突变体细胞膜表面表达量的提高是ML00253764单独发挥小分子药学伴侣分子特定作用的结果。
|
| 图 5 α-MSH(A)与AgRP(B)介导的MC4R突变体细胞膜表面表达水平的分析 |
GPCRs蛋白是经典的膜蛋白,一旦基因发生突变将可能导致受体在胞内的成熟受到阻遏,最常见的一种情况便是被细胞的质量控制系统识别并滞留于内质网内,导致细胞膜表面表达的降低,引发疾病[13]。MC4R突变体N62S与P78L便是从肥胖病人体内鉴定出来的单基因突变体,数据显示其细胞膜表面表达发生了严重的缺陷,只能达到野生型10%左右的水平。ML00253764是一种小分子化合物,我们之前的研究[10]已证实可以拯救另外两个MC4R缺陷型突变体C84R和W174C,本研究结果显示N62S与P78L的细胞膜表达水平也同样可以不同程度的被拯救,且这一拯救结果具有突变体特异性与受体特异性特征。因为ML00253764不能够作为药学伴侣分子影响其他黑皮质素受体及其缺陷型突变体的细胞膜表面表达水平。研究显示,MC4R的胞内转运严格的依赖于体内伴侣分子的出现与否[14],由此推测,ML00253764能够特异性的针对MC4R发挥药学伴侣分子的作用促进其受体蛋白到达细胞膜的转运过程。其机理很可能是ML00253764与突变受体在胞内形成了一种稳定的分子复合物构象[13-15],并绕过了细胞内质量体系的控制从而使错误折叠的受体蛋白摆脱了进入降解途径的命运[14, 16]。
此外,细胞膜渗透性及其相对较小的分子量特征很可能是ML00253764(MW377.251)发挥药理学伴侣活性一个非常重要的因素,因为内源性配体α-MSH(MW1664.87)和AgRP(MW5347.20)均不具有穿透细胞膜的能力,所以对MC4R突变受体的细胞膜表面表达水平无显著性影响,而且对于野生型受体来说还会降低其细胞膜受体量,很可能是因为激动剂或拮抗剂的作用促进了MC4R细胞膜表面受体的脱敏和/或内化进程,导致膜受体减少,与之前的研究结论一致[17, 18],而经药学伴侣分子ML00253764拯救后的MC4R突变体均具有与野生型受体类似的内化动力学速率。
4 结论ML00253764能够以药学伴侣分子的作用方式特异性的拯救MC4R胞内缺陷型突变受体,并且不会影响受体的内化速率,是一种潜在的治疗早发性肥胖病症的药学前体分子。此外细胞膜渗透性特征是药学伴侣分子发挥作用的前提条件,在未来进行GPCRs药物设计及筛选过程中应首先纳入考虑范围。
| [1] | Duffy DL, Box NF, Chen W, et al. Interactive effects of MC1R and OCA2 on melanoma risk phenotypes[J]. Hum Mol Genet, 2004, 13(4): 447–461. |
| [2] | Metherell LA, Chapple JP, Cooray S, et al. Mutations in MRAP, encoding a new interacting partner of the ACTH receptor, cause familial glucocorticoid deficiency type 2[J]. Nat Genet, 2005, 37(2): 166–170. |
| [3] | Tao YX. Functional characterization of novel melanocortin-3 receptor mutations identified from obese subjects[J]. Biochim Biophys Acta, 2007, 1772(10): 1167–1174. |
| [4] | Tao YX. The melanocortin-4 receptor:physiology pharmacology and pathophysiology[J]. Endocrine Reviews, 2010, 31(4): 506–543. |
| [5] | Farooqi IS, Yeo GS, Keogh JM, et al. Dominant and recessive inheritance of morbid obesity associated with melanocortin 4 receptor deficiency[J]. J Clin Invest, 2000, 106(2): 271–279. |
| [6] | Hinney A, Schmidt A, Nottebom K, et al. Several mutations in the melanocortin-4 receptor gene including a nonsense and a frameshift mutation associated with dominantly inherited obesity in humans[J]. Journal of Clinical Endocrinology and Metabolism, 1999, 84(4): 1483–1486. |
| [7] | Chen W, Kelly MA, Opitz Araya X, et al. Exocrine gland dysfunction in MC5R-deficient mice:evidence for coordinated regulation of exocrine gland function by melanocortin peptides[J]. Cell, 1997, 91(6): 789–798. |
| [8] | Bernier V, Lagace M, Lonergan M, et al. Functional rescue of the constitutively internalized V2 vasopressin receptor mutant R137H by the pharmacological chaperone action of SR49059[J]. Molecular Endocrinology, 2004, 18(8): 2074–2084. |
| [9] | Bernier V, Morello JP, Zarruk A, et al. Pharmacologic chaperones as a potential treatment for X-linked nephrogenic diabetes insipidus[J]. Journal of the American Society of Nephrology, 2006, 17(1): 232–243. |
| [10] | Vos TJ, Caracoti A, Che JL, et al. Identification of 2-[2-[2-(5-bromo-2-methoxyphenyl)-ethyl] -4, 5-dihydro-1H-imidazole(ML00257364), a small molecule melanocortin 4 receptor antagonist that effectively reduces tumor-induced weight loss in a mouse model[J]. J Med Chem, 2004, 47(7): 1602–1604. |
| [11] | Fan ZC, Tao YX. Functional characterization and pharmacological rescue of melanocortin-4 receptor mutations identified from obese patients[J]. J Cell Mol Med, 2009, 13(9B): 3268–3282. |
| [12] | Wang XH, Wang HM, Zhao BL, et al. Rescue of defective MC4R cell-surface expression and signaling by a novel pharmacoperone Ipsen 17[J]. J Mol Endocrinol, 2014, 53(1): 1–13. |
| [13] | Conn PM, Ulloa Aguirre A, Janovick JA. G protein-coupled receptor trafficking in health and disease:lessons learned to prepare for therapeutic mutant rescue in vivo[J]. Pharmacol Rev, 2007, 59(3): 225–250. |
| [14] | Meimaridou E, Gooljar SB, Ramnarace N, et al. The Cytosolic chaperone Hsc70 promotes traffic to the cell surface of intracellular retained melanocortin-4 receptor mutants[J]. Molecular Endocrinology, 2011, 25(9): 1650–1660. |
| [15] | Conn PM, Ulloa-Aguirre A. Trafficking of G-protein-coupled receptors to the plasma membrane:insights for pharmacoperone drugs[J]. Trends Endocrinol Met, 2010, 21(3): 190–197. |
| [16] | Granell S, Serra-Juhé C, Martos-Moreno Gá, et al. A novel melanocortin-4 receptor mutation MC4R-P272L associated with severe obesity has increased propensity to be ubiquitinated in the ER in the face of correct folding[J]. PLoS One, 2012, 7(12): e50894. |
| [17] | Castro-Fernandez C, Maya-Nunez G, Conn PM. Beyond the signal sequence:protein routing in health and disease[J]. Endocr Rev, 2005, 26(4): 479–503. |
| [18] | Breit A, Wolff K, Kalwa H, et al. The natural inverse agonist agouti-related protein induces arrestin-mediated endocytosis of melanocortin-3 and -4 receptors[J]. J Biol Chem, 2006, 281(49): 37447–37456. |





