2. 中国科学院苏州生物医学工程技术研究所 中国科学院生物医学检验技术 重点实验室, 苏州 215163
2. Key Laboratory of Biomedical Inspection Technology,Suzhou Institute of Biomedical Engineering and Technology,Chinese Academy of Sciences,Suzhou 215163
基因治疗是人类治疗肿瘤、传染病、遗传病的新方向。基因治疗要依靠转染性高、安全有效的基因载体,寻找安全有效的基因治疗载体是当今基因治疗领域的研究热点。应用于基因治疗的载体分为病毒载体和非病毒载体两大类。病毒载体在基因治疗方面虽然有着较高的转染效率和很强的靶向性,但是其作为携带外源目的基因的载体在导入宿主细胞时,不可避免的存在致癌、致毒等风险。这些缺点使得病毒载体在基因治疗领域受到了一定的限制[1-3]。在非病毒载体中,质粒载体在基因治疗中一直占据重要地位,但是传统质粒有着不可避免的缺点,包括:基因沉默化,未甲基化的序列抑制基因的表达[4];含有抗性基因序列等细菌序列[5];基因片段大等。而基因表达微载体能够有效的避免质粒基因表达载体的外源基因沉默化,能够稳定存在于机体组织中。
基因表达微载体是指不含有细菌复制子序列,抗菌素抗性基因序列等细菌DNA序列,而只有基因表达所需要的基本元件,如基因表达启动子、目的基因和加尾系列(poly A),其外源基因能有效表达的环状的DNA分子[6, 7]。基因表达微载体不含或很少含细菌、病毒DNA序列,大大减少了非宿主细胞的DNA,特别是细菌DNA的CpG序列、抗菌素抗性基因等,从而可以减少基因治疗过程中所引起的机体免疫反应、细胞炎症、细胞毒性等不良副作用[8]。基因表达微载体的分子数量越小,细胞转化效率以及基因表达效率就越高[9]。目前,针对pDNA的改造有制备成微环DNA(mini-circle DNA)和线性共价闭合微环DNA(mini-linear covalently closed,mini-lcc)[10-12]。二者都是尽可能的删除潜在可能会引发机体免疫反应以及干扰载体整合效率的序列。研发一种能安全、长期、高效、稳定表达外源基因的新型基因表达载体,将大大促进基因治疗在人类中应用的进程。
本实验通过昆虫细胞Sf9制备得到的AAV-ITR微载体是一种基于腺相关病毒倒置末端重复序列(Inverted terminal repeats,ITR)的单链基因表达微载体,仅含有AAV基因组的两端的ITR序列和中间的基因表达框序列。在Sf9中制备得到的微载体无质粒中CpG序列、抗菌素的抗性基因序列,因此可以减少传统质粒载体在基因治疗过程中的各种不良副作用以及抗生素基因产生的抗药性,并且能够安全稳定,长期高效的表达外源基因。然而,微载体在生产过程中不仅产生单体,还极易形成二聚体和多聚体等多种形式。通过构建产生的pUC57-minivector-EGFP质粒包含pUC57质粒和AAV-ITR微载体序列。因此,本实验以pUC57-minivector-EGFP质粒为对照研究微载体的单体和多种形式混合体在小鼠组织中的表达效率和稳定性,以期为今后该微载体携带治疗基因在体内的表达提供依据。
1 材料与方法 1.1 材料AAV-ITR基因表达微载体,pUC57-minivector-EGFP质粒由中科院苏州医学工程技术研究所检验室构建保存。Lipofectamine 2000 转染试剂购自 Invitrogen公司。Cole氏苏木素染色液(常规染色)、加拿大树胶购自北京索莱宝科技有限公司。水合氯醛、多聚甲醛、无水葡萄糖等均为国产分析纯以上。琼脂糖粉购自Biowest公司。氯化钠注射液购自湖北天药药业股份有限公司。注射用头孢哌酮钠舒巴坦钠购自苏州中化药品工业有限公司。DL5000 marker购自TaKaRa公司。质粒提取试剂盒购自Axygen公司。胶回收试剂盒购自Biomiga公司。DNeasy Blood & Tissue Kit购自QIAGEN公司。Go Taq qPCR Master Mix购自上海睿安生物科技有限公司。微量注射器购自上海高鸽工贸有限公司。5-6 周龄雄性 ICR 小鼠、高压饲料、进口垫料、小鼠笼等购自上海斯莱克实验动物有限公司。全自动脑立体定位仪、注射进样器、颅骨钻等购自Stoeltingde公司。
1.2 方法 1.2.1 载体的制备首先制备和鉴定本研究中所涉及到的pUC57-minivector-EGFP 质粒、AAV-ITR基因表达微载体和AAV-ITR基因表达微载体单体。pUC57-minivector-EGFP 质粒已经由本实验室构建完成,可以通过直接转化sure 2大肠杆菌感受态细胞,然后挑选单克隆菌落培养后进行验证并扩增,通过购自Axygen公司的质粒提取试剂盒抽提pUC57-minivector-EGFP 质粒,并通过Not I单酶切鉴定。AAV-ITR基因表达微载体的制备需将Sf9 细胞培养处于指数增长期至 2×106 cells/mL时,按 MOI=2 加入两种重组杆状病毒P3代的 Baculovirus-inrep和Baculovirus-ITR-EGFP,继续培养72 h后,抽提得到微载体,并通过电泳验证AAV-ITR基因表达微载体单体与多聚体的存在。通过购自Biomiga公司的胶回收试剂盒可回收AAV-ITR基因表达微载体单体,并以Xho Ⅰ单酶切鉴定AAV-ITR基因表达微载体单体。
1.2.2 基因表达微载体转染小鼠大脑皮层参考国内外文献[13-16],选择NMDA损伤动物模型,应用目前最广泛的皮层以及纹状体立体定向注NMDA致脑损伤模型。由文献[13, 15]可知,小鼠脑内注射,注射量不得超过5 μL,因此,将注射的拷贝数缩减为4×1011。根据公式:样品拷贝数(copies/μL)=样品浓度(ng/μL)×10-9×6.02×1023(阿伏伽德罗常数)/样品分子量(碱基对数 bp×648),可计算4×1011各样品的注射量。将 5-6 周的 ICR 雄性小鼠随机分成 3个组,每组20只,分别通过脑立体定位仪对小鼠进行立体定向脑皮层注射pUC57-minivector-EGFP 质粒、AAV-ITR基因表达微载体和5%的灭菌葡萄糖溶液。首先,麻醉小鼠,腹腔注射5%的水合氯醛(按0.1 mL/10 g,每只注射 0.3 mL,麻醉时间为2 h左右)。剪去头部鼠毛,75%酒精消毒皮肤,沿中线切开头皮长约1.5 cm,用无菌棉签棒蘸取H2O2分离骨膜,暴露颅骨骨缝。使用脑立体定位仪确定钻孔位置:前囟后2.5 mm,中线右侧0.5 mm,进针深度2 mm,颅骨钻开直径约1 mm圆孔。使用皮升注射泵按照1 μL/min的速度注入5 μL溶液(4×1011相同拷贝数的pUC57-minivector-EGFP 质粒、AAV-ITR基因表达微载体用量加入1 μL 转染试剂后用 5%的灭菌葡萄糖溶液补至 5 μL),留针5 min后,缓慢拔针。缝合头皮,肌注青霉素钠(25 g重小鼠为300 000 U,首次每只注射0.2 mL,随后每天注射0.1 mL,连续3 d)。将小鼠放回鼠笼,精心饲养。
大脑皮层表达效果及稳定性检测:上述各实验组中的小鼠分别于3 d、7 d、14 d、一个月和两个月的时间点各处死4只,断头,暴露出脑组织。其中一只取出完整的存在注射部位的右半脑,置于4%多聚甲醛中,用于制作切片观察荧光比例,另外3只于注射部位取出约25 mg的脑组织,使用购自QIAGEN公司的DNeasy Blood & Tissue Kit提取脑组织DNA用于做qPCR。做脑组织切片观察荧光比例,同时为了更加准确的分析,提取脑组织中的DNA通过Real-time PCR 分析二者的降解情况。
1.2.3 基因表达微载体转染小鼠骨骼肌将5-6 周的 ICR 雄性小鼠随机分成4个组,每组16只,通过50 μL微量注射器将拷贝数为4×1010(由于AAV-ITR基因表达微载体单体由胶回收得到,得率较低,注射拷贝数缩减为4×1010)的pUC57-minivector-EGFP 质粒、AAV-ITR基因表达微载体、AAV-ITR基因表达微载体单体和5%的灭菌葡萄糖溶液注射入小鼠右后肢骨骼肌。
小鼠骨骼肌表达效果及稳定性检测:上述各实验组中的小鼠分别于3 d、7 d、15 d和一个月的时间点分别处死4只,暴露出后肢骨骼肌,其中一只取出完整的存在注射部位的骨骼肌,置于4%多聚甲醛中,用于制作切片观察荧光比例。另外3只于注射部位取出约25 mg的骨骼肌组织,使用购自QIAGEN公司的DNeasy Blood & Tissue Kit提取脑组织DNA用于做qPCR。
1.2.4 制作石蜡切片及荧光显微分析将取材后以4%多聚甲醛溶液固定的小鼠右半脑和后肢骨骼肌进行脱水,再经纯酒精和二甲苯各半的混合液浸渍1 h后转入二甲苯中浸渍1 h来进行透明,对透明后的材料进行浸蜡处理。浸蜡完全后,将组织置于融化的固体石蜡中完成包埋。最后按4 μm厚度在小鼠脑组织注射部位及骨骼肌注射部位附近均匀切割蜡块完成切片的制作。将切片按照注射的不同载体和时间标号后置于荧光显微镜下观察并拍摄荧光图(激发波长 488 nm,发射波长 507 nm)。
1.2.5 ImageJ软件统计分析荧光切片将拍摄得到的荧光图通过 Image J(National institutes of health)测量其平均光密度值(Ostu 校准方法)、组织荧光面积或平均灰度值,用以反映不同载体的表达强度。平均光密度值通过灰度图黑白反转后校正光密度并选择合适的阈值,排除背景干扰,使得转染成功的脑组织细胞被全部选中,统计出所选定细胞在图片中的面积及其IOD(所选细胞光密度的总和)值。IOD值与细胞荧光面积的比值即为平均光密度值。组织荧光面积(area)或平均灰度值(Mean gray value)的统计方法与平均光密度值相似。再将所得数值进行方差分析(SPSS 17.0 Inc,Chicago,USA)并绘制折线图以比较各载体的表达效率。
1.2.6 Real-timePCR 比 较 分 析DNA存留分子数 分别收取不同时间点各组载体注射的小鼠的脑组织或骨骼肌,然后用QIAGEN全基因组提取试剂盒进行总 DNA 抽提。设计并由上海生工生物工程合成一对 EGFP 片段引物,上游引物5'-CGGAATTCATGGTGAGCAAGGGCGAGG-3'和下游引物 5'-GCTCTAGATTACTTGTACAGCTCGTCCAT-3'以 SYBGreen 为荧光染料进行 Real-time PCR,比较上述各载体的不同时间段的分子残留量。并将所得各组数据以 表示,采用多个样本均数间方差分析及两两比较的 t检验进行统计学分析。对组内不同时间段的比较与相同时间段内各组间比较,可分析各载体在不同时间段内的残余分子量大小及不同载体间的降解情况,以比较上述3种载体在小鼠体内稳定性和转染效率之间的差异。
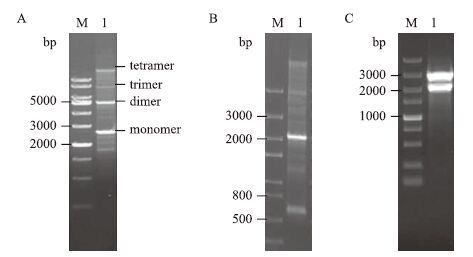
2 结果 2.1 载体的鉴定pUC57-minivector-EGFP 质粒通过Not Ⅰ单酶切鉴定,可得到约2 000 bp和2 700 bp两条条带,与预期相符(图 1-C)。通过电泳验证AAV-ITR基因表达微载体单体与多聚体结果(图 1-A)显示,2000与3 000 bp之间的条带约为2.7 kb,与预期AAV-ITR基因表达微载体单体条带大小相符,由于AAV-ITR基因表达微载体单体在细胞内极易形成二聚体和多聚体,而在5 000-6 000 bp处的条带则符合其二聚体5.4 kb的大小,由此推算得到其余条带依次为三聚体以及多聚体。用Xho Ⅰ单酶切鉴定,应得到2 048 bp,670 bp的条带,大小与预期相符(图 1-B)。
|
| 图 1 AAV-ITR基因微载体与pUC57-minivector-EGFP的鉴定 A:AAV-ITR 基因微载体(单体和多聚体)鉴定;B:AAV-ITR 基因微载体Xho Ⅰ 单酶切鉴定;C:pUC57-minivector-EGFP 质粒Not Ⅰ 单酶切鉴定 |
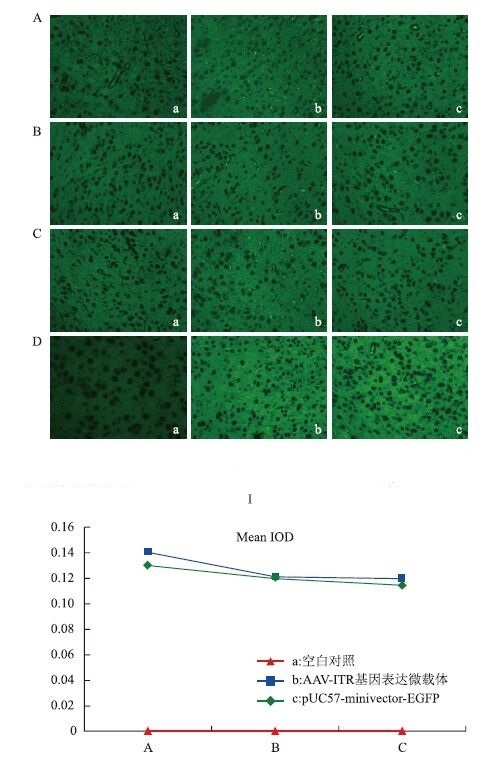
在小鼠脑部注射4×1011 copies的AAV-ITR基因表达微载体和pUC57-minivector-EGFP后的3、7和14 d的脑组织切片荧光显微镜分析(图 2-Ⅰ)显示,可明显看出pUC57-minivector-EGFP在14 d时的表达情况下降非常明显,低于AAV-ITR基因表达微载体14 d时的表达,差异显著(图 2-Ⅰ中Cb、Cc),说明此时,pUC57-minivector-EGFP在小鼠组织中已大量降解。图 2-Ⅰ D为小鼠脑部注射AAV-ITR基因表达微载体和pUC57-minivector-EGFP一个月后的脑组织切片荧光显微图,由于图 2-Ⅰ中D与图 2-Ⅰ中的A、B、C所示切片不属于同一批次且此次切片更接近于注射针孔,不能将其进行共同比较。但是可以明显看出一个月以后AAV-ITR基因表达微载体在小鼠脑组织中的表达效率依然较高且显著高于pUC57-minivector-EGFP的表达。将通过荧光显微境观察拍摄得到的荧光图(图 2-Ⅰ中A、B、C)通过 Image J(National institutes of health)做半定量分析,测量其平均光度值(Ostu 校准方法),用以反映不同载体的表达强度。将计算所得平均光密度值通过折线图表示(图 2-Ⅱ)。可以明显看出小鼠脑部注射AAV-ITR基因表达微载体后3 d(图 2-Ⅱ中Ab)、7 d(图 2-Ⅱ中Bb)和14 d(图 2-Ⅱ中Cb)时AAV-ITR基因表达微载体表达情况均高于pUC57-minivector-EGFP的表达情况(图 2Ⅱ中Ac、Bc、Cc),且AAV-ITR基因表达微载体的表达效果在7-14 d内没有明显变化(图 2Ⅱ中Bb、Cb),表明AAV-ITR基因表达微载体此段时间较为稳定。由此可推断AAV-ITR基因表达微载体较pUC57-minivector-EGFP 在小鼠大脑皮层中的表达效率更高且表达更稳定。
|
| 图 2 AV-ITR基因表达微载体、pUC57-minivector-EGFP注射小鼠大脑皮层的EGFP表达(Ⅰ)及平均光密度值(Ⅱ) A-D:分别为注射小鼠大脑皮层3、7、14和30 d后EGFP的表达。a:空白对照;b:AAV-ITR基因表达微载体;c:pU57-minivector-EGFP;A-C:分别为注射小鼠3、7和14 d的平均光密度值 |
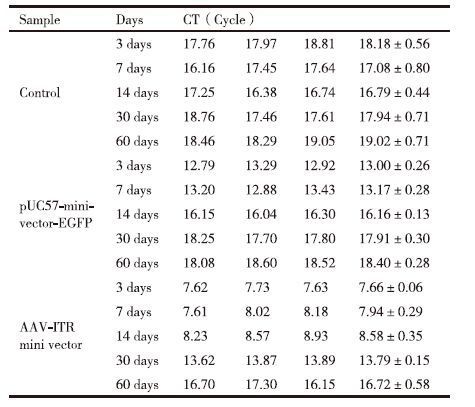
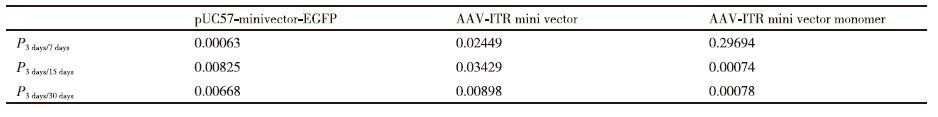
4×1011 copies的AAV-ITR基因表达微载体和pUC57-minivector-EGFP在小鼠脑部不同时间段的表达Real-time PCR 分析结果(表 1)显示,AAV-ITR基因表达微载体的CT值在3、7、14、30和60 d的时间点均小于pUC57-minivector-EGFP,说明AAV-ITR基因表达微载体转染效果较pUC57-minivector-EGFP更好,大脑皮层内残余分子数量更多。随着时间的延长,pUC57-minivector-EGFP和AAV-ITR基因表达微载体的CT值均有逐渐增加的趋势。pUC57-minivector-EGFP在14 d时的CT值已基本接近空白对照,AAV-ITR基因表达微载体在两个月时的CT值与空白对照相比仍有差异。可初步判断pUC57-minivector-EGFP和AAV-ITR基因表达微载体在脑组织中的残余分子数量在60 d内均有不同程度的降解,但AAV-ITR基因表达微载体在小鼠脑组织中比pUC57-minivector-EGFP具有更高的转染效率,而且AAV-ITR基因表达微载体在小鼠脑组织中要更加稳定,不易降解。
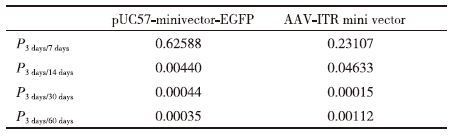
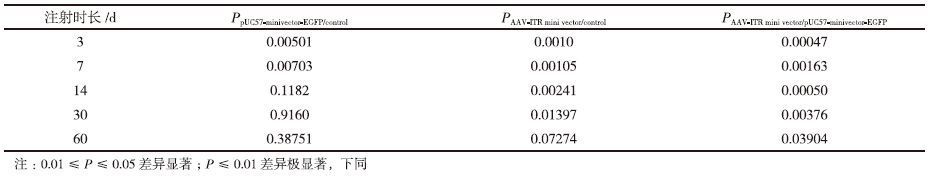
对表 1中的小鼠脑组织中AAV-ITR基因表达微载体、pUC57-minivector-EGFP 3、7、14、30和60 d的残留分子数RT-PCR所得的CT值分别使用函数TTEST进行t检验。结果(表 2)显示,小鼠脑组织中的pUC57-minivector-EGFP 和AAV-ITR基因表达微载体残余分子数量在注射后3-7 d的时间段内的t检验所得数值表明在此时间段内小鼠脑组织中的pUC57-minivector-EGFP 和AAV-ITR基因表达微载体残余分子数量的下降量并无显著差异。在3-14 d的时间段内,小鼠脑组织中的AAV-ITR基因表达微载体残余分子数量下降有显著的差异,而pUC57-minivector-EGFP的残余分子数量下降极其显著。由表 3可以明显的看出AAV-ITR基因表达微载体和pUC57-minivector-EGFP在小鼠脑部直到14 d时的转染效率与空白相比分别有极显著差异和无明显差异。AAV-ITR基因表达微载体在小鼠脑部的残余分子数量在30 d时与空白对照依然有着显著差异,表明AAV-ITR基因表达微载体相对于pUC57-minivector-EGFP有着更高的转染效率和更好的稳定性。
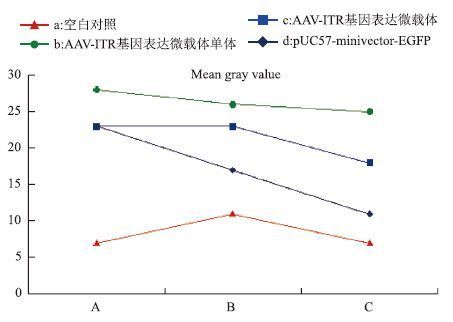
小鼠骨骼肌注射AAV-ITR基因表达微载体单体、AAV-ITR基因表达微载体和pUC57-minivector-EGFP后3、7和15 d组织切片荧光显微境观察拍摄得到的荧光图片(图 3-Ⅰ),通过 Image J(National institutes of health)处理,调整阈值范围,使得转染成功的肌肉组织被全部标记,勾选软件测量工具中的面积统计功能,统计出被标记的肌肉组织面积以充分说明各微载体的转染效率(图 3-Ⅱ)。或者通过计算其平均灰度值来表示不同载体的表达强度(图 4)。结果显示,骨骼肌注射后3 d时AAV-ITR基因表达微载体单体的表达量(图 3-Ⅱ中Ab)明显高于AAV-ITR基因表达微载体(图 3-Ⅱ中Ac)和pUC57-minivector-EGFP(图 3-Ⅱ中Ad)。而此时AAV-ITR基因表达微载体的表达量(图 3Ⅱ中Ac)同pUC57-minivector-EGFP(图 3-Ⅱ中Ad)相当,这点从其灰度值分析(图 4中Ac、Ad)也能很好的体现。7 d时AAV-ITR基因表达微载体单体的表达量(图 3-Ⅱ中Bb)有一定程度地降低,但仍然明显高于AAV-ITR基因表达微载体(图 3-Ⅱ中Bc),此时pUC57-minivector-EGFP的表达量已显著降低(图 3-Ⅱ中Bd)。15 d时AAV-ITR基因表达微载体单体的表达量依然较高(图 3-Ⅱ中Cb),此时pUC57-minivector-EGFP(图 3-Ⅱ中Cd)和AAV-ITR基因表达微载体(图 3-Ⅱ中Cc)大部分已降解。计算平均灰度值分析结果也明显表示出AAV-ITR基因表达微载体单体在3、7和15 d(图 4中Ab、Bb、Cb)时均保持较高水平,且明显高于AAV-ITR基因表达微载体(图 4中Ac、Bc、Cc)和pUC57-minivector-EGFP(图 4中Ad、Bd、Cd)。充分表明AAV-ITR基因表达微载体与pUC57-minivector-EGFP相比表达时间更长且转染效率更好,但却不及AAV-ITR基因表达微载体单体。
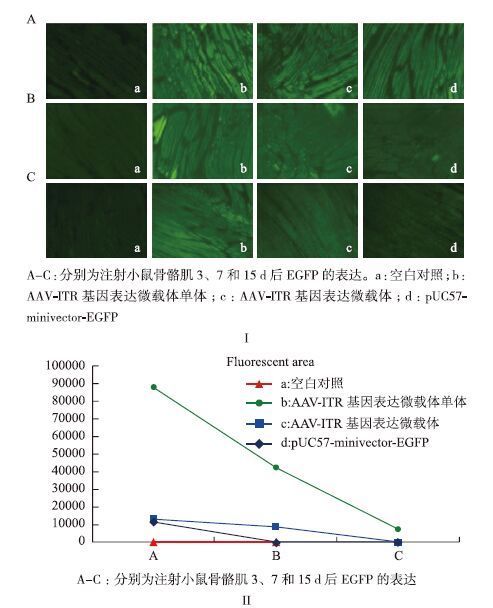
|
| 图 3 AAV-ITR基因表达微载体单体、AAV-ITR基因表达微载体和pUC57-minivector-EGFP注射小鼠骨骼肌EGFP表达结果(Ⅰ)及EGFP成功表达的骨骼肌面积(Ⅱ) A-C:分别为注射小鼠骨骼肌3、7和15 d后EGFP的表达。a:空白对照;b:AAV-ITR基因表达微载体单体;c:AAV-ITR基因表达微载体;d:pUC57-minivector-EGFP;A-C:分别为注射小鼠骨骼肌3、7和15 d后EGFP的表达 |
|
| 图 4 AAV-ITR基因表达微载体单体、AAV-ITR基因表达微载体和pUC57-minivector-EGFP注射小鼠大脑皮层EGFP表达灰度值 A-C:分别为注射小鼠大脑皮层3、7和15 d后EGFP 的表达 |
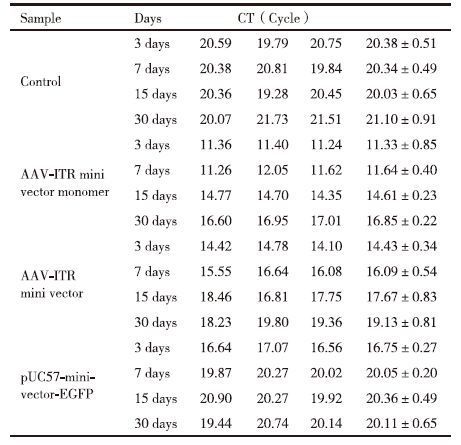
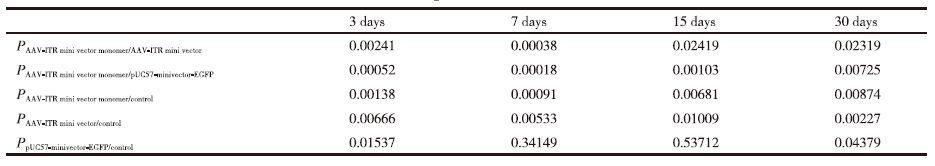
为了比较AAV-ITR基因表达微载体单体在小鼠体内的转染效率和稳定性是否优于AAV-ITR基因表达微载体,将4×1010 copies的AAV-ITR基因表达微载体及其单体和pUC57-minivector-EGFP注射入小鼠骨骼肌后3、7、15和30 d后对其进行Real-time PCR。所得CT值结果(表 4)显示,AAV-ITR基因表达微载体单体、AAV-ITR基因表达微载体和pUC57-minivector-EGFP在30 d内CT都有较为明显的增长,AAV-ITR基因表达微载体单体增长幅度较低,且各时间段CT值均最低,前7 d内CT值无明显变化,一个月后,其数值仍低于空白对照。AAV-ITR基因表达微载体30 d内增加幅度次之,一个月后,其数值与空白对照相当。pUC57-minivector-EGFP的CT值增加更加明显,一周时已与空白对照无明显差异。可以初步判断AAV-ITR基因表达微载体单体相比于AAV-ITR基因表达微载体和pUC57-minivector-EGFP具有更好的稳定性,更加不易降解。
为了进一步说明AAV-ITR基因表达微载体单体在小鼠体内的转染效率和稳定性是否优于AAV-ITR基因表达微载体,将4×1010 copies的AAV-ITR基因表达微载体及其单体和pUC57-minivector-EGFP注射入小鼠骨骼肌后3、7、15和30 d的Real-time PCR所得CT值进行配对t检验分析。表 5显示,在小鼠肌肉注射后的3-7 d的时间段内,AAV-ITR基因表达微载体单体在小鼠骨骼肌中残余分子数量没有下降;AAV-ITR基因表达微载体的残余分子数量有显著下降;pUC57-minivector-EGFP的残余分子数量下降极显著。从表 6中可以明显的看出AAV-ITR基因表达微载体单体在小鼠骨骼肌中的残余分子数量在注射后一个月时与空白相比仍然有着极显著差异,而AAV-ITR基因表达微载体在15 d时与空白已表现出显著差异。AAV-ITR基因表达微载体单体与AAV-ITR基因表达微载体相比随着时间的增长,虽然差异有所减小,但是在一个月时仍有着显著差异,而与pUC57-minivector-EGFP相比,30 d内的各个时间段均有着极显著的差异。由此可以充分表明AAV-ITR基因表达微载体在小鼠骨骼肌中虽然比pUC57-minivector-EGFP有着更好的稳定性和更高的表达效率,但却均不及AAV-ITR基因表达微载体单体。
目前,病毒基因表达载体是用于基因治疗的主要基因表达载体,AAV病毒载体在基因治疗中得到广泛应用[18-20]。通过腺相关病毒本身结构方面所具有的优越性[21-23]和线性共价闭合微环状DNA 载体[24-26]的构造特点。构建出AAV-ITR 单链 DNA 微载体,具有结构简单且安全高效等优点[27]。AAV-ITR单链DNA微载体高效表达效率的主要因素在于微载体两端的AAV-ITR结构。AAV-ITR为一段125 bp的核苷酸序列,能自我互补形成倒T型发卡结构。末端所形成的稳定的环状结构使得整个微载体的结构更加的稳定[23],末端发夹结构的ITR不仅可以引发AAV单链基因组合成第二条链,还可帮助其在细胞中形成稳定的环状多聚体和类染色质结构,从而使外源基因能稳定表达,所以 ITR 结构的存在又赋予此载体较高的稳定性和表达效率[28]。
但是由于制备得到的AAV-ITR基因表达微载体是单体、二聚体以及多聚体的混合物,转染进入细胞之后,单聚体可以更快的进行表达,而二聚体以及多聚体的存在使微载体DNA降解比质粒降解要缓慢持续时间更久。本研究通过对AAV-ITR基因表达微载体和pUC57-minivector-EGFP在小鼠大脑皮层的表达结果分析可以明显看出,14 d时AAV-ITR基因表达微载体的降解有着显著差异,而pUC57-minivector-EGFP的降解差异极显著,此时pUC57-minivector-EGFP与空白对照已无明显差异。AAV-ITR基因表达微载体在一个月时与空白相比还有显著差异,两个月时虽然差异不显著但仍然有着一定的差异。可以充分说明AAV-ITR基因表达微载体在小鼠大脑皮层中比pUC57-minivector-EGFP有更高的稳定性和更好的表达效率。AAV-ITR基因表达微载体单体、AAV-ITR基因表达微载体和pUC57-minivector-EGFP在小鼠骨骼肌中的表达结果分析表明,在一个月的时间内,pUC57-minivector-EGFP最早在一周时已显示出与空白对照无明显差异,AAV-ITR基因表达微载体在半个月时还表现出与空白对照的显著差异,而AAV-ITR基因表达微载体单体直到一个月时仍然与空白对照有着极显著差异。而且,在同时间段内,AAV-ITR基因表达微载体单体的CT值总是最低。由此可见,AAV-ITR基因表达微载体单体在体内的表达效率和稳定性都明显优于AAV-ITR基因表达微载体和pUC57-minivector-EGFP质粒。分析其原因,可能是由于二聚体与多聚体两端的AAV-ITR结构处于线性状态,不易形成倒T型发卡结构,在动物体内主要以游离状态存在,对其稳定性有一定的影响。而单体在动物体内以 ITR 3'末端作为引物合成第二条链,形成一个稳定的环状结构。此外还有可能通过末端重复序列进一步形成环状多聚体,提高载体的稳定性。所以,AAV-ITR基因表达微载体单体在体内的表达效率和稳定性均更有优越性。但是由于实验中AAV-ITR基因表达微载体单体必须通过胶回收得到,收率较低。目前已有报道可以在酵母和昆虫细胞中成功表达制备AAV-ITR 单链 DNA[29, 30],后续实验除了进一步研究AAV-ITR基因表达微载体的价值外,还将着力研究如何能有效的避免多聚体的生成,得到含量更高的单体。
4 结论通过本研究充分证明了AAV-ITR基因表达微载体是一种具有较高转染、表达效率以及稳定性高的基因转移载体。
| [1] | Seow YQ, Wood MJ. Biological gene delivery vehicles:beyond viral vectors[J]. Molecular therapy, 2009, 17(5): 767–777. |
| [2] | 郭勇, 曾庆平. 基因治疗药物的研究进展[J]. 药物生物技术, 1996, (3): 181–186. |
| [3] | Marshall E. Gene therapy death prompts review of adenovirus vector[J]. Science, 1999, 286(5448): 2244–2245. |
| [4] | Chen ZY, He CY, Meuse L, et al. Silencing of episomal transgene expression by plasmid bacterial DNA elements in vivo[J]. Gene Therapy, 2004, 11(10): 856–864. |
| [5] | Pang AS. Production of antibodies against Bacillus thuringiensis delta-endotoxin by injecting its plasmids[J]. Biochem Biophys Res Commun, 1994, 202(3): 1227–1234. |
| [6] | Bartlett JS. Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors[J]. J Virol, 2000, 74(6): 2777–2785. |
| [7] | Sanlioglu S. Endocytosis and nuclear trafficking of adeno-associated virus type 2 are controlled by rac1 and phosphatidylinositol-3 kinase activation[J]. J Virol, 2000, 74(19): 9184–9196. |
| [8] | Akache. A two-hybrid screen identifies cathepsins B and L as uncoating factors for adeno-associated virus 2 and 8[J]. Mol Ther, 2007, 15(2): 330–339. |
| [9] | Zaiss AK. Differential activation of innate immune responses by adenovirus and adeno-associated virus vectors[J]. J Virol, 2002, 76(9): 4580–4590. |
| [10] | Weindler FW, Heilbronn R. A subset of herpes simplex virus replication genes provides helper functions for productive adeno-associated virus replication[J]. J Virol, 1991, 65(5): 2476–2483. |
| [11] | Summerford. AlphaVbeta5 integrin:a co-receptor for adeno-associated virus type 2 infection[J]. Nat Med, 1999, 5(1): 78–82. |
| [12] | Qing K. Human fibroblast growth factor receptor 1 is a co-receptor for infection by adeno-associated virus 2[J]. Nat Med, 1999, 5(1): 71–77. |
| [13] | Bakowska JC, Di Maria MV, Camp SM, et al. Targeted transgene integration into transgenic mouse fibroblasts carrying the full-length human AAVS1 locus mediated by HSV/AAV rep(+)hybrid amplicon vector[J]. Gene Ther, 2003, 10(19): 1691–1702. |
| [14] | Huttner NA, Girod A, Schnittqer S, et al. Analysis of site-specific transgene integration following cotransduction with recombinant adeno-associated virus and a rep encodingplasmid[J]. J Gene Med, 2003, 5(2): 120–129. |
| [15] | Manno CS. AAV-mediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B[J]. Blood, 2003, 101(8): 2963–2972. |
| [16] | Maguire AM, High KA, Auricchio A, et al. Safety and efficacy of gene transfer for Leber’s congenital amaurosis[J]. N Engl J Med, 2008, 358(21): 2240–2248. |
| [17] | 李泰明, 潘俊杰, 祁静, 等. 昆虫细胞制备AAV-ITR基因表达微载体[J]. 生物工程学报, DOI:10.13345/j.cjb.140485. |
| [18] | Alberts B. The breakthroughs of 2009[J]. Science, 2009, 326(5960): 1589. |
| [19] | Yla-Herttuala S. Endgame:glybera finally recommended for approval as the first gene therapy drug in the European union[J]. Mol Ther, 2012, 20(10): 1831–1832. |
| [20] | Miller N. Glybera and the future of gene therapy in the European Union[J]. Nat Rev Drug Discov, 2012, 11(5): 419. |
| [21] | Henckaerts E, Linden RM. Adeno-associated virus:a key to the human genome?[J]. Future Virol, 2010, 5(5): 555–574. |
| [22] | Coura Rdos S, Nardi NB. The state of the art of adeno-associated virus-based vectors in gene therapy[J]. Virol J, 2007, 4: 99. |
| [23] | Grieger JC, Samulski RJ. Adeno-associated virus as a gene therapy vector:vector development, production and clinical applications[J]. Adv Biochem Eng Biotechnol, 2005, 99: 119–145. |
| [24] | Kobelt D, Schleef M, Schmeer M, et al. Performance of high quality minicircle DNA for in vitro and in vivo gene transfer[J]. Mol Biotechnol, 2013, 53(1): 80–89. |
| [25] | Mayrhofer P, Iro M. Gene Vaccines[M]. Thalhamer J, Weiss R, Scheiblhofer S, Editors. Springer Vienna, 2012:297-310. |
| [26] | Maniar LEG, Maniar JM, Chen ZY, et al. Minicircle DNA vectors achieve sustained expression reflected by active chromatin and transcriptional level[J]. Mol Ther, 2013, 21(1): 131–138. |
| [27] | Mayrhofer P, Schleef M, Jechlinger W. Gene Therapy of Cancer[M]. Methods in Molecular BiologyTM, 2009:87-104. |
| [28] | Duan D, Yan Z, Yue Y, et al. Structural analysis of adeno-associated virus transduction circular intermediates[J]. Virology, 1999, 261(1): 8–14. |
| [29] | Cervelli T, Backovic A, Galli A. Formation of AAV single stranded DNA genome from a circular plasmid in Saccharomyces cerevisiae[J]. PLoS One, 2011, 6(8): e23474. |
| [30] | Li L, Dimitriadis EK, Yang Y, et al. Production and characterization of novel recombinant adeno-associated virus replicative-form genomes:a eukaryotic source of DNA for gene transfer[J]. PLoS One, 2013, 8(8): e69879. |