2. 军事医学科学院军事兽医研究所,长春 130122;
3. 石河子大学动物科技学院, 石河子 832003
2. Institute of Veterinary Science,The Academy of Military Medical Sciences,Changchun 130122;
3. College of Animal Science and Technology,Shihezi University, Shihezi 832003
病毒性肝炎是一个全球性的健康问题,尤其是戊型肝炎病毒(hepatitis E virus,HEV)引起的戊型肝炎[1, 2]。戊型肝炎病毒为单链RNA,无包膜病毒,属于肝炎病毒科肝炎病毒属[3-6]。以往的研究提出了4种HEV的传播途径,分别为粪-口传播、食源性传播、输血和母婴垂直传播[7]。感染戊型肝炎病毒可导致体内长期的凝血和胆汁淤滞,并且还会提高孕妇的死亡率[8-10]。近年来研究还表明,戊型肝炎病毒感染除了提高孕妇的死亡率之外,还会导致男性和非妊娠妇女的死亡[11]。在孕妇中产生高死亡率的原因尚不明确,也没有具体的治疗方法,同时,HEV促进疾病进展的细胞蛋白质和途径仍不明确。这些都归根于HEV难以分离及纯化、同时缺乏稳定的HEV细胞感染培养系统,阻碍了对HEV生物学的理解。
1983年首次用戊肝患者的粪便提取物成功感染了2只猕猴,成为了戊型肝炎动物实验的先例[12]。此后国内外学者陆续发现有10多种灵长类动物品系和猪对HEV易感,适宜于做动物模型。但灵长类动物具有昂贵、来源有限、实验条件要求高等缺点。随后,研究人员发现野鼠可自然感染HEV,但选用野鼠作为动物模型也具有一定的风险,并且其来源也相对有限。
长爪沙鼠(Meiiones unguiculataus)亦称蒙古沙鼠,是一种具有广阔开发前景的多功能性啮齿类实验动物,并且在医学研究领域里作为实验动物已有20-30年的历史。其某些特有的生理学、解剖学和行为学特征对于多种疾病的研究具有重要价值,如脑血管疾病、营养代谢病和自发性肿瘤等[13]。长爪沙鼠不仅对多数病原易感,而且在某些病原感染下,会表现出与人类相似的病理特征和临床症状。因此,长爪沙鼠作为一种“多能”性实验动物,具有非常重要的开发利用价值。
本研究拟用猪源HEV病毒感染长爪沙鼠,通过RT-PCR检测,组织病理学观察等方法,探索将长爪沙鼠作为HEV感染模型的可能性。
1 材料与方法 1.1 材料 1.1.1 毒株猪HEV阳性粪便采自长春某猪场,经RT-PCR鉴定为阳性、属基因Ⅳ型,-70℃保存。
将阳性粪便用PBS制成1∶10的悬液,4℃,4 000 r/min离心20 min,取上清,用0.22 μL无菌滤器滤过除菌,测定RT-PCR滴度后备用。
1.1.2 实验动物40-50日龄的长爪沙鼠获赠于浙江省疾病预防控制中心。
1.1.3 检测试剂盒双抗原夹心ELISA检测试剂盒购自北京万泰生物药业公司;TRIZOL Reagent购自Invitrogen公司;UltrasensitiveTM S-P超敏试剂盒购自福州迈新生物技术开发有限公司。
1.2 方法 1.2.1 长爪沙鼠人工感染实验选取检测为HEV阴性的健康长爪沙鼠24只。每只沙鼠分别以腹腔接种及口服接种的途径接种方法1.1.1中处理后的HEV阳性材料0.5 mL,并连续观察50 d。分别在7、14、21、28、35和50 d无痛处死2只长爪沙鼠,并采血及分离血清检测HEV抗体和检测HEV RNA,同时采集心、肝、脾、肺、肾、肠系膜淋巴结、脾脏、小肠、回肠、直肠检测HEV RNA。
1.2.2 HEV抗体检测使用北京万泰生物制药公司提供的抗-HEV抗体酶联免疫试剂(双抗原夹心法),按照说明书检测血清中抗-HEV抗体并判断结果。
1.2.3 HEVRNA的RT-PCR检测 1.2.3.1 引物设计根据GenBank中注册的HEV各基因型的保守区序列,设计一套简并引物,以M1、M2为外引物;M3、M4为内引物。
M1:5'-AAC(T)TATGCA(C)CAGTACCGG-GTTG-3'(5 725-5 746 bp);M2:5'-CCCTTATCCTG-CTGAGCATTCTC-3'(6 433-6 455 bp);M3:5'-GTC(T)ATGC(T)TGCATACATGGCT-3'(6 010-6 031 bp);M4:5'-AGCCGACGAAATC(T)AATTCTGTC-3'(6 336-6 357 bp)。
1.2.3.2 HEV正链RNA的RT-PCR检测按照TRIZOL Reagent说明书提取HEV RNA。取RNA 14 μL加1 μL的Oligo(dT),于75℃加热5 min后迅速冰浴10 min,然后加入5×M-MLV buffer 6 μL,dNTP 1.5 μL,RNasin 1 μL,M-MLV 1 μL,双蒸水6.5 μL,混匀后42℃ 1 h,95℃ 5 min,-20℃ 30 min。
取上述合成的cDNA进行两轮PCR。首轮使用的引物为M1和M2,PCR扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 1 min,30个循环;72℃延伸10 min。第二轮使用的引物为M3和M4,PCR扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 1 min,30个循环;72℃延伸10 min。
1.2.3.3 HEV负链RNA的RT-PCR检测对检测到HEV 正链的RNA的样品,进行HEV负链RNA的RT-PCR检测。
1.2.4 免疫组织化学观察先将组织制成常规石蜡切片,经脱蜡和脱水后对组织抗原进行相应的修复。加过氧化酶阻断液,室温下孵育10 min。然后在每张切片中先后加入50 μL正常非免疫动物血清、50 μL兔抗p293(ORF2 aa382-674)抗体(1∶1 000)及50 μL生物素标记的二抗,分别在室温下孵育1 h、1 h及10 min。再往切片加入50 μL链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min。最后往切片加入100 μL DAB溶液,作用3 min左右后,冲洗干净,苏木素复染,再冲洗干净;切片经过梯度酒精脱水干燥,二甲苯透明,中性树胶封固后显微镜下观察。
1.2.5 病理组织学观察将待观察的病料用10%中性甲醛溶液固定及石蜡包埋后,以3.5 μm 的厚度连续切片,经常规苏木素-伊红染色后显微镜下观察。
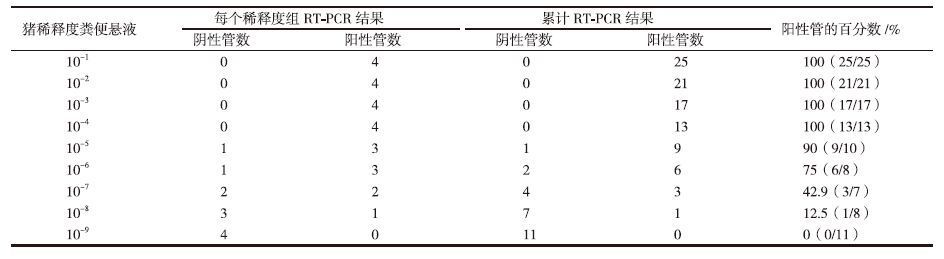
2 结果 2.1 粪便悬液的RT-PCR滴度测定粪便悬液经10递倍稀释后,RT-PCR检测结果见表 1。计算结果表明,接种用猪粪便悬液的RT-PCR滴度为10-6.78。
长爪沙鼠在接种粪便悬液之后,在接种后的前2 d内表现出精神不振,但之后的未再出现明显的临床症状。血清抗体最早于感染后的第21天转为阳性,可持续到感染后第50天(表 2)。
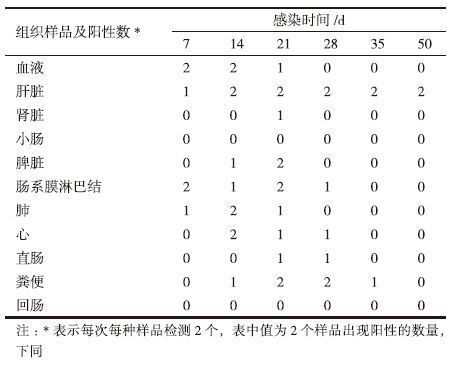
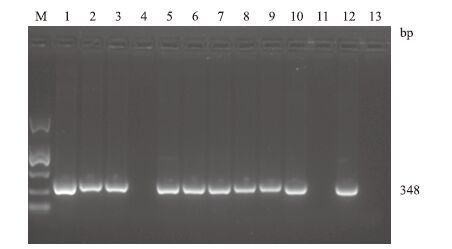
感染后第7天可从血液、心、肾脏、脾脏、肠系膜淋巴结、肝脏、肺等脏器或粪便中检测到HEV正链RNA,最长的可持续到感染后第50天(图 1和表 3)。
|
| 图 1 长爪沙鼠感染21 d后组织样品正链RNA 的RT-PCR检测 M:DNA Marker DL2000;1:血液;2:肝脏;3:肾脏;4:小肠;5:脾脏;6:肠系膜淋巴结;7:肺;8:心;9:直肠;10:粪便;11:回肠;12:阳性对照;13:阴性对照 |
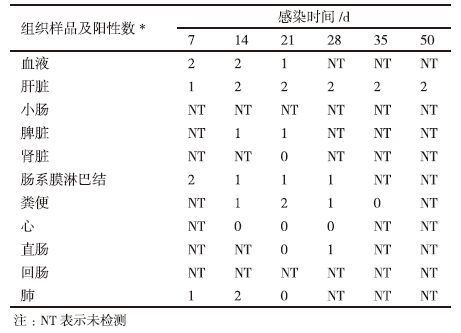
感染长爪沙鼠的负链RNA RT-n-PCR检测结果见图 2和表 4。

|
| 图 2 长爪沙鼠感染21 d后组织样品的负链RNA RT-PCR检测 M:DNA Marker DL2000;1:血液;2:肝脏;3:脾脏;4:肾脏;5:肠系膜淋巴结;6:粪便;7:心;8:直肠;9:肺;10:阳性对照;11:阴性对照 |
观察发现大部分脏器组织中缺少典型的病理变化。而肝脏的主要病变为广泛肝细胞变性、空泡变性、浊肿、水样变性而致气球样变,肝细胞胞浆疏松、空泡变性、胞核大小不等,出现双核、肝窦扩张或变窄,病理符合小叶性肝炎(图 3)。
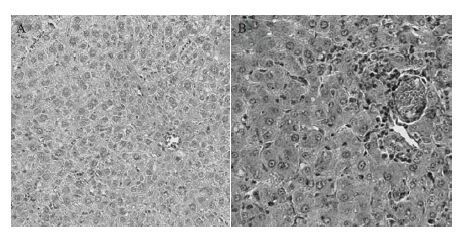
|
| 图 3 人工感染长爪沙鼠的病理组织学照片(40×) A:阴性对照;B:长爪沙鼠肝脏病理组织 |
免疫组织化学观察可见在细胞质中有HEVAg大量分布,细胞核与周围边的细胞界限清晰可见(图 4)。
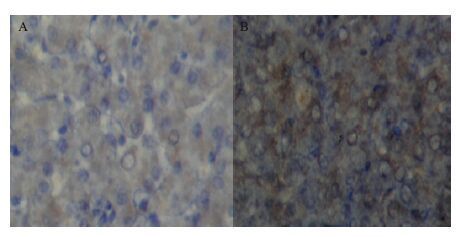
|
| 图 4 人工感染长爪沙鼠的免疫组织化学照片(100×) A:阴性对照;B:长爪沙鼠肝脏病理组织 |
目前,可实验感染HEV的动物主要有非人灵长类动物和猪,其中以非人灵长类动物最为常用[14]。自1983年Balayan等[12]首次使用戊肝患者的粪便提取物成功感染2只猕猴以来,许多非人灵长类动物模型(黑猩猩、恒河猴、枭猴、短尾猴、小绢猴、非洲绿猴等)逐步的建立了起来,其中较为常用的还是猕猴模型。猪作为基因Ⅲ型、Ⅳ型的自然宿主,也可应用于HEV感染的研究。1990年Balayan等[15]首次用1株亚洲人HEV成功感染猪,实现了HEV猪模型的制作。然而以非人灵长类动物或猪作为实验动物模型具有繁殖周期长、饲养管理繁、价格昂贵及来源有限等缺点[16]。
长爪沙鼠因其独特的生物学特性在病毒学领域、细菌学领域及寄生虫学领域中应用广泛。如在病毒学领域方面,广泛应用于肾综合征出血热[17]、流行性出血热病毒[18]和乙型肝炎病毒[19]等研究。说明,其在研究人类疾病及新药开发领域具有重要的价值。
本研究首先将HEV阳性猪粪便稀释悬液接种于长爪沙鼠,并每周采集血清和多种组织(心、肝、脾、肺、肾、肠系膜淋巴结、脾脏、小肠、回肠、直肠),随后通过ELISA和RT-PCR、免疫组织化学及病理组织学观察进行了感染后检测。
结果发现长爪沙鼠不仅可感染HEV,并且能产生HEV抗体,并且在血液、心、肝脏、脾脏、肺脏、肾脏、肠系膜淋巴结、粪便中检测到了HEV RNA。再通过对负链RNA的检测,发现在肝、脾、肺、肠系膜淋巴结中存在HEV负链RNA,进而表明HEV可以在以上组织中进行复制,其中病毒在肝脏中残留时间最久。Kasorn-dorkbua等[20]用HEV阳性样品接种至SPF猪体内,结果发现直接接种在心、胰组织的SPF猪未感染HEV,而直接接种在肝组织的SPF猪成功感染HEV,表明猪体内肝脏是HEV复制的主要器官;Lee等[21]使用原位杂交技术检测机体内不同组织中的HEV RNA,结果发现存在于肝脏部位的HEV RNA杂交信号最强。以上研究结果与本研究结果均说明肝脏是HEV复制的主要器官部位[22]。
在接种后的前2天内长爪沙鼠表现出了精神不振等症状,但之后的未再出现较为明显的临床症状,这与赵素元等[23]使用子午沙鼠作为HEV动物模型的结果相似,说明啮齿类动物模型在具有可大量用于实验,以降低偶然因素带来的影响,增加实验数据的稳定性和可靠性等优势之外,在临床表现方面还存在一些不足之处。但在HEV免疫组化染色发现,细胞质中有大量戊型肝炎病毒抗原(HEV-Ag)的分布,同时在组织病理学观察发现,除肝脏之外大部分脏器组织中缺少典型的病理变化,肝脏的主要病变为广泛肝细胞变性、空泡变性、浊肿、水样变性而致气球样变,肝细胞胞浆疏松、空泡变性、胞核大小不等,出现双核、肝窦扩张或变窄,病理现象均与小叶性肝炎相符合。有研究表明,在发展中国家大约有一半HEV感染患者表现出急性肝炎的症状[24],病理学观察可发现肝细胞排列紊乱、汇管区有多形核细胞和淋巴细胞浸润等现象[25]。Ji等[26]用Ⅳ型猪HEV通过静脉注射感染猕猴后,肝组织病理学检查后发现,肝细胞有轻到中度水肿、肝门周围存在淋巴细胞浸润等与人急性肝炎病理学现象相似的病变。说明长爪沙鼠在感染HEV后所显示的病变与人及非灵长类动物具有一定的相似性,这一结果说明长爪沙鼠具备作为HEV动物模型的潜在价值。我们有必要进一步对最佳接种途径、时间、环境及对不同基因型HEV的易感性、系统比较病理学观察等进行研究。长爪沙鼠HEV感染模型的建立,将为今后的HEV研究提供一种更为理想的途径,加速HEV的研究进程。
4 结论本实验探索了使用长爪沙鼠作为HEV感染模型的可行性。通过实验发现,长爪沙鼠具有可感染HEV及体内复制病毒的能力,同时还发现其组织病理学特征与人类具有相似性,说明其具有作为HEV动物模型的潜在价值。
| [1] | Khan J, Shafiq M, Mushtaq S, et al. Seropositivity and coinfection of hepatitis B and C among patients seeking hospital care in Islamabad, Pakistan[J]. BioMed Research International, 2014, 2014: 516859. |
| [2] | Rutjes SA, Bouwknegt M, Van Der Giessen JW, et al. Seroprevalence of hepatitis E virus in pigs from different farming systems in The Netherlands[J]. Journal of Food Protection, 2014, 77(4): 640–642. |
| [3] | Schroter M, Feucht HH, Schafer P, et al. GB virus C/hepatitis G virus infection in hemodialysis patients:determination of seroprevalence by a four-antigen recombinant immunoblot assay[J]. Journal of Medical Virology, 1999, 57(3): 230–234. |
| [4] | EL-TRAS WF, Tayel AA, EL-KADY NN. Seroprevalence of hepatitis E virus in humans and geographically matched food animals in Egypt[J]. Zoonoses and Public Health, 2013, 60(3): 244–251. |
| [5] | Khuroo MS. Discovery of hepatitis E:the epidemic non-A, non-B hepatitis 30 years down the memory lane[J]. Virus Research, 2011, 161(1): 3–14. |
| [6] | Mushahwar IK. Hepatitis E virus:molecular virology, clinical features, diagnosis, transmission, epidemiology, and prevention[J]. Journal of Medical Virology, 2008, 80(4): 646–658. |
| [7] | Xu B, Yu HB, Hui W, et al. Clinical features and risk factors of acute hepatitis E with severe jaundice[J]. World Journal of Gastroenterology:WJG, 2012, 18(48): 7279–7284. |
| [8] | Chau TN, Lai ST, Tse C, et al. Epidemiology and clinical features of sporadic hepatitis E as compared with hepatitis A[J]. The American Journal of Gastroenterology, 2006, 101(2): 292–296. |
| [9] | Renou C, Gobert V, Locher C, et al. Prospective study of Hepatitis E Virus infection among pregnant women in France[J]. Virology Journal, 2014, 11: 68. |
| [10] | Song YJ, Park WJ, Park BJ, et al. Hepatitis E virus infections in humans and animals[J]. Clinical and Experimental Vaccine Research, 2014, 3(1): 29–36. |
| [11] | Arankalle VA, Chadha MS, Tsarev SA, et al. Seroepidemiology of water-borne hepatitis in India and evidence for a third enterically-transmitted hepatitis agent[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(8): 3428–3432. |
| [12] | Balayan MS, Andjaparidze AG, Savinskaya SS, et al. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route[J]. Intervirology, 1983, 20(1): 23–31. |
| [13] | 肖丽, 戴方伟, 宋晓明, 等. 长爪沙鼠在病原感染中的应用[J]. 中国比较医学杂志, 2013, 23(7): 61–67. |
| [14] | 蒋雷, 尹革芬, 舒相华, 等. 戊型肝炎病毒树鼩感染模型的初步研究[J]. 云南农业大学学报:自然科学, 2013, 28(2): 186–189. |
| [15] | Balayan MS, Usmanov RK, Zamyatina NA, et al. Brief report:experimental hepatitis E infection in domestic pigs[J]. Journal of Medical Virology, 1990, 32(1): 58–59. |
| [16] | 耿家宝, 王玲, 朱永红, 等. 实验感染戊型肝炎病毒动物模型的研究进展[J]. 中国预防医学杂志, 2010, 11(4): 429–432. |
| [17] | 姚苹苹, 徐芳, 朱函坪, 等. 肾综合征出血热的4周龄长爪沙鼠模型[J]. 中国人兽共患病杂志, 2005, 21(1): 60–61. |
| [18] | 翁景清, 朱智勇. 双价流行性出血热灭活疫苗的研究和应用[J]. 医学研究通讯, 2000, 29(10): 21–22. |
| [19] | 赵月. 人源HBV人工感染沙鼠和C57BL/6小鼠的病理学研究[D]. 北京:中国农业大学, 2014. |
| [20] | Kasorndorkbua C, Halbur PG, Thomas PJ, et al. Use of a swine bioassay and a RT-PCR assay to assess the risk of transmission of swine hepatitis E virus in pigs[J]. Journal of Virological Methods, 2002, 101(1-2): 71–78. |
| [21] | Lee YH, Ha Y, Ahn KK, et al. Localisation of swine hepatitis E virus in experimentally infected pigs[J]. Veterinary Journal, 2009, 179(3): 417–421. |
| [22] | 李文贵, 段新慧, 张佳, 等. 戊型肝炎病毒感染模型研究进展[J]. 动物医学进展, 2014, 35(6): 103–106. |
| [23] | 赵素元, 廖立夫, 邹林樾, 等. 子午沙鼠感染戊肝病毒传代的实验研究[J]. 中国媒介生物学及控制杂志, 2001, 12(3): 215–217. |
| [24] | Kamar N, Dalton HR, Abravanel F, et al. Hepatitis E virus infection[J]. Clinical Microbiology Reviews, 2014, 27(1): 116–138. |
| [25] | Peron JM, Danjoux M, Kamar N, et al. Liver histology in patients with sporadic acute Hepatitis E:A study of 11 patients from South-West France[J]. Virchows Arch, 2007, 450(4): 405–410. |
| [26] | Ji YL, Zhu YH, Ling JR, et al. Swine hepatitis E virus in rural southern China:Genetic characterization and experimental infection in rhesus monkeys(macaca mulatta)[J]. Journal of Gastroenterol, 2008, 43(7): 565–570. |