2. 中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室,兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology,Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences,Lanzhou 730046
小反刍兽疫(PPR),俗称羊瘟,是由副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus)小反刍兽疫病毒(PPR virus,PPRV)引起的一种烈性、接触性传染病,主要感染山羊和绵羊[1]。该病危害严重,发病率达100%,若伴发其他疾病其死亡率可达100%,是世界动物卫生组织(OIE)法定必须报告的动物疫病,也是我国农业部制定的《法定动物疫病病种名录》中规定的Ⅰ类动物疫病[2]。自2007年我国西藏首次发生PPR疫情疫情以来,该病已在我国20多个省份发生,对我国的养殖户造成了重大经济损失,对我国的养羊业构成了严重威胁。
PPRV基因组是单股负链无节段RNA,共编码6种结构蛋白和两种非结构蛋白,分别为核衣壳蛋白(N)、磷蛋白(P)、囊膜基质蛋白(M)、纤突糖蛋白(F)、血凝素(H)和大蛋白(L)以及 C、V非结构蛋白。F蛋白和H蛋白是构成病毒表面纤突的两种糖蛋白,是决定病毒感染成功与否的关键因素,其中F蛋白通过促进病毒囊膜和细胞膜融合,使直接释放的N蛋白进入细胞浆,从而帮助病毒进入宿主细胞[3]。一般认为副黏科病毒的F蛋白促使细胞融合必须与H蛋白或HN蛋白共同参与,但有实验表明,PPRV F蛋白可使鸡红细胞溶解,在感染初期可导致溶血和细胞融合[1, 4]。由此证明,PPRV F蛋白在无HN蛋白参与的情况下仍能表现出融合功能。
作为融合的直接作用蛋白,F蛋白不仅直接参与病毒囊膜与宿主细胞膜的融合,而且也可以介导宿主临近细胞间的融合。F蛋白为了获得融合活性,必须由无生物学活性F0前体形式裂解成二硫键连接的融合前形式F1+F2异源二聚体,F1形成了膜锚定亚单位,这个亚单位在副黏病毒中有一些保守序列,其中有4个片段已经被深入研究,这4个片段分别是位于新生成N-端的融合多肽(FP)、2个七肽重复区(HR1和HR2)以及跨膜区(TM)。这些保守序列编译的多肽FP、HR1、HR2和TM共同介导宿主细胞膜和病毒囊膜的融合,在融合过程中,FP插入到宿主细胞膜,HR1和HR2相互作用使得病毒囊膜和宿主细胞膜相互靠近,它们的靠近进一步引起了融合[5, 6]。F蛋白HR1和HR2在融合触发时重新定位,形成稳定的六螺旋束(6-HB),在PPRV-F蛋白HR1和HR2形成的六螺旋束中,HR1是三聚体,HR2是单体。PPRV-F蛋白的HR1和HR2均能影响合胞体的形成,而且HR2的影响效果更强,FP在发挥融合活性时可能插入靶细胞膜中启动融合过程。
因此,鉴于F蛋白HR1和HR2在病毒融合过程的重要作用,本研究对小反刍兽疫的 F蛋白的七肽重复区进行原核表达,旨在获得高纯度的蛋白抗原,为进一步研究小反刍兽疫病毒F蛋白介导的融合过程奠定基础。
1 材料与方法 1.1 材料原核表达载体 pET-30a(+)、质粒PCAGGS-FLAG-F,羊抗 PPRV Nigeria75/1 株多克隆抗体均由家畜疫病病原生物学国家重点实验室保存;pMD19-T Simple Vector、Premix TaqTM(Ex TaqTM Version 2.0)购自TaKaRa公司;大肠杆菌Trans5α Chemically Competent Cell,BL21(DE3)Chemically Competent Cell购自北京全式金生物技术有限公司,限制性内切酶BamHⅠ和XhoⅠ购自NEB,T4连接酶购自Promega,Mouse Anti-His Tag Monoclonal Antibody购自北京中杉金桥生物技术有限公司,Goat Anti-Mouse IgG/HRP antibody购自北京博奥森生物技术有限公司,DNA凝胶回收试剂盒和质粒小量提取试剂盒购自爱思进生物技术(杭州)有限公司,Biodlight Western Chemiluminescent HRP Substrate购自巴傲得生物科技有限公司;镍琼脂糖凝胶 FF购自北京韦氏博慧色谱科技有限公司;其他常规试剂均为进口或国产分析纯级产品。
1.2 方法 1.2.1 引物的设计与合成根根据PPRV Nigeria75/1中F基因碱基序列,利用Oligo 6.0分别设计用于扩增F基因HR1和HR2的特异性引物,分别在两对引物的上游、下游引入BamHⅠ和XhoⅠ酶切位点(表 1)。
以本实验室保存的F基因全长PCAGGS-FLAG-F质粒为模板,分别以两对特异性引物PCR扩增获得目的基因。反应体系为50 mL:上、下游引物各2 mL,2×Premix Taq 25 mL,模板1 mL,ddH2O 20 mL。PCR反应条件:94℃ 5 min;95℃ 1 min,54℃ 40 s,72℃ 40 s,35个循环;72℃延伸8 min。切胶回收目的片段,对目的片段及载体进行双酶切,胶回收酶切产物,连接转化,挑取单克隆,PCR及双酶切鉴定,将初步鉴定的阳性克隆送至苏州金唯智生物科技有限公司北京分公司进行测序。
1.2.3 重组蛋白表达菌株的确定将筛选出的阳性重组质粒转化到BL21(DE3),挑取单克隆,提取质粒进行PCR和双酶切鉴定,选取阳性克隆送至苏州金唯智生物科技有限公司北京分公司进行测序,测序正确的分别命名为pET30a-HR1和pET30a-HR2。
1.2.4 重组蛋白表达将过夜培养的阳性pET30a-HR1和pET30a-HR2重组菌液按1%的量分别转接于含50 μg/mL Kan的LB液体培养基中,37℃,200 r/min振荡培养至OD600达到0.6-0.8时加入终浓度为1 mmol/L的IPTG,37℃诱导6 h,离心收集菌液,-70℃冻融3次,冰浴中超声裂解20 min,然后13 000 r/min离心15 min,分别收集上清和沉淀,用与上清等体积的PBS重悬沉淀,将上清和沉淀分别进行SDS-PAGE电泳分析目的蛋白表达情况。
1.2.5 重组蛋白表达诱导条件的确定选取表达克隆,过夜培养,按1%的比例分别转接于含50 μg/mL Kan的LB液体培养基中,37℃,200 r/min振荡培养至OD600为0.6-0.8时分成三组,第一组诱导的条件为37℃、6 h,IPTG的终浓度依次为0、0.2、0.4、0.6、0.8和1 mmol/L;第二组诱导温度37℃,IPTG终浓度1 mmol/L,诱导时间依次为2、4和6 h;第三组诱导时间为6 h,IPTG终浓度为1 mmol/L,诱导温度依次为21℃、28℃和37℃。收集菌体,8 mol/L尿素裂解,SDS-PAGE分析对比确定最优表达条件。
1.2.6 表达产物的纯化在最优条件下大量表达重组蛋白,12 000 r/min离心5 min,PBS洗2次,按照每克菌体湿重加10 mL PBS的比例重悬,-70℃冻融3次,冰浴中超声裂解,13 000 r/min离心15 min,收集上清,按照镍琼脂糖凝胶 FF说明书操作。
1.2.7 表达产物的鉴定将纯化重组蛋白进行SDS-PAGE电泳,用eBlotTM Protein Transfer System转移到PVDF膜上,5%脱脂奶粉37℃封闭1 h,用PBST洗涤3次,每次10 min;加入Mouse Anti-His Tag Monoclonal Antibody(1∶1 000),37℃孵育1 h,同上洗涤;加入Goat Anti-Mouse IgG/HRP antibody(1∶4 000),37℃孵育40 min,同上洗涤后用Biodlight Western Chemiluminescent HRP Substrate显色试剂盒进行ECL显色,化学发光成像仪分析。平行实验以兔抗PPRV Nigeria 75/1株F蛋白多克隆抗体为一抗(按1∶50稀释),Mouse Anti-Rabbit IgG/HRP antibody(按1∶4 000稀释)为二抗进行Western blot,对表达的蛋白进行免疫活性分析。
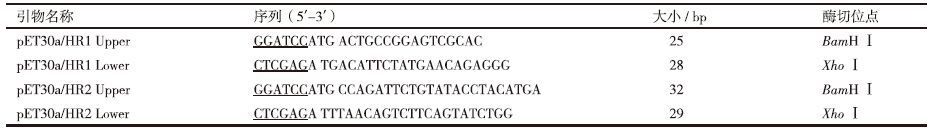
2 结果 2.1 HR1和HR2基因的扩增根据所设计的特异性引物,以PCAGGS-FLAG-F重组质粒为模板,成功扩增获得了与预期目的条带大小一致的条带,HR1大小为189 bp,HR2大小为153 bp(图 1)。
|
| 图 1 目的基因的PCR扩增 M:DNA Marker;1,2:HR1;3,4:HR2 |
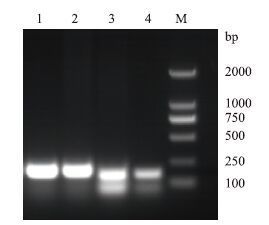
回收纯化目的条带,用BamHⅠ和XhoⅠ双酶切PCR产物和表达载体pET-30a(+),将目的产物亚克隆至pET-30a(+),获得重组质粒pET-30a(+)/HR1、pET-30a(+)/HR2,经双酶切(图 2)、PCR 鉴定结果正确,测序结果与原序列一致,成功构建了HR1和HR2的原核表达载体。
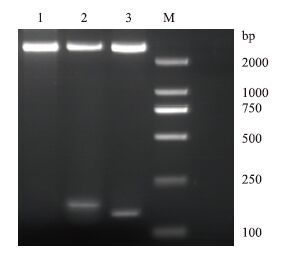
|
| 图 2 重组质粒的酶切鉴定 M:DNA Marker;1:pET-30a(+);2:pET30a-HR1;3:pET30a-HR2 |
SDS-PAGE分析结果(图 3)表明,在37℃、IPTG终浓度为1 mmol/L的条件下诱导6 h获得了与目的蛋白大小接近的重组蛋白,而转染空载体pET-30a(+)的菌株在相同条件下未表达出相应的蛋白条带,并且重组蛋白大多数出现在上清中,说明所表达的蛋白为可溶性表达。
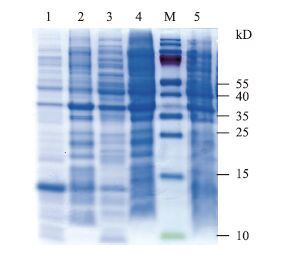
|
| 图 3 表达产物的SDS-PAGE分析 M:蛋白Marker;1:可溶性pET30a-HR1;2:包涵体pET30a-HR1;3:可溶性pET30a-HR2;4:包涵体pET30a-HR2;5:pET-30a(+)对照 |
经过对诱导温度、时间及诱导剂IPTG用量的筛选,确定构建的原核基因工程菌最佳反应条件pET-30a(+)-HR1为28℃、IPTG终浓度为1 mmol/L、200 r/min、诱导6 h,pET-30a(+)-HR2为28℃、IPTG终浓度为0.4 mmol/L、200 r/min、诱导6 h。
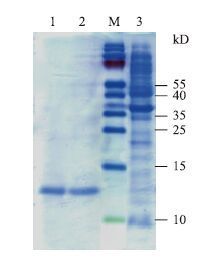
2.5 表达产物纯化结果将超声裂解所得的上清与镍琼脂糖凝胶FF混合均匀,用不同咪唑浓度的缓冲液洗脱,SDS-PAGE电泳。结果(图 4)显示,pET30a-HR1在300 mmol/L咪唑浓度时,目的蛋白的洗脱量最大,杂质蛋白量最小;pET30a-HR2在100 mmol/L咪唑浓度时,目的蛋白的洗脱量最大,杂质蛋白量最小。
|
| 图 4 表达产物纯化结果SDS-PAGE分析 M:蛋白Marker;1:pET30a-HR1;2:pET30a-HR2;3:pET-30a(+)对照 |
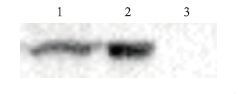
用抗His标签抗体作为一抗的Western blotting鉴定,结果(图 5)显示,诱导后的pET-30a(+)-HR1/BL21(DE3)和pET-30a(+)-HR2/BL21(DE3)均在预期分子量大小处出现特异性条带,说明重组蛋白获得表达,且与His标签表达为融合蛋白,利于后续的蛋白纯化。用羊抗PPRV Nigeria 75/1株多克隆抗体作为一抗的Western blotting结果(图 6)显示,与抗His标签的抗体作为一抗的结果一致,证明重组蛋白具有良好的反应原性。

|
| 图 5 纯化的表达产物Western blot分析 1:pET-30a(+)对照;2:pET30a-HR1;3:pET30a-HR2(一抗为Mouse Anti-His Tag Monoclonal Antibody) |
|
| 图 6 纯化的表达产物Western blot分析 1:pET30a-HR1;2:pET30a-HR2;3:pET-30a(+)对照(一抗为兔抗PPRV Nigeria 75/1株F蛋白多克隆抗体) |
在病毒感染过程中,病毒囊膜和宿主细胞膜的融合是非常重要的一步。作为融合的直接作用蛋白,副黏科病毒F蛋白不仅直接参与病毒囊膜与宿主细胞膜的融合,也可以介导宿主临近细胞间的融合。
在F蛋白介导的宿主细胞和病毒囊膜的融合过程中,F基因的保守序列表达的融合多肽FP、2个七肽重复区蛋白HR1和HR2以及跨膜区蛋白TM起着重要的作用,其中HR1和HR2可以拉近病毒囊膜蛋白和宿主细胞受体的距离,进而导致了融合。在PPRV-F蛋白HR1和HR2形成的六螺旋束中,HR1是三聚体,HR2是单体,即HR1分子以α螺旋的形式形成三聚体核心,HR2分子同样以α螺旋的形式反向平行结合于HR1分子形成的沟槽中,这种结构被认为是F蛋白最稳定的构象。虽然F蛋白晶体结构中缺乏TM区的结构,但最近的研究表明副黏病毒F蛋白TM区是蛋白锚定于细胞膜所必需的,TM区连接到三聚体上可能有助于稳定融合前构象。F蛋白的重折叠产生了新的亚基,破坏了许多融合前的构象,整体上产生一种更紧凑和稳定的结构,FP采用一种对融合具有重要意义的螺旋结构,而且FP的结构与自身和TM都相关[7, 8]。有报道认为一些副黏病毒的胞质区也与融合活性有关。
在副黏病毒感染中,抗F蛋白的抗体对阻止感染和防止病毒在体内的扩散起主要作用[9],蛋白单抗能完全抑制新城疫病毒(NDV)在鸡体内的生长,防止鸡群死亡[10]。NDV F蛋白DNA疫苗能够有效保护鸡群抵抗强毒NDV的感染[11-13]。近年来,国内外学者对F蛋白的研究日益增多。在参与VLPs装配方面,证明编码F蛋白的基因参与了NDV[14]和MV[15, 16]的VLPs装配。PPRV F蛋白TM区对VLPs的装配和释放无明显影响,但会对细胞的状态产生影响[17]。Rahaman等[18]证明PPRV F蛋白的HR1和HR2均能抑制合胞体的形成,而且HR2的抑制效果更强。目前,HR1或HR2单独介导宿主细胞膜和病毒囊膜的融合机制还不清楚。
在原核表达系统中,虽然蛋白多易以包涵体形式表达,导致蛋白不能正确折叠成天然结构而无生物学活性,但由于目的蛋白、载体及表达条件的不同,也可表达出有活性的重组蛋白。在pET系统中,鉴于pET30a(+)载体具有标签小、影响较小的优点,本实验选用pET30a(+)作为载体,构建了重组质粒pET30a/HR1和pET30a/HR2,并设置了不同的表达条件,期望表达出可溶性的、有活性的蛋白。
Western blotting结果表明,分别以抗His标签的抗体和抗PPRV的阳性血清作为一抗,重组工程菌诱导表达样品均在预期分子量大小处检测到特异性条带,而阴性对照中未出现大小一致的条带,这说明成功表达了融合蛋白,表达的融合蛋白具有良好的特异性和免疫反应性。这为后续研究PPRV F基因缺失体对病毒囊膜和宿主细胞膜融合的影响奠定了基础。
4 结论构建pET30a(+)/HR1和pET30a(+)/HR2重组表达载体,将其转化BL21(DE3),在IPTG诱导下成功表达出带His标签的融合蛋白,最佳表达条件分别为:pET-30a(+)-HR1诱导温度28℃、IPTG终浓度为1 mmol/L、摇床转速200 r/min、诱导时间6 h;pET-30a(+)-HR2诱导温度28℃、IPTG终浓度为0.4 mmol/L、摇床转速200 r/min、诱导时间6 h。通过镍琼脂糖凝胶 FF分离出高纯度的融合His标签的蛋白。
Western blotting分析显示,这两种蛋白与抗His标签的抗体和抗PPRV Nigeria 75/1株多克隆抗体均能发生特异性反应,即重组蛋白具有良好的特异性和反应原性。
| [1] | 殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997. |
| [2] | 世界动物卫生组织国际动物卫生法典. 世界动物卫生组织国际动物卫生法典[M]. 北京: 中国农业科学技术出版社, 2002.73-76. |
| [3] | Mase M, Murayama K, Karino A, et al. Analysis of the fusion protein gene of Newcastle disease viruses isolated in Japan[J]. Journal of Veterinary Medical Science, 2011, 73(1): 47–54. |
| [4] | Devireddy LR, Raghavan R, Ramachandran S, et al. The fusion protein of peste des petits ruminants virus is a hemolysin[J]. Archives of Virology, 1999, 144(6): 1241–1247. |
| [5] | Chang A, Dutch RE. Paramyxovirus fusion and entry:multiple paths to a common end[J]. Viruses, 2012, 4(4): 613–636. |
| [6] | Apte-Sengupta S, Negi S, Leonard VHJ, et al. Base of the measles virus fusion trimer head receives the signal that triggers membrane fusion[J]. Journal of Biological Chemistry, 2012, 287(39): 33026–33035. |
| [7] | Smith EC, Gregory SM, Tamm LK, et al. Role of sequence and structure of the hendra fusion protein fusion peptide in membrane fusion[J]. Journal of Biological Chemistry, 2012, 287(35): 30035–30048. |
| [8] | Donald JE, Zhang Y, Fiorin G, et al. Transmembrane orientation and possible role of the fusogenic peptide from parainfluenza virus 5(PIV5)in promoting fusion[J]. Proceedings of the National Academy of Sciences, 2011, 108(10): 3958–3963. |
| [9] | Merz DC, Scheid A, Choppin PW. Importance of antibodies to the fusion glycoprotein of paramyxoviruses in the prevention of spread of infection[J]. The Journal of Experimental Medicine, 1980, 151(2): 275–288. |
| [10] | Umino Y, Kohama T, Sato TA, et al. Protective Effect of monoclonalantibodies to newcastle disease virus in passive immunization[J]. Journal of General Virology, 1990, 71(5): 1199–1203. |
| [11] | Letellier C, Burny A, Meulemans G. Construction of a pigeonpox virus recombinant:expression of the Newcastle disease virus(NDV)fusion glycoprotein and protection of chickens against NDV challenge[J]. Archives of Virology, 1991, 118(1-2): 43–56. |
| [12] | Sakaguchi M, Nakamura H, Sonoda K, et al. Protection of chickens from Newcastle disease by vaccination with a linear plasmid DNA expressing the F protein of Newcastle disease virus[J]. Vaccine, 1996, 14(8): 747–752. |
| [13] | Taylor J, Edbauer C, Rey-Senelonge A, et al. Newcastle disease virus fusion protein expressed in a fowlpox virus recombinant confers protection in chickens[J]. Journal of Virology, 1990, 64(4): 1441–1450. |
| [14] | Pantua HD, McGinnes LW, Peeples ME, et al. Requirements for the assembly and release of Newcastle disease virus-like particles[J]. Journal of Virology, 2006, 80(22): 11062–11073. |
| [15] | Cathomen T, Mrkic B, Spehner D, et al. A matrix-less measles virus is infectious and elicits extensive cell fusion:consequences for propagation in the brain[J]. The EMBO Journal, 1998, 17(14): 3899–3908. |
| [16] | Pohl C, Duprex WP, Krohne G, et al. Measles virus M and F proteins associate with detergent-resistant membrane fractions and promote formation of virus-like particles[J]. Journal of General Virology, 2007, 88(4): 1243–1250. |
| [17] | 王秋霞. 小反刍兽疫病毒样颗粒的装配与释放研究[D]. 北京:中国农业科学院, 2013. |
| [18] | Rahaman A, Srinivasan N, Shamala N, et al. The fusion core complex of the peste des petits ruminants virus is a six-helix bundle assembly[J]. Biochemistry, 2003, 42(4): 922–931. |