2. 云南省烟草农业科学研究院,昆明 650031
2. Yunnan Academy of Tobacco Agricultural Sciences, Kunming 650031
烟草(Nicotiana tabacum L.)是以积累淀粉为主的粉叶类植物[1]。淀粉代谢是烟叶生长和产质形成过程中较基本的物质代谢途径之一,与烟叶品质和风格的形成密切相关。淀粉在烟草叶片细胞中的合成、积累、分解、转化状况,决定着烤后叶片内部各种化学成分间的协调程度[2]。烟叶中淀粉含量及其转化形成的糖含量的高低,直接影响烟叶燃吸的香吃味特性,是决定烟叶内在和外观品质的重要因素[3]。初烤后烟叶残留的淀粉是对烟叶色、香、味不利的化合物,一方面淀粉会影响燃烧速度和燃烧的完全性,另一方面淀粉在燃吸时会产生糊焦气味,对烟气产生不良影响[4-6]。烤烟是喜温作物,对温度反应敏感[3]。烟叶中的淀粉随着烟叶生长和成熟而逐步积累,积累程度也与温度有直接联系[7]。
目前,烟草淀粉代谢研究较多的主要集中在不同生态区、不同海拔条件下对淀粉含量及酶活性的影响[8-10],而且多为整个生育期或某个生育期,而不同温度对不同生育期烟草淀粉代谢的研究还尚未见报道。本研究选取大田条件下正常生长的烟草云烟87作为研究对象,通过精密控温的人工气候室分别模拟云南江川、贵州遵义和河南襄县的气温条件,对烤烟生长的3个时期(移栽-团棵期、团棵-现蕾期、成熟期)进行控温试验,对不同温度处理下烟叶及根系的淀粉代谢规律及基因表达进行比较研究,旨在探讨不同温度对淀粉积累及香气风格形成的影响,以揭示不同生育期温度与淀粉的动态关系,为淀粉对烟叶品质的影响提供理论基础,并为建立烟叶特色的区域提供理论依据。
1 材料与方法 1.1 材料 1.1.1 试验材料选用由云南省烟草农业科学研究院选育的烤烟品种云烟87为试验材料。
1.1.2 材料培养与处理 1.1.2.1 育苗采用漂浮育苗方式培育烟苗,移栽(行×株距,120 cm×50 cm)至黑桶(35 cm×40 cm,土壤类型为水稻土)后,置于云南玉溪研和基地室外生长,田间管理按常规。实验在云南省烟草农业科学研究院,于2014年3月-12月进行。
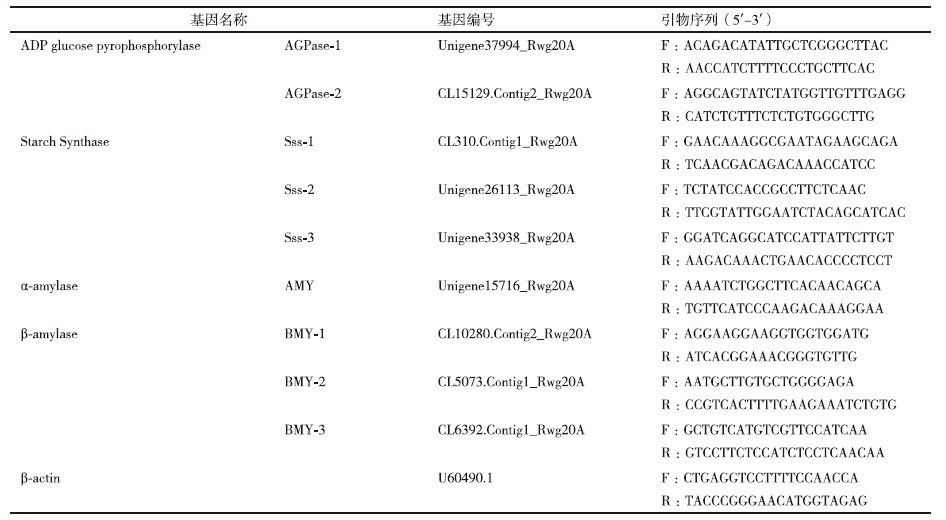
1.1.2.2 不同温度处理当移栽至黑桶内的烟苗分别长至还苗10 d、团棵期、现蕾期时,搬入精密人工气候室进行不同的温度处理。分别取移栽-团棵期、团棵-现蕾期、成熟期3个时期,设置的3个温度分别模拟河南襄县、云南江川和贵州遵义地区烟草栽培季节的气温特征(表 1)。试验光强为200 μmol/(m2>·s),湿度(夜晚40%,白天50%)、CO2浓度(450 ppm)。生长温度处理日变化见图 1。
|
| 图 1 不同温度的设置 |
将烟苗以自下而上第12片烟叶为研究对象(移栽-团棵期以刚展开的最大叶为研究对象),开始不同温度处理时计为0 d,之后采集时间见表 1。取样时,每次取 3-5 株烟草,将叶脉去掉后,取叶片中部的部分,剪碎并混匀,称取0.3 g,用液氮速冻,每个处理的每一个测定指标设3个重复。将叶片两端的部分剪下,并去主脉,杀青,烘干,用于淀粉含量的测定。
1.2 方法 1.2.1 淀粉含量的测定 1.2.1.1 样品制备按照我国烟草行业标准测定烟叶产品的含水率并制备烟末。将烟叶用粉碎机粉碎,过40目筛后置于棕色瓶中密闭保存。
淀粉含量测定 淀粉含量的测定参照何其芳等[11]的方法。
1.2.2 淀粉代谢关键酶活性测定淀粉合成相关酶(ADPG焦磷酸化酶、可溶性淀粉合成酶)活性的测定参照程方民等[12]的方法;淀粉酶活性测定参照史宏志等[13]的方法。
1.2.3 淀粉代谢相关基因表达分析采用Life Tech-nologies 公司的Trizol Reagent提取样品组织总RNA。提取的RNA质量由超微量分光光度计(Thermo Na-ndrop 2000C)检测和琼脂糖凝胶电泳检测。检测合格的RNA用宝生物(大连)有限公司的反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)进行反转录。
以反转录得到的cDNA为模板,按照宝生物(大连)有限公司的荧光定量分析试剂盒SYBR Premix Ex Taq Ⅱ(Perfect RealTime)进行实时荧光定量PCR反应,体系为:SYBR Premix Ex TaqTM Ⅱ(2×)10 μL,上下游引物各0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA模板2 μL,DEPC灭菌水6.8 μL,总体积20 μL。根据熔解曲线检验引物特异性。引物序列见表 2,基因编号和序列来自本实验室前期对云烟87的全转录组测序结果。
将反转录得到的cDNA模板按照配比梯度稀释方法稀释成5倍、25倍、125倍、625倍和3 125倍5个梯度浓度。用筛选到的特异性引物和内参基因β-actin作为引物,制作标准曲线。每个模板梯度设3个重复。在安捷伦Mx3005P型荧光定量PCR仪上进行实时荧光定量PCR反应。每个样品设3个重复。反应体系及反应条件参照宝生物(大连)有限公司的荧光定量分析试剂盒SYBR Premix Ex Taq Ⅱ(Per-fect Real Time)的说明书进行。利用其自带的软件对数据进行解析,通过相对值分析淀粉代谢相关基因的表达情况。
每组试验重复3次,每次3个测定重复。试验原始数据用SPSS11.5统计软件分析和Duncan多重比较,图中小写字母表示P<0.05水平显著差异。统计结果用Sigmaplot10.0作图。
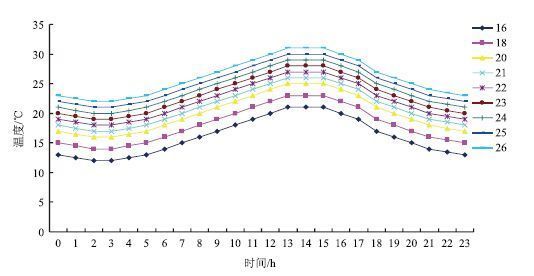
2 结果 2.1 温度对不同生育期淀粉含量及相关酶活性的影响淀粉是烟草叶片光合作用的直接产物,随着烟叶的生长而呈现逐步积累的过程。移栽-团棵期叶片中的淀粉含量变化(图 2-A)显示,随着处理时间的延长,淀粉含量均不断积累,在30 d达到最大积累量,且在整个处理期都表现为20℃<18℃<16℃。AGPase、SSs和SBE是合成淀粉的关键酶,AGPase能催化G-1-P 转化为 ADPG,作为淀粉合成的直接底物,SSs能将 ADPG 的葡萄糖基转移到以 α-1,4 糖苷键连接的葡聚糖的非还原性末端[14, 15]。淀粉酶是能将淀粉水解成葡萄糖、麦芽糖等一类小分子物质,在淀粉的分解中起重要作用。移栽-团棵期叶片中AGPase活性在均温20℃和16℃下不断升高,18℃下呈波动上升,3个温度均在30 d时活性达到最大(图 2-B)。SSs活性变化(图 2-C)表明,活性均为先升高后降低,且均在10 d达到最大。淀粉酶活性如图 2-D所示,都表现为先升高后降低趋势。
|
| 图 2 移栽-团棵期温度对烟叶淀粉含量(A)、AGPase(B)、SSs(C)和淀粉酶(D)活性的影响 |
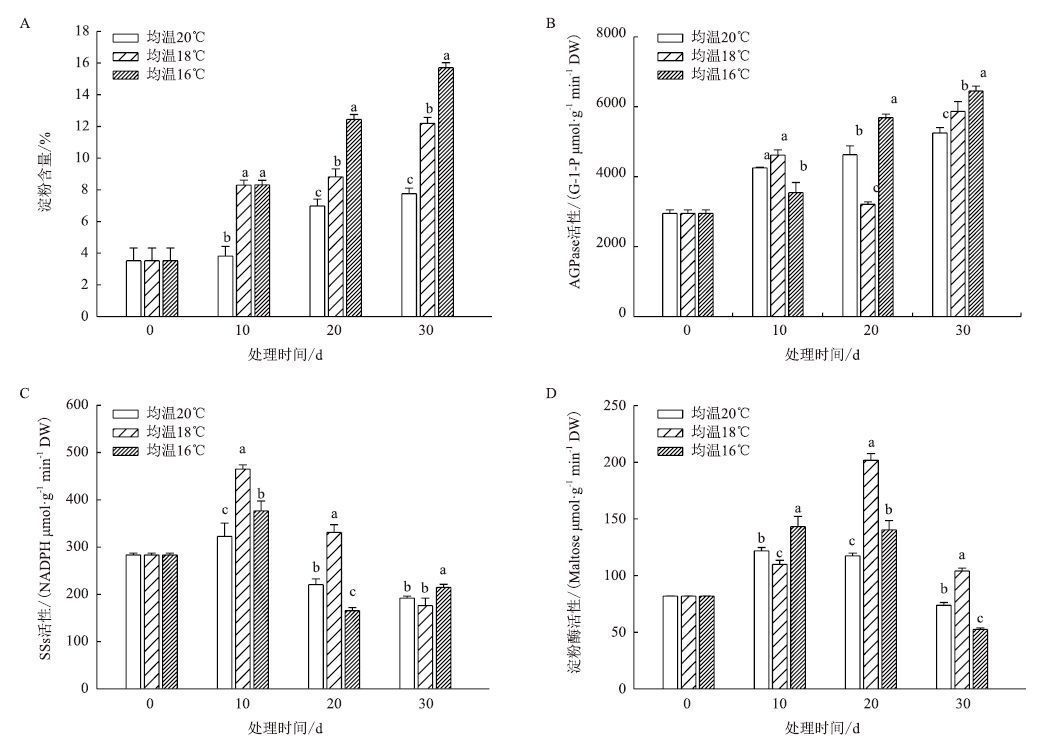
团棵-现蕾期叶片中淀粉含量变化(图 3-A)显示,3个温度下淀粉含量均不断积累,均温23℃的淀粉积累量大于均温25℃和21℃。叶片中AGPase活性变化(图 3-B)表明,在3个温度下活性均不断升高,均在20 d时达到最大,此时均温23℃活性最高。SSs活性(图 3-C)在均温25℃条件下不断升高,在均温23℃和21℃下先升高后降低,在10 d时达到最大。淀粉酶(图 3-D)在3个温度下均不断下降,20 d时活性最低。
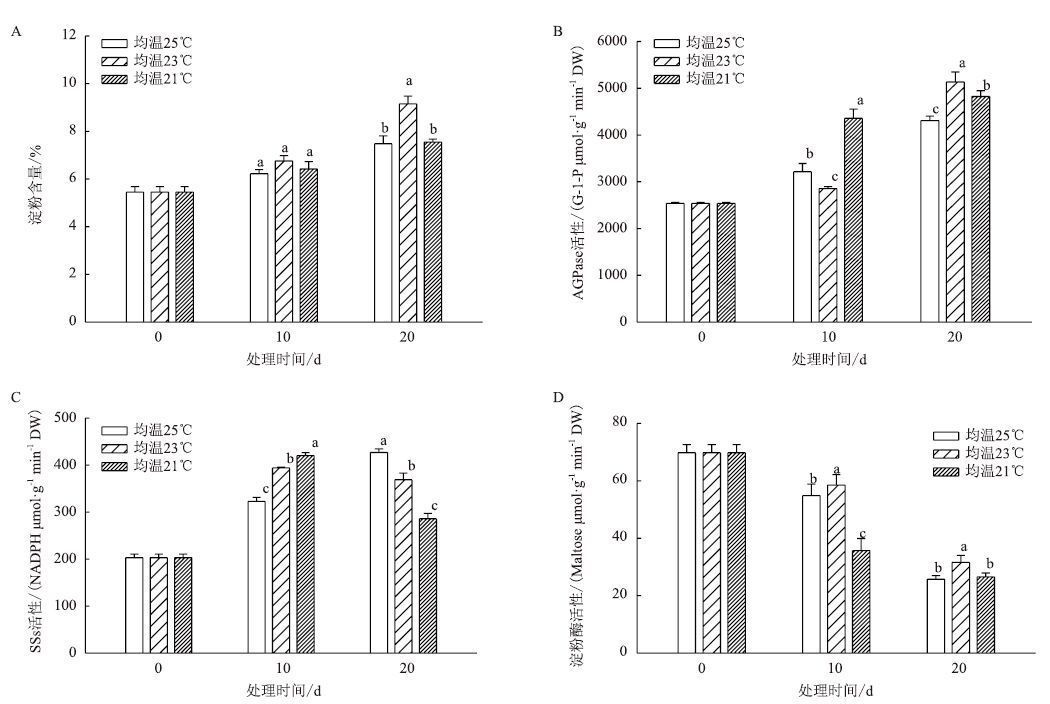
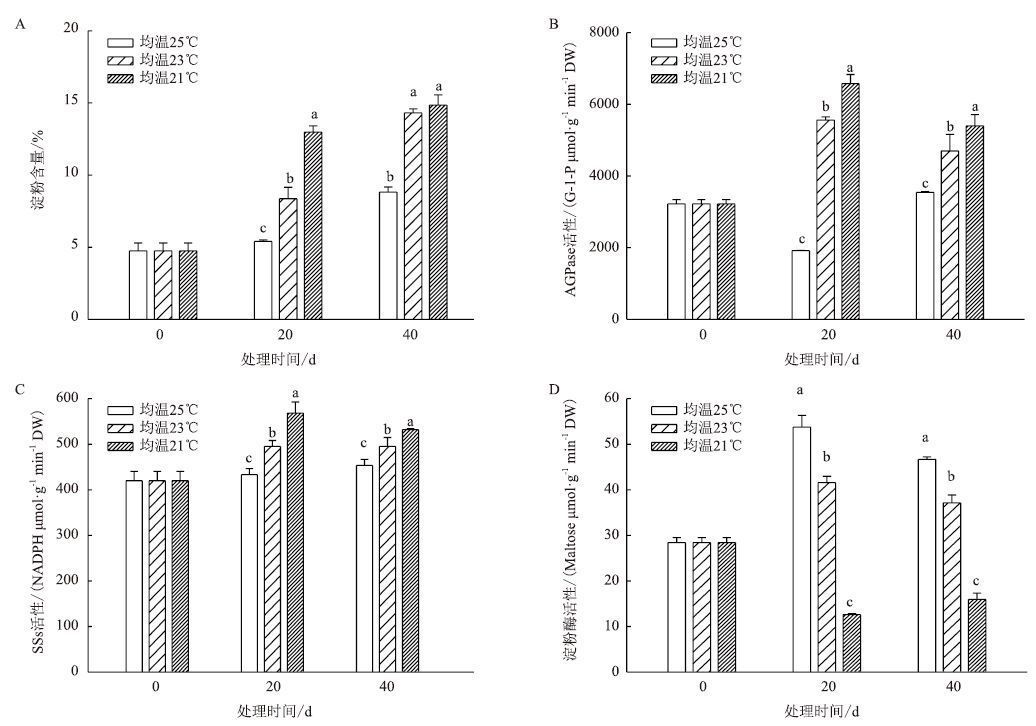
成熟期叶片中淀粉含量变化(图 4-A)显示,在整个处理期,3个温度下淀粉含量均不断升高,都表现为25℃<23℃<21℃。合成淀粉的相关酶AGPase活性(图 4-B)和SSs活性(图 4-C)在整个处理期均表现为均温25℃<23℃<21℃,而分解淀粉的淀粉酶活性在整个处理期活性表现为均温21℃<23℃<25℃(图 4-D)。
|
| 图 3 团棵-现蕾期温度对烟叶淀粉含量(A)、AGPase(B)、SSs(C)和淀粉酶(D)活性的影响 |
|
| 图 4 成熟期温度对烟叶淀粉含量(A)、AGPase(B)、SSs(C)和淀粉酶(D)活性的影响 |
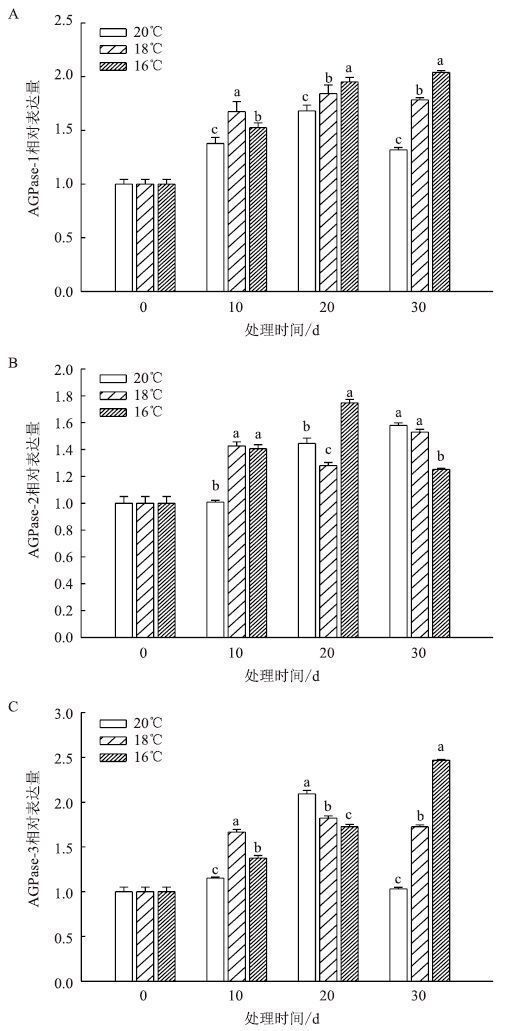
移栽-团棵期叶片中AGPase相关基因表达情况如图 5所示。AGPase-1在均温20℃和18℃下表达量先升高后降低,20 d时达到最大;16℃下不断上升,在30 d达到最大。AGPase-2在均温20℃和16℃下的表达量为先升高后降低趋势,在20 d时表达量达到最大,均温18℃下波动上升,在30 d达到最大。AGPase-3在均温20℃和18℃下的表达量为先升高后降低趋势,在20 d时表达量达到最大,均温16℃下表达量不断上升,30 d时达到最大。
|
| 图 5 移栽-团棵期温度对叶片 AGPase 相关基因表达的影响 |
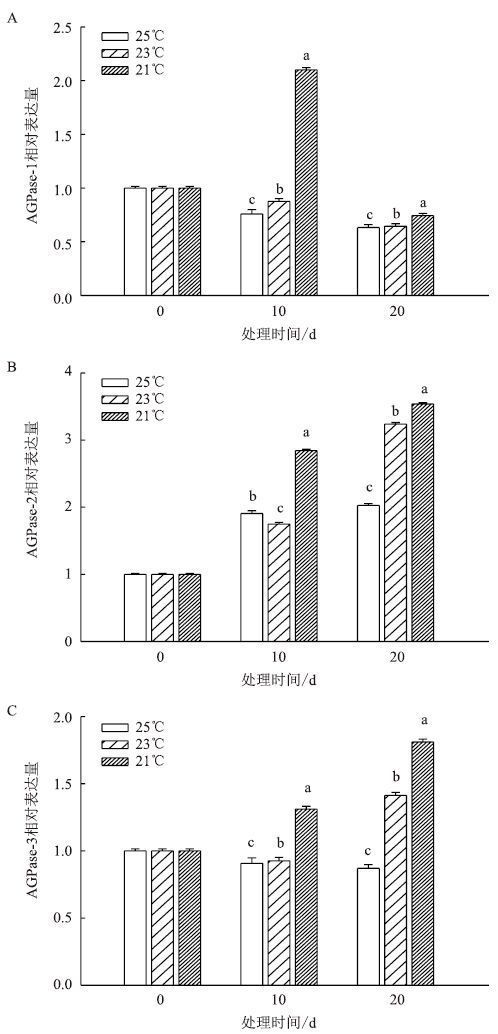
团棵-现蕾期叶片中AGPase相关基因表达情况(图 6)显示,AGPase-1在均温25℃和23℃下表达量不断降低,均温21℃下先升高后降低,在处理10 d时达到最大。AGPase-2在3个温度下的表达量均不断升高,20 d达到最大。AGPase-3在均温25℃下表达量不断降低,23℃下先降低后升高,20 d达到最大;21℃下不断升高,在20 d时表达量达到最大。
|
| 图 6 团棵-现蕾期温度对叶片 AGPase 相关基因表达的影响 |
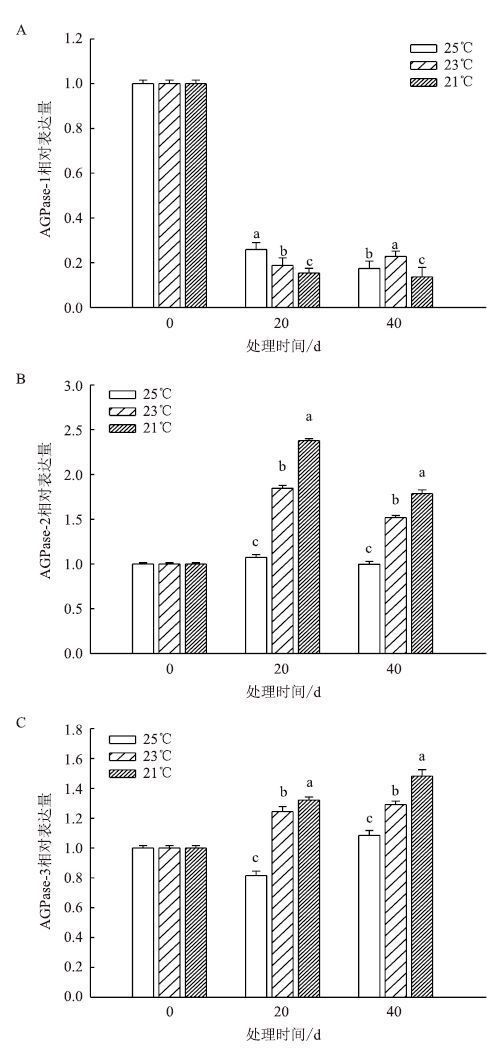
成熟期叶片中AGPase相关基因表达情况如图 7所示。AGPase-1在3个温度下表达量急剧降低。AGPase-2在3个温度下的表达量均先升高后降低,且25℃<23℃<21℃。AGPase-3也表现为25℃<23℃<21℃。
|
| 图 7 成熟期温度对叶片 AGPase 相关基因表达的变化 |
移栽-团棵期叶片中SSs相关基因表达结果(图 8)显示,SSs-1在3个温度下表达量均为先升高后降低,20 d时达到最大;SSs-2在3个温度下的表达量也为先升高后降低趋势,均在10 d时表达量达到最大;SSs-3在均温18℃下的表达量较高。
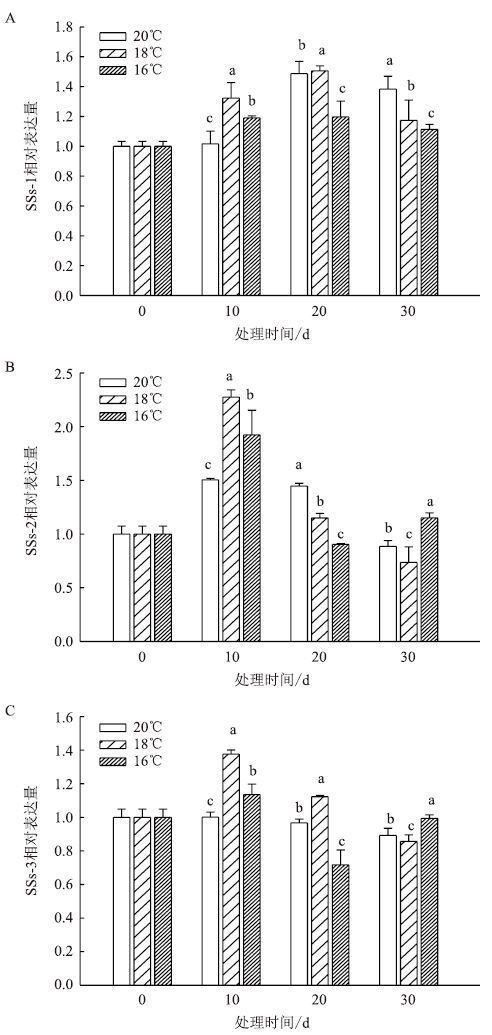
|
| 图 8 移栽-团棵期温度对叶片 SSs 相关基因表达的影响 |
团棵-现蕾期叶片中SSs相关基因表达结果(图 9)显示,SSs-1在均温25℃和23℃下表达量不断升高,在处理20 d时达到最大;均温21℃下先升高后降低,在10 d时达到最大表达量。SSs-2在均温25℃和23℃下的表达量先降低后升高,25℃下的表达量均低于处理前的表达量,23℃的表达量在20 d达到最大;均温21℃下表达量先升高后降低。SSs-3在均温25℃下表达量先降低后升高,20 d时达到最大;21℃下表达量不断降低。
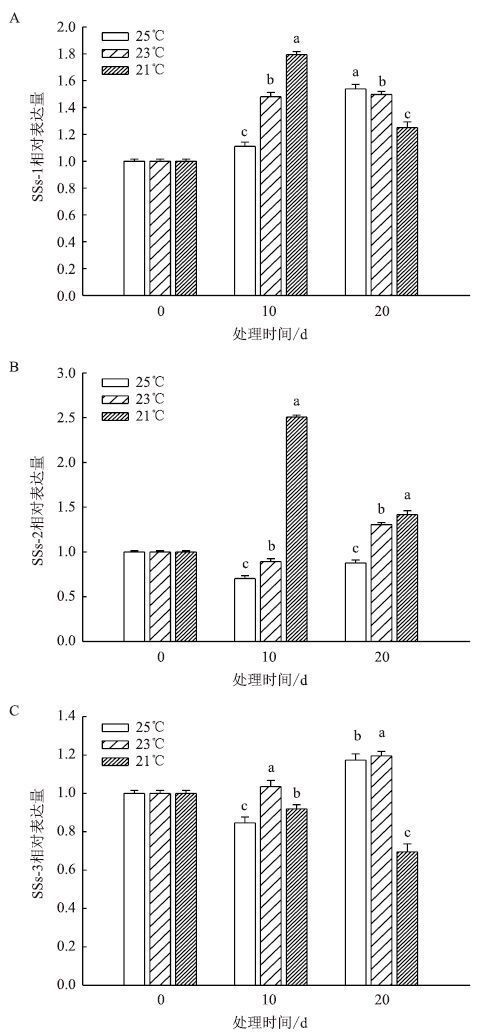
|
| 图 9 团棵-现蕾期温度对叶片 SSs 相关基因表达的影响 |
成熟期叶片中SSs相关基因表达结果(图 10)显示,SSs-1在3个温度下表达量均降低。SSs-2在3个温度下均不断升高,且都表现为21℃>23℃>25℃。SSs-3在均温25℃和23℃下的表达量不断升高,21℃下先升高后降低,同样是21℃>23℃>25℃。
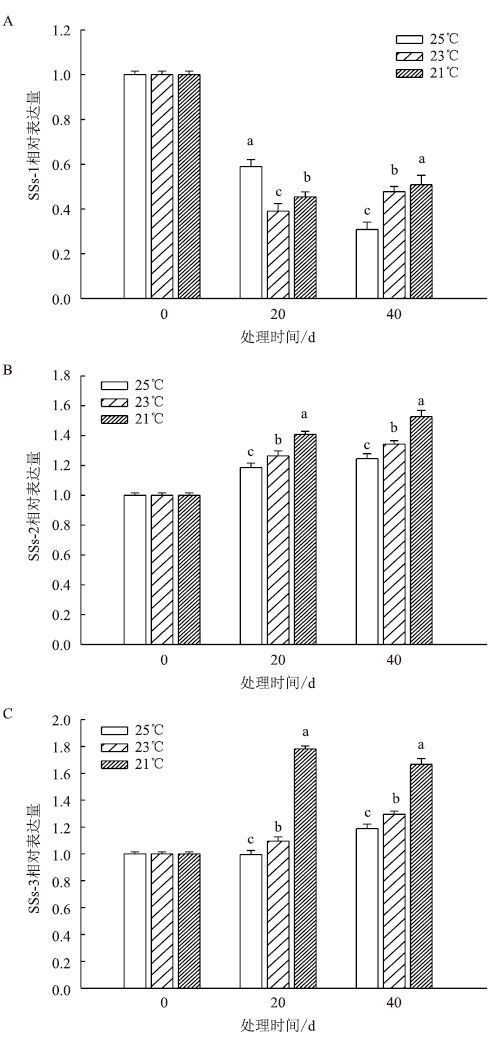
|
| 图 10 成熟期温度对叶片 SSs 相关基因表达的影响 |
2.2.3 淀粉酶相关基因 移栽-团棵期叶片中淀粉酶相关基因表达结果(图 11)显示,BMY-1在均温20℃和16℃下表达量均低于0 d对照,均温18℃在20 d表达量急剧升高,其他点表达量均低于0 d的表达量。BMY-2在3个温度下的表达量均为先升高后降低趋势,都在20 d时表达量达到最大。BMY-3在3个温度下表达量的变化趋势均为10 d时降低,20 d时升高,30 d时又降低。AMY在3个温度下表达量均不断升高。
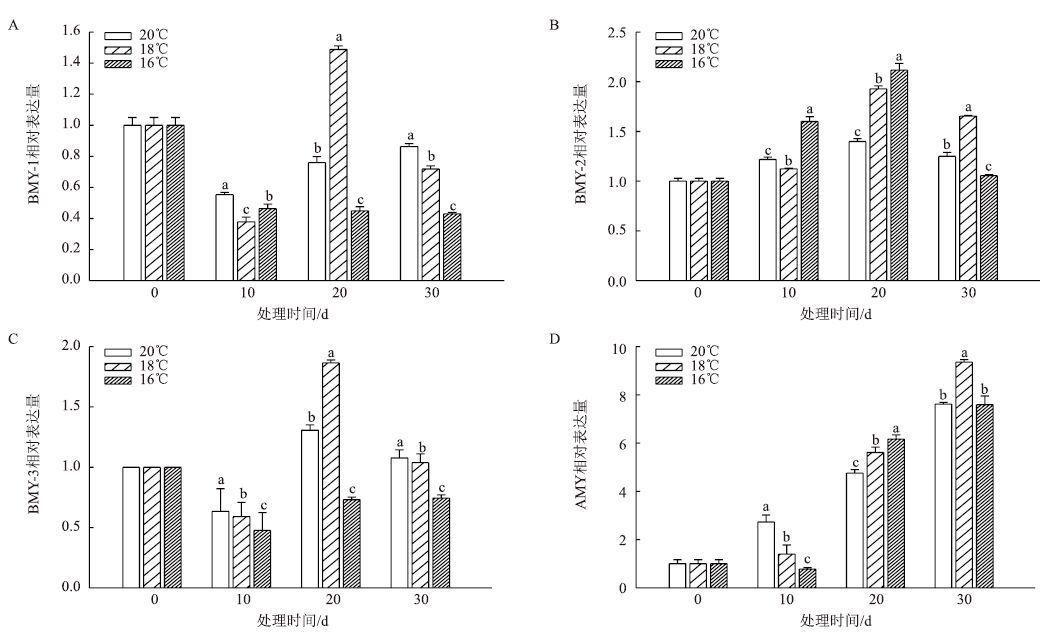
|
| 图 11 移栽-团棵期不同温度下叶片淀粉酶相关基因表达的变化 |
团棵-现蕾期叶片中淀粉酶相关基因表达情况(图 12)显示,BMY-1在3个温度下的表达量都急剧下调。BMY-2在均温25℃和21℃下的表达量先升高后降低,在10 d时达到最大;均温23℃下的表达量不断升高,20 d时达到最大。BMY-3的变化趋势与BMY-1相似,3个温度下基因表达都受到抑制。AMY在3个温度下的表达量也不断降低。
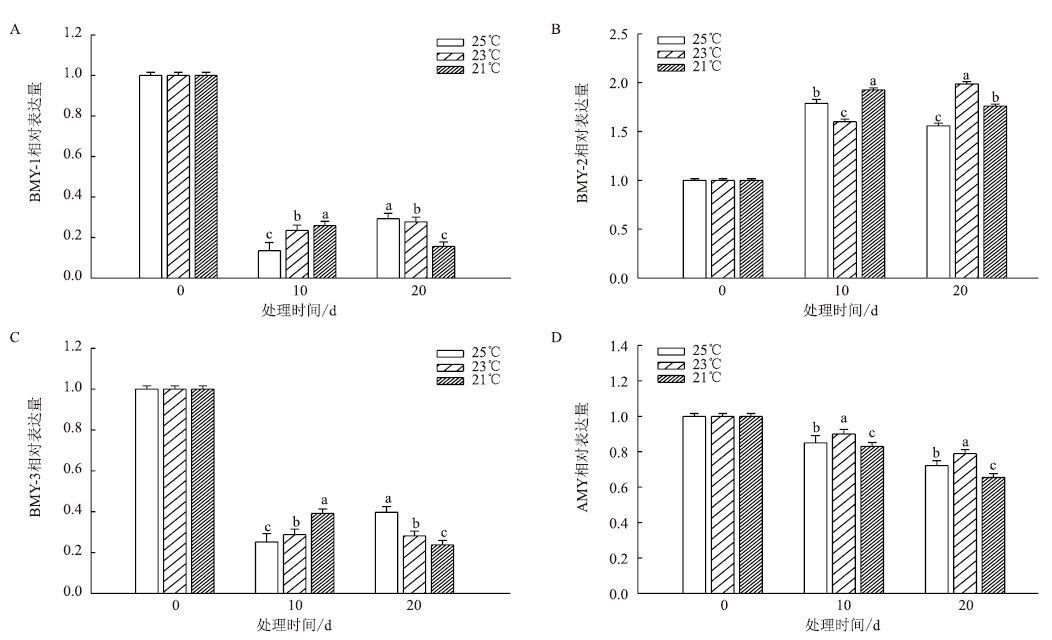
|
| 图 12 团棵-现蕾期温度对叶片淀粉酶相关基因表达的影响 |
成熟期叶片中淀粉酶相关基因表达结果(图 13)显示,BMY-1和BMY-3在3个温度下的表达量都表现为先降低后升高。BMY-2的表达量在3个温度下表现为先升高后降低,且均温25℃>23℃>21℃。AMY在整个处理期也表现为均温25℃>23℃>21℃,在均温25℃下表达量先升高后降低;在均温23℃和21℃下表达量先降低后升高。从3个温度来看,均温23℃下的表达量相对较高。
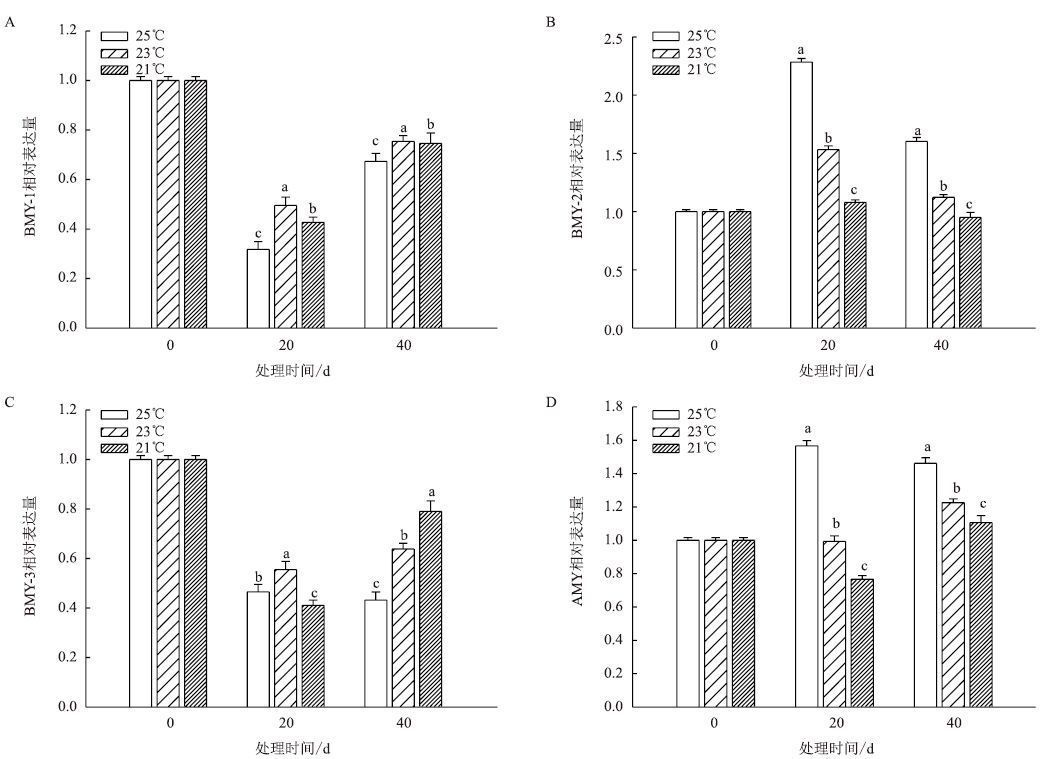
|
| 图 13 成熟期温度对叶片淀粉酶相关基因表达的影响 |
生态环境对烟叶品质具有较大影响,丰富的生态环境形成了各具风味的烟叶特色,植物淀粉的生物合成受到多因素的影响[16-18]。不同的温度条件对烟草淀粉代谢有显著影响。通过模拟河南襄县、贵州遵义和云南江川气温条件的研究发现,不同发育期在3个温度下烟草叶片和根系中的淀粉含量、相关酶活性及基因表达差异较大。
通过对不同时期不同温度下淀粉含量研究比较发现,淀粉含量与温度变化、不同发育期及不同器官有紧密联系。在移栽-团棵期,3个温度下淀粉变化趋势较一致,随着烟草的发育过程而逐渐增加,在整个处理过程中均温16℃下含量均较高;团棵-现蕾期淀粉含量趋于稳定,升高幅度较小甚至个别温度(均温25℃)出现下降趋势,在均温23℃下含量较高;成熟期叶片中的淀粉含量在均温21℃下高于另外两个温度。因此,在移栽-团棵和团棵-现蕾期,贵州遵义地区的淀粉含量丰富,成熟期云南江川地区淀粉含量丰富,而河南襄县地区在各个时期淀粉含量均较低。赵宸楠[19]对云南和河南烤烟比较研究发现,河南的淀粉含量在生长前期高于云南,后期低于云南;王晶[20]的研究结果表明,河南烟叶的淀粉积累量更为丰富。本研究中成熟期的变化规律与赵宸楠的结果相似,但前期变化不同,可能是处理因素及取样时间不一致所导致。
淀粉的生物合成是一个复杂的生化调控过程,该过程由多个同工酶协同催化完成[14]。本研究结果显示,各个时期淀粉的合成与降解在AGPase、SSs和Amylase的作用下维持动态平衡。在移栽-团棵、团棵-现蕾期,3个温度下AGPase、SSs活性均低于成熟期的活性,而Amylase活性在成熟期较低,表明淀粉在生长前期不断被分解来提供生长所需能量,到成熟期分解降低合成加快,最终使成熟期淀粉含量达到最高。这与张松涛等[21]的研究结果一致。
酶活性在不同温度下差异很大,相关酶对温度的响应必将影响到淀粉的积累,而即使在同一温度下,不同时期酶活性也不尽相同。Ridout等[22]的研究结果表明,烟草在较低温度条件下AGPase活性较高,淀粉积累增多,吕艳梅等[23]研究发现,较高温度影响AGPase活性,进而抑制淀粉的积累。本研究也表明,在移栽-团棵期、团棵-现蕾期和成熟期均是较低温度下AGPase活性较高。Keeling[24]等研究认为,温度升高SSs活性会显著降低,不利于淀粉的生物合成,本研究中,在团棵-现蕾和成熟期出现了相似的规律,即较低温度下SSs活性较高,较高温度下SSs活性较低。Amylase主要起分解淀粉的作用,蔡宪杰等[25]研究发现,Amylase活性随温度的升高而增加,在本研究中,团棵-现蕾和成熟期的Amylase活性也是在较高的温度下活性较高。
基因表达是物质代谢的基础,淀粉代谢相关酶基因通过编码淀粉代谢相关酶,从而控制淀粉的合成和分解,三者之间存在着密切的对应关系。基因表达的升高或降低,其编码合成的相关酶活性则会相应地升高或降低,控制合成的淀粉含量也会相应地增加或减少[26, 27]。在不同的生态环境或采取不同的栽培措施,淀粉积累及淀粉合成关键酶活性会发生变化,淀粉合成关键酶基因表达也会发生相应的变化[28]。荧光定量PCR检测结果表明,每个时期3个温度下AGPase、SSs和Amylase相关基因表达强度和表达趋势差异较大,基因表达情况可大致与酶活及淀粉含量对应,同一个酶对应的几个基因在同一时期并不是同时高表达或低表达,各个同工酶基因在特定时期协调表达来控制酶活的升降,以维持淀粉代谢的动态平衡。本实验通过模拟这3个地区的温度来研究淀粉代谢的变化,希望从其中一个侧面来解释3个地区烟草香型风格差异较大的原因,为探索烟叶风格之间淀粉代谢的差异提供理论依据。
4 结论通过模拟3个地区温度条件发现,贵州遵义地区的温度条件有利于移栽-团棵期淀粉的积累;云南江川地区的温度条件有利于团棵-现蕾和成熟期淀粉含量的积累,总体而言,云南江川前高后低的温度条件更有利于淀粉的积累。
| [1] | 李统帅. 烘烤过程中烟叶淀粉颗粒结构及理化性质的变化[D]. 郑州:河南农业大学, 2010. |
| [2] | 崔国民, 典瑞丽, 杨子娟, 等. 烟叶部位成熟度烘烤工艺对淀粉代谢的影响[J]. 中国农学通报, 2012, 28(13): 259–263. |
| [3] | 张丽, 文俊, 陈金湘, 等. 乙烯利对烘烤过程中烟叶淀粉代谢关键酶的影响[J]. 河南农业科学, 2012, 41(10): 66–69. |
| [4] | Weeks WW. Chemistry of tobacco constituents influences flavor and aroma[J]. Rec Adv Tob Sc, 1985, 11: 175–200. |
| [5] | 段丽斌, 崔国民, 赵昶灵, 等. 烤烟烘烤中烟叶淀粉降解的研究进展[J]. 中国农学通报, 2013, 29(18): 180–186. |
| [6] | 何其芳, 李荣华, 郭培国, 等. 烟叶中淀粉含量测定方法的比较[J]. 现代食品科技, 2012, 28(2): 229–232. |
| [7] | 韩锦峰. 烟草栽培生理[M]. 北京: 中国农业出版社, 2003. |
| [8] | 张松涛, 杨永霞, 滑夏华, 等. 不同生态区烟叶淀粉生物合成动态比较研究[J]. 农艺与调制, 2012, 18(4): 31–34. |
| [9] | 杨永霞, 石冰瑾, 王霄龙, 等. 不同海拔高度的烤烟淀粉合成动态研究[J]. 湖南农业大学学报, 2012, 38(1): 22–26. |
| [10] | 李自强, 刘新民, 董建新, 等. 罗平县海拔高度和土壤类型与烟叶化学成分的关系[J]. 中国烟草科学, 2010, 31: 44–48. |
| [11] | 何其芳, 李荣华, 郭培国, 等. 烟叶中淀粉含量测定方法的比较[J]. 现代食品科技, 2012, 28(2): 229–232. |
| [12] | 程方民, 蒋德安, 吴平, 等. 早籼稻籽粒灌浆过程中淀粉合成酶的变化及温度效应特征[J]. 作物学报, 2001, 27(2): 201–206. |
| [13] | 史宏志, 韩锦峰, 赵鹏. 不同氮量与氮源下烤烟淀粉酶和转化酶活性动态变化[J]. 中国烟草科学, 1999, 3: 5–8. |
| [14] | Tetlow IJ, Morell MK, Emes MJ. Recent developments in understanding the regulation of starch metabolism in higher plants[J]. J Exp Bot, 2004, 55(406): 2131–2145. |
| [15] | 陈国清, 陆大雷, 陆卫平. 玉米胚乳淀粉合成研究进展[J]. 中国农学通报, 2014, 30(33): 8–15. |
| [16] | 史宏志, 韩锦峰, 远彤, 等. 红光和蓝光对烟叶生长、碳氮代谢和品质的影响[J]. 作物学报, 1999, (2): 215–220. |
| [17] | 韩锦峰. 烟草栽培生理[M]. 北京: 中国农业出版社, 2003.151-156. |
| [18] | 黄国文, 陈良碧. 干旱对上部烟叶细胞结构和化学成分的影响[J]. 生命科学研究, 2004, (2): 183–187. |
| [19] | 赵宸楠. 河南和云南烤烟碳氮代谢比较研究[D]. 郑州:河南农业大学, 2011:30-34. |
| [20] | 王晶. 不同生态区烟叶碳水化合物合成及积累规律的比较研究[D]. 郑州:河南农业大学, 2013:33-34. |
| [21] | 张松涛, 杨永霞, 滑夏华, 等. 不同生态区烟叶淀粉生物合成动态比较研究[J]. 中国烟草学报, 2012, 8(18): 31–39. |
| [22] | Ridout JW, Raper CD, Jr GS, et al. Changes in ratio of soluble sugars and free amino nitrogen in the apical meristem during floral transition of tobacco[J]. Int Plant Sci, 1992, 153: 78–88. |
| [23] | 吕艳梅, 谭伟平, 肖层林, 等. 高温对优质水稻籽粒淀粉形成及淀粉合成相关酶活性的影响[J]. 华北农学报, 2014, 29(1): 135–139. |
| [24] | Keeling PL, Bacon PJ, Holt DC. Elevation temperature reduce starch deposition in wheat endosperm by reducing the activity of soluble starch synthase[J]. Planta, 1993, 191: 341–348. |
| [25] | 蔡宪杰, 尹启生, 王信民, 等. 烘烤过程中温湿度对烤烟淀粉酶活性的影响[J]. 烟草科技, 2006, 12: 43–45. |
| [26] | Shannon JC, Pien FM, Cao HP, et al. Brittle-1, an adenylate translocator, facilitates transfer of extraplastidial synthsized ADP-glucose into amylopasta of maizes endosperms[J]. Plant Physiology, 1998, 117: 1235–1252. |
| [27] | Hurkman WJ, McCue KF, Altenbach SB, et al. Effect of temperature on expression of genes encoding enzymes for starch biosynthesis in developing wheat endosperm[J]. Plant Science, 2003, 164: 873–881. |
| [28] | 姜慧娟, 赵铭钦, 刘鹏飞, 等. 烤烟香型划分及质量特征研究进展[J]. 浙江农业科学, 2012, (12): 1628–1632. |