水杨酸(Salicylic acid,SA),又名邻羟基苯甲酸,是植物体内普遍存在的一种小分子酚类物质,最早是从柳树叶和树皮中分离得到的[1]。SA参与调节植物体内的多种生理生化过程,响应植物体遭遇的各种非生物和生物压力,如干燥、寒冷、重金属、热和渗透压胁迫以及作为内源信号调节植物对病原菌的防御反应,在植物体整个生活周期中起到极其重要的“监管”作用[2-4]。植物体内有两条SA合成途径:苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)介导的肉桂酸途径和异分支酸合成酶(Isochorismate synthase,ICS)介导的异分支酸途径[5, 6]。其中PAL催化苯丙氨酸脱氨生成肉桂酸和氨,是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的关键酶和限速酶[7]。PAL主要通过调节植物体内SA的含量来调节植物体的生长发育和增强植物体面对各种生物和非生物胁迫下的抗逆性[8]。该酶在陆地植物中广泛存在,但在低等藻类植物中未见报道,但推测藻类植物中存在PAL类似酶。如Moffitt等[9]从蓝藻中筛选到的PAL比真核生物同源物要小20%,结构解析表明这两种蓝藻的PAL在高级结构上与植物和酵母PAL相似,且与芳香族氨基酸解氨酶家族的组氨酸转氨酶(Histidine ammonia-lyase,HAL)相似。
β-1,3-葡聚糖酶(β-1,3-glucanase,β-1,3-GA)属于糖基水解酶家族,广泛分布于植物、真菌和细菌中。在植物中,该酶与植物细胞分裂、花粉管生长、种子萌发等多种生长发育过程有关[10]。如在温度变化及脱落酸等胁迫下β-1,3-GA过量表达的转基因拟南芥的种子发芽性能较好[11]。β-1,3-GA是病原相关蛋白2(Pathogenesis-related protein,PR-2)的家族成员,在植物抗病过程中该酶及其基因表达显著增加[12, 13]。除了细菌和真菌等病原物的诱导之外,β-1,3-GA的转录表达还受NaCl、受伤、寒冷、H2O2等非生物胁迫和SA、脱落酸、茉莉酸甲酯等植物激素的诱导[14]。
龙须菜(Gracilariopsis lemaneiformis)是红藻门的一种大型经济海藻,常被用作琼胶提取和鲍鱼养殖或者加工成海洋风味食品,同时龙须菜还具有较强的 N、P 吸收能力,是富营养化海区重要的修复材料。在我国从南到北沿海各省,尤其是福建、浙江和广东等都有龙须菜养殖。但夏季天气炎热,南方养殖龙须菜容易病烂,不适合养殖。本研究拟探讨水杨酸代谢途径关键酶PAL和诱导酶β-1,3-GA在病烂、高盐、高温逆境胁迫下及外源添加SA后的活性变化,从而揭示这两种酶与SA的抗生物和非生物胁迫作用之间的关系,为龙须菜的抗逆抗病养殖提供参考。
1 材料与方法 1.1 材料实验材料为龙须菜981品种,采自浙江温州。选择生长状态良好的藻体,置于实验室23℃光照培养箱中培养,添加Provasoli培养基[15],光强2 000 lux,光周期L∶D(12 h∶12 h)。
1.2 方法 1.2.1 病烂实验海区采集的龙须菜,在实验室培养一段时间后部分龙须菜出现溃烂现象,挑选刚开始溃烂的龙须菜作为病烂组,以同一区域健康龙须菜为对照组,分别测定PAL和β-1,3-GA的活性。选取4对病烂组和其相应的对照组,每组3个平行。
1.2.2 高盐实验将龙须菜分别培养在35‰盐度人工海水中,以25‰盐度海水为对照,分别测定在24 h、48 h的PAL和β-1,3-GA的活性。
1.2.3 高温实验将龙须菜置于33℃光照培养箱中培养,以23℃培养藻做对照组,分别测定两组藻在24 h、48 h的PAL和β-1,3-GA的活性。
1.2.4 水杨酸添加实验在33℃光照培养箱中培养的龙须菜中,分别添加水杨酸至终浓度分别为0、100、200、300和400 μmol/L,每组3个平行,分别测定24 h、48 h的PAL和β-1,3-GA的活性。
1.2.5 苯丙氨酸解氨酶活性测定使用PAL试剂盒(GY5,苏州科铭生物公司)。PAL催化L-苯丙氨酸解氨酶裂解为反式肉桂酸和氨,反式肉桂酸在290 nm处有最大吸收值,通过测定吸光值升高速率计算PAL活性。按样本鲜重计算:PAL(U/g鲜重)=DA×V反总÷(V样÷V样总×W)÷0.05÷T=26.6×DA÷W(DA:实验组吸光度-对照组吸光度;V反总:反应体系总体积,200 μL;V样:加入样本体积,5 μL;V样总:加入提取液体积,1 mL;T:反应时间,30 min;W:样品鲜重)。每克藻体在每毫升反应体系中每分钟使290 nm下吸光值变化0.05定义为一个酶活性单位。
1.2.6 β-1,3-葡聚糖酶活性测定采用β-1,3-葡聚糖酶活性测定试剂盒(SY12,苏州科铭生物公司)。β-1,3-葡聚糖酶水解昆布多糖,内切β-1,3-葡萄糖苷键,产生还原末端,通过测定还原糖生成的速率计算酶活性。按样本鲜重计算:β-1,3-GA(U/g鲜重)=[(DA+0.0192)÷0.0497×V1]÷(W×V1÷V2)=20.876×(DA+0.0192)÷W(V1:加入反应体系中的样本体积,0.035 mL;V2:加入提取液体积,1 mL;W:样本鲜重,g)。每克藻体每小时产生1 mg还原糖定义为一个酶活性单位。
1.2.7 数据处理与分析利用GraphPad Prism 5.0进行作图与数据处理,使用SPSS13.0独立样本t检验和单因素方差分析中的Duncan进行显著性分析,P<0.05表示差异显著。
2 结果 2.1 病烂对PAL和β-1,3-GA活性的影响病烂龙须菜中PAL、β-1,3-GA的活性多高于健康对照藻(图 1)。如图 1-A所示,在4组健康和病烂龙须菜中,2、3、4组中病烂藻的PAL活性分别为29.41、83.67和22.79 U/g鲜重,是相应健康对照藻的1.42、1.29和1.27倍,且与各自对照差异显著(P<0.05)。图 1-B所示,在1、2、3组中病烂藻的β-1,3-GA的活性分别为28.63、32.85和36.88 U/g鲜重,是相应健康对照藻的1.26、1.29和1.35倍(P<0.05)。总体来看,与健康龙须菜相比,病烂藻中PAL和β-1,3-GA活性显著增加。
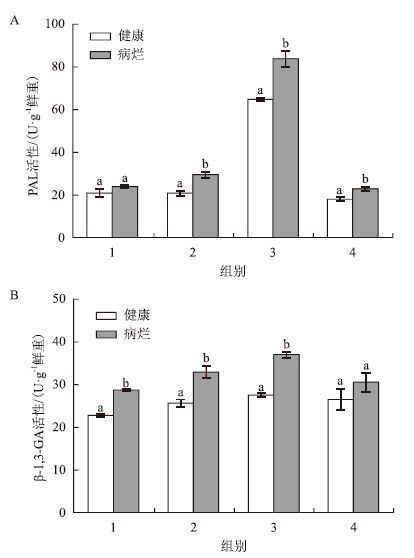
|
| 图 1 病烂对PAL和β-1,3-GA活性的影响 小写字母表示差异显著(P<0.05),下同 |
以25‰盐度为对照,不同盐度对PAL、β-1,3-GA活性的影响(图 2)显示,两种酶的活性都有所提高且在48 h均略高于24 h。如图 2-A所示,高盐组PAL活性在24 h和48 h分别是相应对照组的1.21倍和1.23倍,但无显著差异。如图 2-B所示,24 h高盐组β-1,3-GA活性(21.69 U/g鲜重)是对照组的1.90倍(P<0.05),48 h高盐组β-1,3-GA活性(68.45 U/g鲜重)是对照组的1.42倍(P<0.05)。总体来看,高盐处理对β-1,3-GA的活性影响较显著。
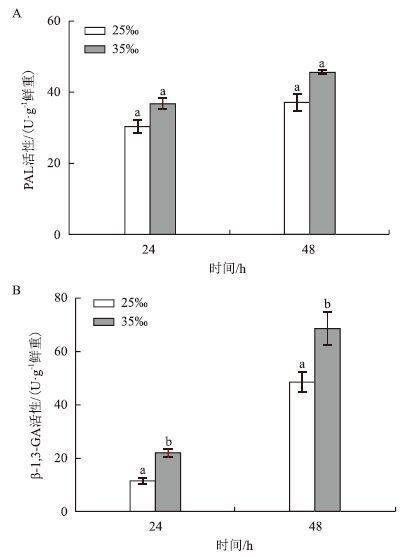
|
| 图 2 盐度对PAL和β-1,3-GA活性的影响 |
以23℃为对照,不同温度对两种酶活性的影响结果(图 3)显示,33℃培养下龙须菜中PAL和β-1,3-GA的活性均有所提高。在24 h,高温组PAL活性达到33.48 U/g鲜重,是对照组的1.25倍(P<0.05);但在48 h,PAL活性仅为对照组的1.11倍,无显著差异。高温组β-1,3-GA在24 h的活性(33.48 U/g鲜重)是对照组的1.27倍(P<0.05),48 h的活性是对照组的1.15倍,但无显著差异。总体来看,高温组PAL和β-1,3-GA活性在24 h增加显著。
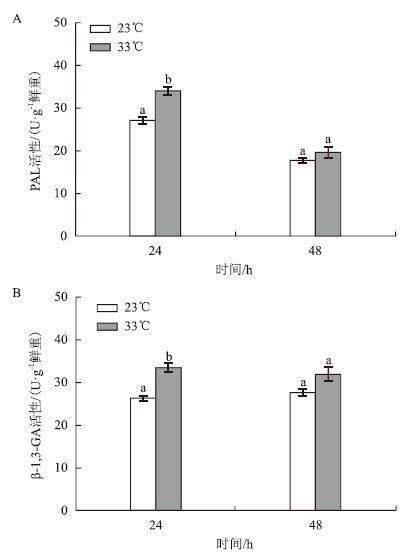
|
| 图 3 温度对PAL和β-1,3-GA活性的影响 |
以不添加水杨酸为对照组,100 μmol/L SA添加后PAL和β-1,3-GA都表现出最大活性,随着SA浓度的继续增高,两种酶活性出现下降趋势(图 4)。
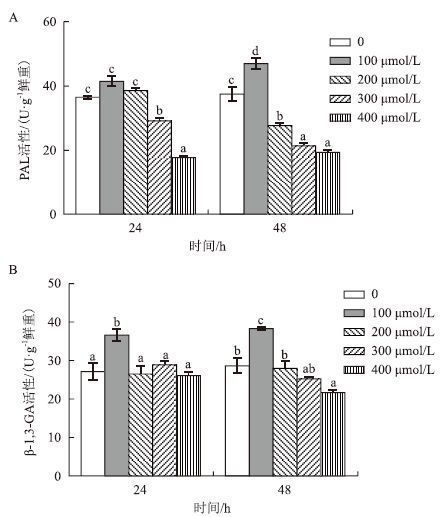
|
| 图 4 水杨酸浓度对PAL和β-1,3-GA活性的影响 |
PAL在24 h和48 h的酶活性测定结果(图 4-A)显示,在24 h 100 μmol/L SA处理后PAL活性达到最大值(41.41 U/g鲜重),是对照组的1.13倍(P>0.05),而300和400 μmol/L SA添加后PAL活性分别是对照组的0.86倍和0.49倍(P<0.05),可见高于300 μmol/L SA显著抑制了PAL的活性。在48 h,除了100 μmol/L SA促进了PAL活性升高(是对照组的1.26倍)之外,其余3种浓度SA添加后PAL活性分别为对照组的0.74倍、0.57倍和0.46倍,均与对照组差异显著(P<0.05)。
β-1,3-GA在24 h和48 h的酶活性测定结果(图 4-B)显示,在24 h 100 μmol/L SA处理后β-1,3-GA活性达到最大值(36.64 U/g鲜重),是对照组的1.35倍(P<0.05),但200-400 μmol/L SA与对照组无显著差异。在48 h,100 μmol/L SA促进了PAL活性升高,是对照组的1.34倍(P<0.05),而400 μmol/L SA添加后β-1,3-GA活性是对照组的0.76倍,与对照组差异显著(P<0.05),可见400 μmol/L SA显著抑制了β-1,3-GA在48 h的活性。
上述结果表明,100 μmol/L SA促进了PAL和β-1,3-GA活性的增加,而高浓度SA则抑制了两种酶的活性,且多具有一定的剂量效应。
3 讨论 3.1 PAL和β-1,3-GA参与的植物抗病性PAL是SA代谢关键酶,β-1,3-GA是受水杨酸诱导的一种糖基水解酶,两者在植物抗病过程中发挥了重要的作用。高峰等[16]研究表明喷施水杨酸后PAL、β-1,3-GA、过氧化物酶(POD)和多酚氧化酶(PPO)活性上升,可能是水杨酸诱导棉花耐黄萎病的抗病性提高的一个重要原因。在马铃薯抗性品种中PAL和β-1,3-GA活性要高于敏感品种[17]。本研究中PAL和β-1,3-GA各做了4个病烂与健康对照组,PAL和β-1,3-GA中分别有3组的病烂龙须菜活性显著高于健康龙须菜。推测可能是在龙须菜遭遇病烂胁迫时,两种酶的活性迅速增加,参与龙须菜的抗病防卫。
3.2 PAL和β-1,3-GA参与的植物抗逆性植物在生长过程中会遭遇各种各样的非生物胁迫,如温度胁迫、盐度胁迫、营养胁迫、干旱胁迫、重金属胁迫等。PAL和β-1,3-GA参与了SA介导的信号通路以抵抗外界各种胁迫,维持植物的正常生长。在低温胁迫下的黄瓜幼苗中,与ICS相比,PAL活性和转录表达均增加,说明PAL途径在冷刺激诱导的SA合成过程中占据主要地位[18]。添加10 μmol/L MJ和 2 mmol/L SA后冷藏柠檬水果抗寒性增加,与激素添加后增强了总酚含量和PAL活性并抑制了POD活性有关[19]。在高盐胁迫下,外源SA的添加使长春花中PAL活性显著增加,并改变了抗氧化物和酚类代谢,产生抗盐性[20]。在低营养胁迫下,牵牛花子叶中PAL活性和转录表达上调,SA含量升高,诱导牵牛花正常开花[21]。Hwang等[22]从水稻中克隆了27条β-1,3-glucanases基因,有些受H2O2、衰老、NaCl、冷及受伤等环境胁迫的诱导。
本实验主要设置了高盐和高温两种胁迫条件。高盐胁迫下,PAL活性在24 h和48 h均与对照组无显著差异,而β-1,3-GA活性均显著高于对照组。33℃高温培养下,高温组PAL和β-1,3-GA活性均在24 h高于对照组,而48 h均与对照组无显著差异。由此可见,β-1,3-GA在受NaCl胁迫中活性变化比PAL明显,这与该酶受NaCl诱导的报道一致[14, 22],而两种酶在耐受高温胁迫中短期作用更明显一些。
3.3 SA对PAL和β-1,3-GA活性的影响外源SA作为一种激发子或外源信号分子,可以诱导PAL和β-1,3-GA的基因表达,增加PAL和β-1,3-GA的活性。如水杨酸、草酸、CaCl2等诱导子可以显著增强梨中的β-1,3-GA、PAL、过氧化物酶和多酚氧化酶等防御相关酶的活性[23]。受SA诱导,黄花蒿(Artemisia annua)中PAL转录表达上调[24]。外源水杨酸钠的添加可诱导康萍和浮萍的愈伤组织胞内和胞外β-1,3-GA活性增强[25]。
在本研究中,100 μmol/L SA添加后PAL和β-1,3-GA活性显著增加,表明100 μmol/L SA诱导了PAL和β-1,3-GA的合成,导致两种酶活性增加。这与SA可作为诱导子增强PAL和β-1,3-GA活性的报道一致[26-28]。随着SA浓度的升高,两种酶的活性出现下降趋势,如400 μmol/L SA处理后PAL和β-1,3-GA活性显著降低,这可能与SA诱导信号通路中的反馈调节机制有关。同时,也与本课题组前期研究中100 μmol/L SA可以缓解高温对龙须菜生长的不利影响而高浓度SA则会抑制其生长的结果相符(资料尚未发表)。
4 结论本研究分析了低等藻类植物龙须菜中两种酶的活性变化,结果表明PAL和β-1,3-GA在病烂、高盐和高温逆境下活性增加,推测两种酶在龙须菜的抗病抗逆过程中发挥了重要作用。此外,外源SA可以诱导龙须菜中PAL和β-1,3-GA活性增加,100 μmol/L SA可产生最佳诱导效果,而浓度过高则使两种酶活性受抑制。
| [1] | Raskin I. Role of salicylic acid in plant[J]. Annu Rev Plants Physiol Plant Mol Biol, 1992, 43(1): 439–463. |
| [2] | Rivas-San Vicente M, Plasencia J. Salicylic acid beyond defence:its role in plant growth and development[J]. Journal of Experimental Botany, 2011, 62(10): 3321–3338. |
| [3] | Hayat Q, Hayat S, Irfan M, et al. Effect of exogenous salicylic acid under changing environment:a review[J]. Environmental and Experimental Botany, 2010, 68(1): 14–25. |
| [4] | Kumar D. Salicylic acid signaling in disease resistance[J]. Plant Science, 2014, 228: 127–134. |
| [5] | Chen Z, Zheng Z, Huang J, et al. Biosynthesis of salicylic acid in plants[J]. Plant Signaling & Behavior, 2009, 4(6): 493–496. |
| [6] | Métraux JP. Recent breakthroughs in the study of salicylic acid biosynthesis[J]. Trends in Plant Science, 2002, 7(8): 332–334. |
| [7] | Zhang X, Liu CJ. Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J]. Molecular Plant, 2015, 8(1): 17–27. |
| [8] | Dehghan S, Sadeghi M, Poppel A, et al. Differential inductions of phenylalanine ammonia-lyase and chalcone synthase during wounding, salicylic acid treatment, and salinity stress in safflower, Carthamus tinctorius[J]. Bioscience Reports, 2014, 34(3): 273–282. |
| [9] | Moffitt MC, Louie GV, Bowman ME, et al. Discovery of two cyanobacterial phenylalanine ammonia lyases:kinetic and structural characterization[J]. Biochemistry, 2007, 46(4): 1004–1012. |
| [10] | Zamora-Carreras H, Torres M, Bustamante N, et al. The C-terminal domains of two homologous Oleaceae β-1, 3-glucanases recognise carbohydrates differently:Laminarin binding by NMR[J]. Archives of Biochemistry and Biophysics, 2015, 580: 93–101. |
| [11] | Dogra V, Sreenivasulu Y. Cloning and functional characterization of β-1, 3-glucanase gene from Podophyllum hexandrum-A high altitude Himalayan plant[J]. Gene, 2015, 554(1): 25–31. |
| [12] | Van Loon LC, Rep M, Pieterse CMJ. Significance of inducible defense-related proteins in infected plants[J]. Annu Rev Phytopathol, 2006, 44: 135–162. |
| [13] | Kim J S, Lee J, Lee C, et al. Activation of pathogenesis-related genes by the Rhizobacterium, Bacillus sp. JS, Which Induces Systemic Resistance in Tobacco Plants[J]. The Plant Pathology Journal, 2015, 31(2): 195–201. |
| [14] | Xie YR, Raruang Y, Chen ZY, et al. ZmGns, a maize class I β-1, 3-glucanase, is induced by biotic stresses and possesses strong antimicrobial activity[J]. Journal of Integrative Plant Biology, 2015, 57(3): 271–283. |
| [15] | Provasoli L. Media and prospects for the cultivation of marine algae[M]//Watarnable A, Hattori R. Culture and collection of algae. Proceedings of the US-Japan Conference, Hakone:Japan Soc Plant Physiol, 1968:63-75. |
| [16] | 高峰, 李国英, 王钦英. 水杨酸诱导棉花耐黄萎病的效应[J]. 新疆农业科学, 2004, 41(5): 333–336. |
| [17] | Bariya HS, Thakkar VR, Thakkar AN, et al. Induction of systemic resistance in different varieties of Solanum tuberosum by pure and crude elicitor treatment[J]. Index Medicus for South-East Asia Region, 2011, 49(2): 151–162. |
| [18] | Dong CJ, Li L, Shang QM, et al. Endogenous salicylic acid accumulation is required for chilling tolerance in cucumber(Cucumis sativus L.) seedlings[J]. Planta, 2014, 240(4): 687–700. |
| [19] | Siboza XI, Bertling I, Odindo AO. Salicylic acid and methyl jasmonate improve chilling tolerance in cold-stored lemon fruit(Citrus limon)[J]. Journal of Plant Physiology, 2014, 171(18): 1722–1731. |
| [20] | Misra N, Misra R, Mariam A, et al. Salicylic acid alters antioxidant and phenolics metabolism in catharanthus roseus grown under salinity stress[J]. African Journal of Traditional, Complementary and Alternative Medicines, 2014, 11(5): 118–125. |
| [21] | Wada KC, Mizuuchi K, Koshio A, et al. Stress enhances the gene expression and enzyme activity of phenylalanine ammonia-lyase and the endogenous content of salicylic acid to induce flowering in pharbitis[J]. Journal of Plant Physiology, 2014, 171(11): 895–902. |
| [22] | Hwang H, Kim ST, Kim SG, et al. Comprehensive analysis of the expression of twenty-seven beta-1, 3-glucanase genes in rice(Oryza sativa L.)[J]. Molecules and Cells, 2007, 23(2): 207–214. |
| [23] | Tian S, Wan Y, Qin G, et al. Induction of defense responses against Alternaria rot by different elicitors in harvested pear fruit[J]. Applied Microbiology and Biotechnology, 2006, 70(6): 729–734. |
| [24] | Zhang Y, Fu X, Hao X, et al. Molecular cloning and promoter analysis of the specific salicylic acid biosynthetic pathway gene phenylalanine ammonia-lyase(AaPAL1)from Artemisia annua[J]. Biotechnology and Applied Biochemistry, 2015 . |
| [25] | Gunter EA, Kapustina OM, Popeyko OV, et al. Induction of β-1, 3-glucanase in callus cultures in vitro[J]. Biochemistry(Moscow), 2008, 73(7): 826–832. |
| [26] | 焦蒙丽, 曹蓉蓉, 陈红艳, 等. 水杨酸对丹参培养细胞中迷迭香酸生物合成及其相关酶的影响[J]. 生物工程学报, 2012, 28(3): 320–328. |
| [27] | Hao W, Guo H, Zhang J, et al. Hydrogen peroxide is involved in salicylic acid-elicited rosmarinic acid production in Salvia miltiorrhiza cell cultures[J]. The Scientific World Journal, 2014. |
| [28] | 李颖章, 郑晓华, 唐海林, 等. 水杨酸和黄萎病菌毒素处理棉花愈伤组织使β-1, 3-葡聚糖酶和几丁质酶的活性增加[J]. 植物学报, 2003, 45(7): 802–808. |




