采用微生物细胞工厂生产各种化学品的过程中,有机化学品产物或有害的环境(高温和低温、极端pH、渗透压、营养饥饿、有害的底物、有毒的污染物、高浓度的代谢产物或者副产物等)往往会对微生物细胞或胞内酶产生严重的毒害效应,从而导致细胞死亡或酶催化剂失活,进而严重影响生物催化转化过程的生产效能。因此,提高微生物的环境耐受性是构建高效生产菌株的重要策略之一。
热激蛋白(Heat shock proteins,HSP)也被称作分子伴侣,是细胞在外界物理化学刺激下产生的一类蛋白质,在胞内蛋白质的合成、转运、折叠和降解过程中发挥着重要作用[1, 2]。近年来,研究者利用基因工程技术将各种热激蛋白的编码基因进行异源表达,结果发现,宿主菌对不同胁迫条件的耐受性均得到明显的提高[3-6]。
简单节杆菌(Arthrobacter simplex)是工业上普遍使用的甾体C1,2脱氢反应菌株,转化体系中常通过添加乙醇促进疏水性底物的溶解。本课题组在前期工作中,以简单节杆菌TCCC 11037生物转化醋酸可的松生成醋酸泼尼松的C1,2脱氢反应为研究模型,考察了有机溶剂—乙醇对菌体生长、细胞形态和细胞生理性质的影响,结果表明,乙醇的加入对菌体的生长、细胞形态和生理活性都产生了显著的影响[7, 8]。通过LC-MS/MS和生物信息学分析,进一步鉴定得到了一些与乙醇胁迫相关的差异显著蛋白,如热激蛋白GroEL[9]。在此基础上,本研究以Arthrobacter simplex TCCC 11037基因组为模板,采用PCR的方法克隆groEL基因,通过表达载体pET-22b(+)将其在大肠杆菌BL21(DE3)中进行异源表达。并对重组菌的生长和抗逆性能进行初步的分析,旨为深入研究该菌株中热激蛋白GroEL的生物学功能提供基础数据。
1 材料与方法 1.1 材料 1.1.1 菌种和载体简单节杆菌(Arthrobacter sim-plex)TCCC 11037,天津科技大学微生物制药研究室保存。宿主菌E.coli DH5α感受态细胞、E.coli BL21(DE3)感受态细胞,Transgen公司,载体pMD19-T(simple)和pET-22b(+)分别购自TaKaRa公司和Novagen公司。
1.1.2 酶和试剂HiFi DNA Polymerase购自Trans-gen公司,限制性内切酶Hind Ⅲ/EcoR I和T4 DNA 连接酶来自TaKaRa公司,细菌基因组提取试剂盒质粒购自Tiangen公司,抽提试剂盒和胶回收试剂盒购自OMEGA公司。
1.2 方法 1.2.1 简单节杆菌中groEL基因的克隆参照天根的细菌基因组提取试剂盒提取方法提取Arthrobacter simplex TCCC 11037的基因组,根据16S RNA比对结果选取与Arthrobacter simplex TCCC 11037亲缘关系最近的Nocardioides sp. J54在GenBank登录的groEL序列(WP_028656707.1)设计用于简单节杆菌groEL基因扩增的引物。上游引物5'-CCGGAATTCATGTCGAAGCTGATTGCTTTC-3',下游引物5'-CCCAAGCTTTCAGCGCAGGTCCCAGCG-3'(下划线部分分别为EcoRⅠ和Hind Ⅲ的酶切位点)。以简单节杆菌总DNA为模板,使用HiFi DNA Polymerase酶进行PCR扩增条件:94℃预变性5 min;94℃变性30 s,65℃退火30 s,72℃延伸1 min,30个循环。PCR产物经1%琼脂糖凝胶电泳后,用琼脂糖凝胶DNA回收试剂盒回收,回收产物与pMD19-T(simple)载体连接后转化DH5α感受态,分别经菌液PCR及EcoRⅠ/HindⅢ双酶切验证,将阳性克隆送至深圳华大基因公司测序。
1.2.2 序列同源性分析和系统发育树构建用NCBI的ORF finder程序寻找DNA片段中的开放读码框并确定其编码的氨基酸序列,利用NCBI数据库中的Blast软件将目的基因编码的氨基酸序列与GenBank中的氨基酸序列进行比对和相似性搜索,获得相似性在60%以上的7株菌株的序列,利用MEGA5软件,运用Neighbor-Joining,采用Poisson校正模型,自举1 000次构建系统发育树。
1.2.3 GroEL重组大肠杆菌的构建PCR产物与pMD19-T(simple)载体连接,经EcoRⅠ/Hind Ⅲ双酶切获得黏性末端基因片段,与经过相同处理pET-22b(+)连接,构建重组表达质粒pET-22b(+)-groEL,经菌液PCR及EcoRⅠ/Hind Ⅲ双酶切,将验证正确的重组质粒采用化学法转入BL21(DE3)感受态细胞。挑取单克隆,通过重提质粒、PCR和EcoRⅠ/Hind Ⅲ双酶切,筛选出GroEL重组大肠杆菌。
1.2.4 GroEL蛋白的诱导表达分别将重组菌E.coli BL21(DE3)/pET-22b(+)-groEL和含有空质粒的对照菌株E.coli BL21(DE3)/pET-22b(+)接种于含有100 μg/mL氨苄青霉素的LB液体培养基中,37℃ 180 r/min过夜培养。以1%接种量接入50 mL含有100 μg/mL氨苄青霉素的LB液体培养基中,37℃ 180 r/min培养至OD600约为0.6,此时,加入终浓度为1 mmol/L的IPTG,37℃诱导表达6 h,6 000 r/min离心10 min收集适量菌体,加入蛋白上样缓冲液,沸水浴5 min,10 000 r/min离心5 min后取上清液,进行SDS-PAGE电泳分析。
1.2.5 简单节杆菌GRoELXL表达对大肠杆菌无压力条件下生长特性的影响分别将重组菌株E.coli BL21/pET-22b(+)-groEL和对照菌株E.coli BL21/pET-22b(+)接种一环到装有50 mL LB液体培养基(含有100 μg/mL氨苄青霉素)的250 mL三角瓶中,37℃ 180 r/min振荡培养12 h。以1%的接种量将上述培养液转接到新鲜的装有50 mL LB液体培养基(含有100 μg/mL氨苄青霉素和1 mmol/L IPTG)的250 mL三角瓶中,用LB液体培养基将两个菌株的初始OD600值均调为0.02,37℃ 180 r/min振荡培养,每隔一定时间取样测定OD600值,绘制生长曲线。
1.2.6 简单节杆菌ROELse表达对大肠杆菌抗逆性能的影响 1.2.6.1 热激蛋白GROELse表达对大肠杆菌高浓度压力冲击条件下存活情况的影响按照1.2.4的方法进行GroEL蛋白的诱导表达,将收集得到的菌体用新鲜的LB液体培养基(含有100 μg/mL氨苄青霉素)悬浮并将菌液的OD600值均调节至0.8。取培养液1 mL,6 000 r/min离心10 min收集菌体,将其悬浮在5 mL含有不同压力(包括10%乙醇、50℃、15%甲醇、3 mol/L山梨醇和pH=3.0)的LB液体培养基(含有100 μg/mL氨苄青霉素)中,37℃,180 r/min振荡30 min。将上述培养液采用10倍逐级稀释法在LB平板(含有100 μg/mL氨苄青霉素)上进行涂布,37℃培养一定时间后观察平板上的菌落数。实验中以不加压力的条件作为对照组,按照下述公式计算存活率。同时将对照菌株接种到含氨苄青霉素(100 μg/mL)的LB培养液中,按照相同的方法进行培养和测定存活率。
活率(%)=菌株压力条件下的菌落数/菌株无压力条件下的菌落数×100%
1.2.6.2 热激蛋白GROELse表达对大肠杆菌适当压力条件下生长特性的影响分别将重组菌株E.coli BL21/pET-22b(+)-groEL和对照菌株E.coli BL21/pET-22b(+)接种一环到装有50 mL LB液体培养基(含有100 μg/mL氨苄青霉素)的250 mL三角瓶中,37℃ 180 r/min振荡培养12 h。以1%的接种量将上述培养液转接到新鲜的装有50 mL LB液体培养基(含有100 μg/mL氨苄青霉素和1 mmol/L IPTG)的250 mL三角瓶中,用LB液体培养基将两个菌株的初始OD600值均调为0.02。然后在不同压力条件下(包括4%乙醇、42℃、5%甲醇、1 mol/L山梨醇和pH 5.0)180 r/min继续振荡培养(除42℃外,其他压力条件下的培养温度均为37℃),每隔一定时间取样测定OD600值。实验中以不加压力的条件作为对照组,按照下述公式计算相对OD600。
相对OD600=菌株压力条件下的OD600值/菌株无压力条件下的OD600值
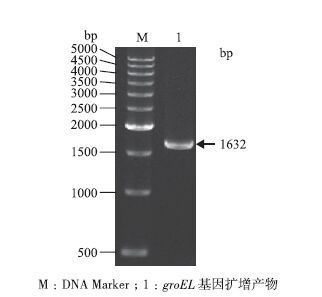
2 结果 2.1 简单节杆菌中groEL基因的克隆以Arthrobacter simplex TCCC 11037基因组为模板,利用PCR技术扩增目标基因,扩增产物经1%(W/V)琼脂糖凝胶电泳分析,约在1 600 bp处有特异性的单一条带(图 1),与预期大小相符。
|
| 图 1 简单节杆菌groEL基因的PCR扩增产物 Marker;1: groEL基因扩增产物 |
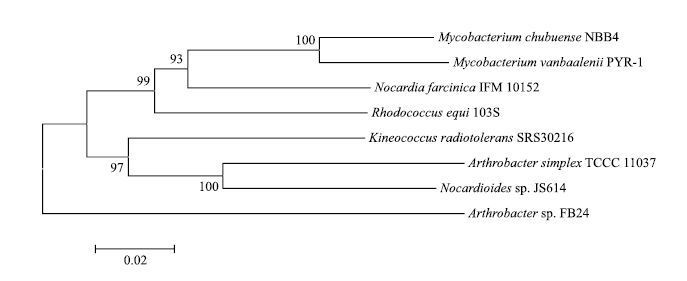
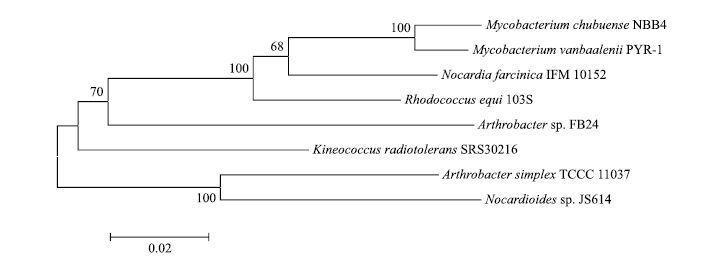
由测序结果可知,已成功克隆得到A. simplex TCCC 11037中groEL基因,其全长为1 632 bp,编码544个氨基酸。将此groEL基因进行同源比对,结果(图 2,图 3)表明,A. simplex TCCC 11037中GroEL的核苷酸和氨基酸序列与Nocardioides sp. JS614的同源性最高,分别达到89%和95%。不同微生物来源的groEL基因的亲缘关系非常接近,氨基酸序列与核苷酸序列的系统进化树基本是一致的。进化分析表明A. simple TCCC 11037的groEL基因与Nocardioides聚为一枝,与诺卡氏菌属的进化关系最近。该基因的序列信息已经在GenBank上注册,登录号为KJ854907。
|
| 图 2 groEL核苷酸序列的系统发育树 遗传距离用Tamura-Nei公式计算,系统发育树树用Neighb Joint(NJ)法构建,枝长代表了分歧程度,各枝上的数字是1 000次bootstrap重抽样分析的支持百分比,下同 |
|
| 图 3 GroEL氨基酸序列的系统发育树 |
表达载体pET-22b(+)-groEL经PCR和双酶切鉴定,结果(图 4)表明获得了与预期大小相同的目的片段,说明表达载体pET-22b(+)-groEL已经构建成功。

|
| 图 4 表达载体pET-22b(+)-groEL的PCR和双酶切鉴定结果 M:DNA Marker;1:表达载体的PCR扩增产物;2:pET-22b(+)质粒;3:pET-22b(+)-groEL质粒经 EcoR I和 Hind Ⅲ双酶切后的产物 |
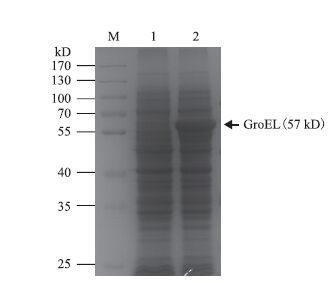
与含有空质粒的对照菌株相比,重组菌株E.coli BL21(DE3)/pET-22b(+)-groEL在57 kD处出现一条明显的特异条带(图 5),其分子量与目的蛋白基本吻合,说明groEL已在大肠杆菌中成功表达。
|
| 图 5 groEL在大肠杆菌中的诱导表达 |
图 6显示,无压力添加的条件下,重组菌株和对照菌株的生长阶段没有明显的差异,延滞期均为0-4 h,对数生长期是4-14 h,但重组菌株在对数期的生长速率略高于对照菌株。之后两个菌株的生长均进入稳定期,培养14 h后OD600达到最大,为0.77。
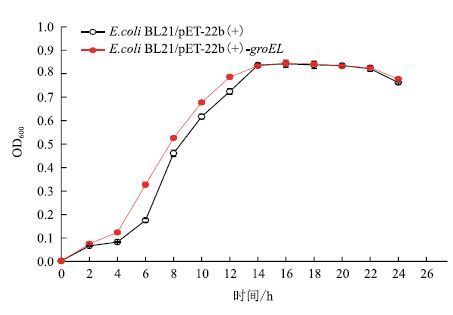
|
| 图 6 菌株无压力条件下的生长曲线 |
图 7显示,10%(V/V)乙醇及50℃高温处理条件下,重组菌株和对照菌株的存活率无明显差别,而重组菌株在15%甲醇、3 mol/L山梨醇的高渗压力及强酸条件(pH=3.0)等压力冲击条件下的存活率与对照组相比分别提高了9.94%、16.70%和30.79%。以上结果说明,简单节杆菌中的groEL基因的表达能够不同程度的提高大肠杆菌在甲醇、高渗和强酸等压力冲击条件下的存活能力。
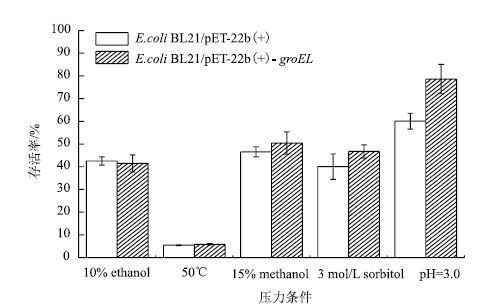
|
| 图 7 各种冲击条件下菌株存活情况 |
图 8显示,4%(V/V)乙醇和42℃条件下,重组菌株和对照菌株的生长均无明显差别。在5%(V/V)甲醇、1 mol/L山梨醇和pH=5.0的条件下,重组菌株的相对OD600值较对照菌株均有所提高。其中,5%(V/V)甲醇条件下培养30 h后,重组菌株相对OD600达到了0.64,比对照菌株提高了6.72%;1 mol/L山梨醇条件下培养30 h时,重组菌株相对OD600达到了1.07,与对照菌株相比提高了22.53%;pH=5.0条件下培养30 h时,重组菌株相对OD600达到了0.86,与对照菌株相比提高了33.03%。这说明简单节杆菌中GroEL的表达能够提高大肠杆菌在甲醇、高渗和强酸这3种压力条件下的生长性能。
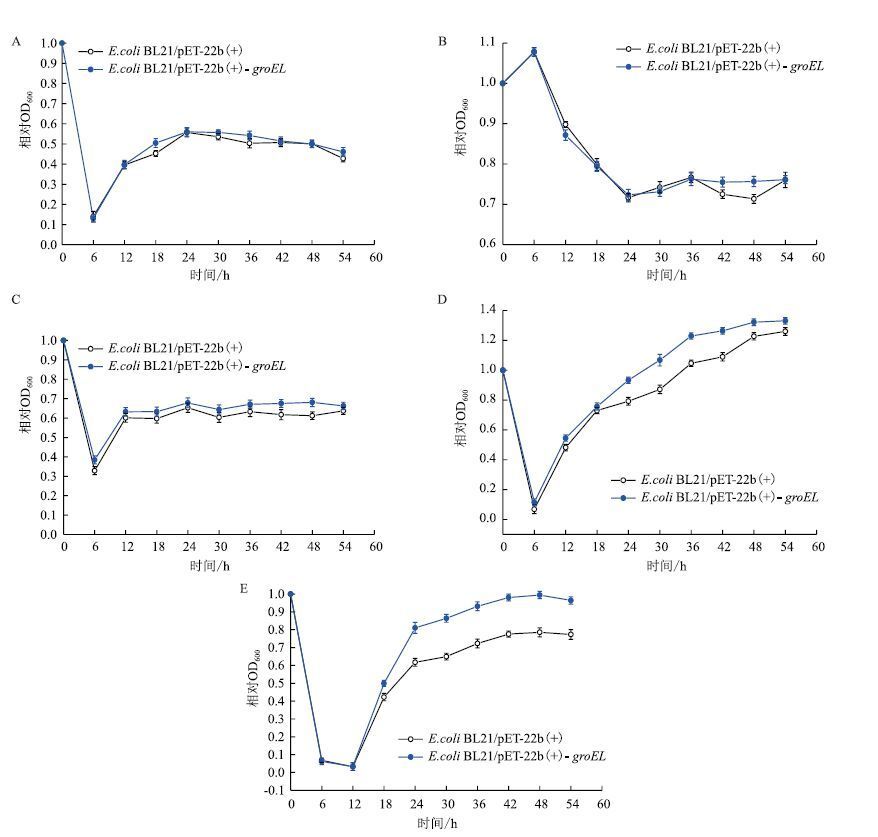
|
| 图 8 E.coli BL21/pET-22b(+)和E.coli BL21/pET-22b(+)-groEL在适当压力下的生长情况 A:4%乙醇溶液;B:42℃;C:5%甲醇;D:1 mol/L山梨醇;E:pH=5 |
简单节杆菌(Arthrobacter simplex)是工业上普遍使用的用于甾体化合物C1,2脱氢反应的生产菌株,转化体系中多采用添加有机溶剂(如乙醇)的方法促进疏水性底物的溶解[10]。但有机溶剂的用量却因为其对微生物的不利影响受到严格控制,这大大限制了转化体系中底物的投料量,最终影响转化效率。因此,迫切需要提高现有菌株的有机溶剂耐受性,而充分认识简单节杆菌在有机溶剂条件下的适应行为是完成上述工作的重要基础。课题组前期工作中,通过LC-MS/MS和生物信息学分析发现,热激蛋白GroEL与菌体乙醇胁迫条件下的适应行为密切相关[9]。在此基础上,本研究克隆得到了简单节杆菌中GroEL基因的全序列,序列同源性分析结果表明,该菌株中GroEL的核苷酸和氨基酸序列与Nocardioides sp. JS614来源的GroEL同源性最高,分别为89%和95%。
GroEL是一种热激蛋白,本研究发现,简单节杆菌中groEL基因的异源表达对大肠杆菌的抗逆性能产生了明显的影响,重组菌株在甲醇、高渗和强酸这3种压力高浓度冲击条件下的存活能力和适当压力条件下的生长性能均明显提高。这一结果与文献报道的情况相似。2013年,Zingaro等[14]将groESL在大肠杆菌中进行过表达,结果表明,与对照菌株相比,重组菌株分别在4%(V/V)乙醇、0.75%(V/V)正丁醇、1.25%(V/V)2-丁醇、20%(V/V)1,2,4-丁三醇中培养48 h后,菌体浓度分别增大了12、2.8、3和4倍。这说明热激蛋白groESL对于提高微生物的有机溶剂耐受性具有良好效果。2014年,孙翔英等[15]将腾冲嗜热菌(Thermoanae-robacter tengcongensis MB4)中的groEL基因在大肠杆菌中表达,结果发现,重组菌株43℃培养3 h后的OD600是对照菌株的1.39倍,同时,乙酸耐受性提高了16%。这些结果都说明,热激蛋白的异源表达在改善细胞受到应激胁迫时的生存能力和提高细胞环境耐受性方面表现出良好的效果,但不同微生物来源的groEL基因在影响微生物抗逆性能方面的作用存在一定差异。目前本课题组正在建立适合简单节杆菌的遗传表达体系,下一步将通过groEL基因的过表达,进一步明确该基因在简单节杆菌乙醇胁迫条件下适应行为中发挥的生物学功能。该工作是简单节杆菌中groEL基因克隆与表达的首次报道,也为深入研究该菌株中热激蛋白GroEL的生物学功能提供了基础数据。
4 结论本研究通过PCR技术成功从A. simplex TCCC 11037基因组中扩增出groEL基因的全序列,该序列信息已提交GenBank注册,登录号为KJ854907。简单节杆菌中groEL基因的全长1 632 bp,编码544个氨基酸,其核苷酸和氨基酸序列与Nocardioides sp. JS614来源的GroEL同源性最高,分别为89%和95%。通过pET-22b(+)表达载体将该基因在大肠杆菌中进行异源表达,蛋白大小为57 kD左右。进一步考察groEL异源表达对大肠杆菌生长和抗逆性能的影响。结果表明,简单节杆菌中groEL基因的表达对大肠杆菌无压力条件下生长特性无明显影响,但重组菌株在甲醇、高渗和强酸这3种压力高浓度冲击条件下的存活能力和适当压力条件下的生长性能均明显提高。
| [1] | Alsaker KV, Paredes C, Papoutsakis ET. Metabolite stress and tolerance in the production of biofuels and chemicals:Gene-expression-based systems analysis of butanol, butyrate, and acetate stresses in the anaerobe Clostridium acetobutylicum[J]. Biotechnology and Bioengineering, 2010, 105(6): 1131–1147. |
| [2] | Dunlop MJ. Engineering microbes for tolerance to next-generation biofuels[J]. Biotechnol Biofuels, 2011, 4(1): 32–40. |
| [3] | Kang HJ, Heo DH, Choi SW, et al. Functional characterization of Hsp33 protein from Bacillus psychrosaccharolyticus:additional function of HSP33 on resistance to solvent stress[J]. Biochemical and Biophysical Research Communications, 2007, 358(3): 743–750. |
| [4] | Zingaro KA, Papoutsakis ET. Toward a semisynthetic stress response system to engineer microbial solvent tolerance[J]. Mbio, 2012, 3(5): e00308–12. |
| [5] | Sugimoto S, Higashi C, Matsumoto S, et al. Improvement of multiple-stress tolerance and lactic acid production in Lactococcus lactis NZ9000 under conditions of thermal stress by heterologous expression of Escherichia coli dnaK[J]. Applied and Environmental Microbiology, 2010, 76(13): 4277–4285. |
| [6] | Desmond C, Fitzgerald GF, Stanton C, et al. Improved stress tolerance of GroESL-overproducing Lactococcus lactis and probiotic Lactobacillus paracasei NFBC 338[J]. Applied and Environmental Microbiology, 2004, 70(10): 5929–5926. |
| [7] | 骆健美, 宋妍, 王建锋, 等. 基于细胞性质分析不同有机溶剂对简单节杆菌C1, 2脱氢反应的影响[J]. 化学与生物工程, 2012, 29(5): 49–53. |
| [8] | 宁静, 刘莉娜, 王敏, 骆健美. 乙醇对简单节杆菌生长、生理特性和细胞结构的影响[J]. 天津科技大学学报, 2013, 28(6): 9–14. |
| [9] | 宁静. 乙醇条件下简单节杆菌细胞性质的变化及其对物质跨细胞运输的影响[D]. 天津:天津科技大学, 2013. |
| [10] | 李福, 王普, 李荣贵. 有机溶剂/水两液相体系中甾体激素的生物国转[J]. 生物技术, 2004, 14(3): 76–79. |
| [11] | Alexandre H, Ansanay-Galeote V, Dequin S, Blondin B. Globalgene expression duringshort-termethanolstressin Saccharomyces cerevisiae[J]. FEBS Letters, 2011, 498(1): 98–103. |
| [12] | Akiko OK, Wang Y, Sachiko K, et al. Cloning and characterization of groESL operon in Acetobacter aceti[J]. Journal of Bioscience and Bioengineering, 2002, 94(2): 140–147. |
| [13] | Tomas CA, Beamish J, Papoutsakis ET. Transcriptional analysis of butanol stress and tolerance in Clostridium acetobutylicum[J]. J Bacteriol, 2004, 186: 2006–2018. |
| [14] | Zingaro KA, Terry Papoutsakis E. GroESL overexpression imparts Escherichia coli tolerance to i-, n-, and 2-butanol, 1, 2, 4-butanetriol and ethanol with complex and unpredictable patterns[J]. Metabolic Engineering, 2013, (15): 196–205. |
| [15] | 孙翔英. 人工构建耐热大肠杆菌的分子设计与应用[D]. 石河子:石河子大学, 2014. |




