微生物多糖主要指某些细菌、真菌和藻类等微生物在代谢过程中产生的多糖。按照微生物分泌多糖的部位可将其分为胞壁多糖、胞内多糖和胞外多糖三大类,其中胞外多糖具有产生量大、易与菌体分离、可通过发酵实现工业化生产等优点,是研究和应用较多的一类微生物多糖[1]。随着对微生物胞外多糖研究的深入,人们发现其具有许多生物活性,如免疫调节、降血糖、抗肿瘤、抗氧化及絮凝等,如Takeuchi等[2]报道Xanthomonas campestri产生的黄原胶具有一定的抗肿瘤活性,Zhao等[3]报道Pseudomonas fluorescen PGM37产生的胞外多糖具有较好的吸水保湿和抗氧化性能,Lian等[4]研究表明Bacillus mucilaginosus胞外多糖能够捕捉水中的重金属离子,可作为生物絮凝剂,在净化工业废水等领域发挥作用。因此,微生物胞外多糖在新药研发、保健食品开发及环境保护等领域应用前景较好。
本研究拟从土壤样品中筛选出产胞外多糖的菌株,并对其产生的胞外多糖的性质、结构等作初步的分析研究,旨在为该胞外多糖日后的进一步研究开发提供基础数据。
1 材料与方法 1.1 材料 1.1.1 土壤样品采自江西省上饶市玉山县三清山山脚。
1.1.2 试剂PCR所用的Taq Master Mix购自Vazyme公司;DNA凝胶回收试剂盒购自AXYGEN公司;引物由上海桑尼生物科技有限公司合成;其余试剂均为国产分析纯。
1.1.3 主要仪器HZQ-F100全温振荡培养箱,太仓市华美生化仪器厂;高速离心机,美国Sigma公司;NDJ-8S旋转黏度计,上海平轩科学仪器有限公司;PCR仪,美国Bio-Rad公司;凝胶图像分析仪,上海培清科技有限公司;真空冷冻干燥机,北京四环科学仪器厂;酶标仪,美国BioTek公司;气相色谱仪,美国Agilent科技公司;傅立叶转换红外光谱仪、AV-500核磁共振仪,德国Bruker公司。
1.1.4 培养基蔗糖20 g/L,KNO3 3.0 g/L,Na2HPO4 2.0 g/L,MgCl2 0.2 g/L,CaCl2 0.07 g/L,FeCl2 0.0125 g/L,MnSO4 0.003 g/L,ZnCl2 0.0075 g/L,pH 7.0。此培养基加入2%的琼脂即可配成相应固体培养基。
1.2 方法 1.2.1 菌株筛选及纯化 1.2.1.1 菌株筛选将土样分为10组,各组称取1 g土样加入到装有液体培养基的锥形瓶中,在200 r/min,30℃条件下培养2 d后,从各组锥形瓶中各取1 mL培养基再次接入培养基中,相同条件下培养2 d再富集一次。再从各组各取1 mL富集后培养基加入到9 mL无菌水中,混匀制成菌悬液,采用10倍梯度稀释,取 10-6-10-4稀释度的菌悬液涂于固体培养基的培养皿,放入30℃恒温培养箱中倒置培养。
1.2.1.2 菌株纯化涂布好的培养皿培养2 d,待长出菌落后,根据菌落形态特征挑取单菌落在培养皿上划线,并重复3次,直到培养皿上长出的菌落为单一形态的菌落。挑选无色透明、有黏性的菌落编号后,分别接种至液体培养基中,200 r/min,30℃条件下培养2-4 d后发酵液变粘,并使用苯酚硫酸法[5]鉴定胞外产物。
1.2.2 菌株鉴定采用基因组DNA提取试剂盒提取待测菌种的基因组DNA,利用细菌16S rDNA通用引物2F:5'-CATGCAAGTCGAGCG-3';2R:5'-GGTGTGACGGGCGGT-3'进行PCR扩增,PCR程序:94℃预变性 1 min;94℃变性 30 s,55℃退火 30 s,72℃延伸 2 min,30个循环;72℃延伸 10 min。扩增产物采用DNA凝胶回收试剂盒回收后在上海桑尼生物科技有限公司测序,对测序结果与NCBI数据库BLAST序列比对,确定待测菌株的属种。
1.2.3 胞外多糖提取及纯化向发酵2 d的培养基中加入1倍体积去离子水稀释,8 000 r/min,离心15 min收集上清,去除菌体沉淀。向上清液中加入2倍体积95%乙醇,混匀后8 000 r/min,离心15 min弃上清,收集沉淀,即为粗多糖。粗多糖干燥后复溶于水配制成1%溶液,用Sevag法[6]去蛋白,加入Sevag试剂(氯仿∶正丁醇=4∶1)和多糖溶液以1∶1比例混匀,剧烈震荡10 min,8 000 r/min,离心10 min,取上清液,反复多次至两相界面无白色黏稠状沉淀,使用酶标仪在280 nm下检测去蛋白效果。将多糖溶液在去离子水中透析24 h,然后加入2倍体积95%乙醇,混匀后8 000 r/min,离心15 min收集沉淀,在真空干燥箱中45℃干燥,得到纯化多糖。
1.2.4 胞外多糖流变学特性测定称取适量干燥的胞外多糖,溶于去离子水中,配制成1%的多糖溶液,分别测定质量浓度(1、2、4、6、8、10 g/L)、不同温度(25、30、40、50、60、70、80、90和100℃)、pH(2、4、6、7、8、10和12)、无机盐(NaCl、KCl、MgCl2、CaCl2和FeCl3)对其黏度的影响。实验中采用NDJ-8S旋转黏度计于室温,2号转子,6 r/min条件下测定黏度,待读数稳定读出黏度值。
1.2.5 胞外多糖结构分析 1.2.5.1 气相色谱分析[7](1)称取10 mg干燥的D-葡萄糖、D-甘露糖、L-阿拉伯糖、D-半乳糖、D-木糖、L-鼠李糖于试管中,各加入10 mg盐酸羟胺和0.6 mL吡啶,90℃水浴反应30 min,冷却至室温后加入0.5 mL乙酸酐,在90℃水浴下继续反应30 min进行乙酰化,然后将反应产物放入80℃真空干燥箱中干燥后用1 mL氯仿溶解作气相色谱分析。(2)称取20 mg干燥纯化多糖,加入2 mol/L的三氟乙酸(TFA)10 mL,110℃水解6 h,然后将水解产物放入80℃真空干燥箱中干燥后加入2 mL甲醇蒸干,并重复3-4次,以除去三氟乙酸,然后按照上述标准单糖衍生化方法将水解产物衍生化,80℃真空干燥后用1 mL氯仿溶解作气相色谱分析。(3)色谱条件:色谱柱:DB-5型石英毛细管柱(30 m×0.25 mm×0.25 μm);检测器:氢火焰离子化检测器(FID),温度280℃;进样口温度:250℃,流速1 mL/min;升温程序:150℃保持2 min,每分钟升温8℃至250℃,保持6 min;进样量:2 μL。
1.2.5.2 红外光谱分析取2 mg干燥的纯化多糖与100 mg溴化钾混合研磨压片后,在4 000-400 cm-1范围内进行扫描分析。
1.2.5.3 核磁共振分析[8]称取200 mg纯化多糖配制成为20 mg/mL的溶液,用0.5 mol/L H2SO4将其pH调至2.0,100℃加热水解24 h。水解液冷却后加入适量BaCO3粉末至无气泡产生,12 000 r/min,离心15 min,取上清液在去离子水中透析24 h,再放入冻干机中过夜干燥。称取10 mg干燥后水解多糖,溶于0.5 mL D2O中作1H谱分析;称取30 mg干燥后水解多糖,溶于0.5 mL D2O中作13C谱分析;反应温度30℃。
2 结果 2.1 菌株鉴定结果固体培养基上菌落形态如图 1-A所示,菌落呈圆形,半透明,边缘光滑,表面有光泽,黏稠;图 1-B为光学显微镜下菌体形态,菌体呈杆状,末端钝圆;16S rDNA测序结果显示,其片段大小为1 431 bp,该序列提交至GenBank,登录号为KT285023,测序结果与NCBI数据库进行BLAST同源性比对,菌株与数据库中肠杆菌属Enterobacter sp. 638(NC009436)最相近,相似度达98%,结合菌株菌落形态特征,该菌鉴定为肠杆菌,命名为Enterobacter WL113。通过苯酚硫酸法鉴定菌株产生的胞外黏性物质属于多糖。

|
| 图 1 菌株菌落特征及光学显微镜下菌株形态 A:菌株菌落特征;B:光学显微镜下菌株形态(400×) |
研究不同质量浓度胞外多糖溶液黏度的变化。如图 2-A所示,随着多糖浓度的提高,溶液黏度逐渐增大。1 g/L的多糖溶液黏度为92 mPa·S,而10 g/L的溶液黏度为3 072 mPa·S,黏度提高了约33倍。
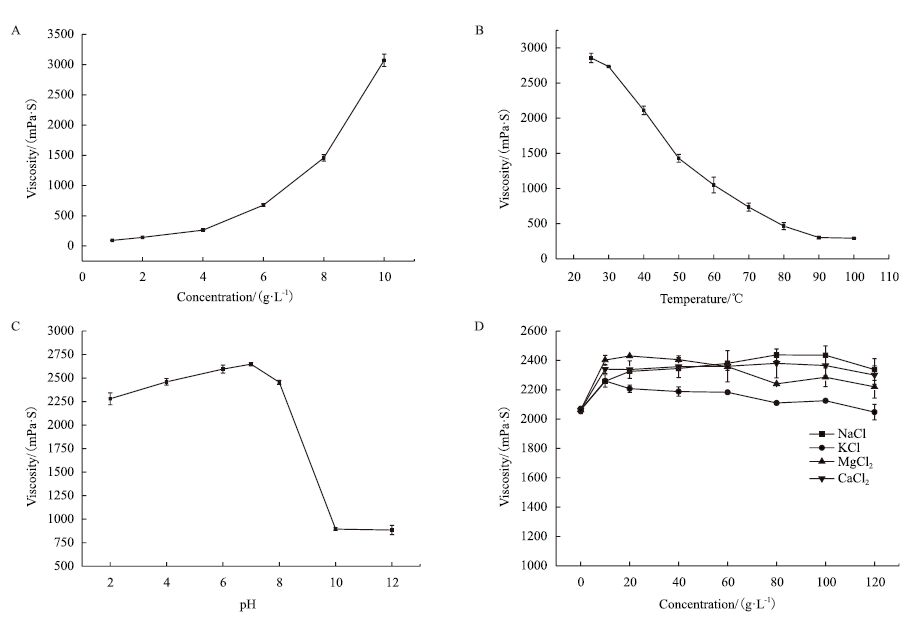
|
| 图 2 胞外多糖流变学特性 A:浓度对胞外多糖黏度的影响;B:温度对胞外多糖黏度的影响;C:pH对胞外多糖黏度的影响;D:无机盐对胞外多糖黏度的影响 |
研究胞外多糖溶液在25-100℃水浴20 min后黏度的变化情况。由图 2-B可以看出,随着温度的升高,多糖溶液黏度逐渐下降,25℃时黏度为2 857 mPa·S,100℃时降为292 mPa·S,降低了89.8%,表明该多糖对温度变化较为敏感,热稳定性较差。实验中发现,100℃水浴20 min后,当温度降回25℃时多糖黏度能够基本恢复,但加热1.5 h后黏度不能恢复,表明长时间高温加热可能会破坏多糖结构。
2.2.3 pH对胞外多糖黏度的影响研究胞外多糖溶液在pH为2-12时黏度的变化情况。如图 2-C所示,多糖在pH值为2-8的范围内黏度变化相对稳定,在中性条件下黏度最高,pH值为10及以上时黏度急剧降低,且调回中性后黏度不恢复,表明其在酸性至弱碱性范围内有较好的酸碱耐受能力,而强碱环境可能会破坏多糖分子结构,导致黏度降低。
2.2.4 无机盐对胞外多糖黏度的影响探究NaCl、KCl、MgCl2、CaCl2和FeCl3浓度分别为1%、2%、4%、6%、8%、10%和12%时对多糖黏度的影响。如图 2-D所示,随着Na+、K+、Mg2+和Ca2+浓度的增加,多糖黏度呈波浪形变化,但总体上均大于未添加无机盐时的黏度。实验中,不同浓度的Fe3+加入到多糖溶液中后均会促进多糖絮凝,产生沉淀。总之,实验结果表明该多糖对Na+、Mg2+等金属盐离子的耐受性能良好。
2.3 胞外多糖结构分析 2.3.1 气相色谱分析标准单糖气相谱图如图 3-A所示,6种单糖的出峰顺序为:1#鼠李糖,2#阿拉伯糖,3#木糖,4#甘露糖,5#葡萄糖,6#半乳糖。图 3-B为胞外多糖的气相谱图,对比图 3-A可知,胞外多糖主要单糖组成为:7#阿拉伯糖,8#甘露糖,9#葡萄糖,根据峰面积计算摩尔比为:阿拉伯糖∶甘露糖∶葡萄糖=1.63∶3.16∶2.38。
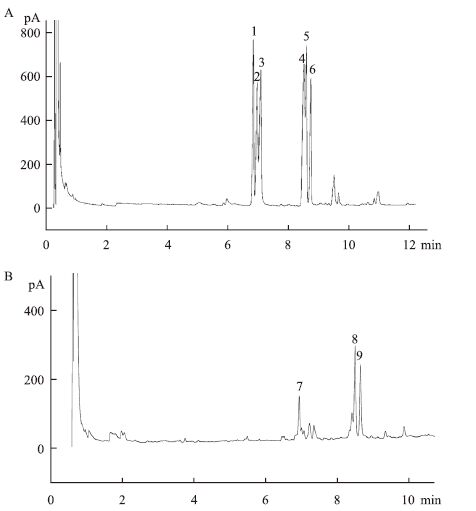
|
| 图 3 胞外多糖气相色谱分析 A:标准单糖气相色谱图;B:胞外多糖气相色谱图 |
胞外多糖的红外光谱如图 4所示,此多糖具有典型的多糖特征吸收峰(3 335、2 924、1 402、777 cm-1)[9]。3 335 cm-1的宽峰是O-H伸缩振动;2 924 cm-1处的弱峰是C-H伸缩振动;1 722 cm-1处的吸收峰由羧基C=O伸缩振动引起,说明多糖分子中可能存在糖醛酸;1 625 cm-1处为酰胺C=O吸收峰,表明该多糖为糖蛋白缀合物[10];1 400-1 200 cm-1处的吸收峰是由于C-H变角振动;1 020和972 cm-1处的吸收峰是由糖分子中两种C-O伸缩振动引起,一种是吡喃糖环内醚键C-O-C,另一种是羟基吸收峰;883和844 cm-1处分别是吡喃糖β型和α型C-H变角振动的吸收峰,表明该多糖存在β型和α型吡喃糖苷[11];777 cm-1处为吡喃糖环的对称伸缩振动。
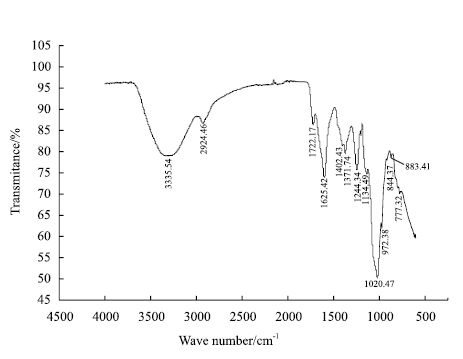
|
| 图 4 胞外多糖红外光谱图 |
图 5-A为胞外多糖1H NMR谱,δ5.0-5.4 ppm范围内信号表明多糖存在α构型,而δ4.4-4.9 ppm范围内信号表明存在β构型,δ1.0-1.5 ppm范围内信号可能为与C-O键相连的甲基质子峰。图 5-B为胞外多糖13C NMR谱,低场区域103 ppm附近化学位移表明含有β型吡喃糖,高场区域99 ppm附近化学位移表明含有α型吡喃糖;δ76-80 ppm处信号表明有发生取代的C-2、C-3、C-4,76 ppm附近为被取代的C-4,δ70-76 ppm处表明有未取代的C-2、C-3、C-4,69 ppm附近信号表明有发生取代的C-6,60 ppm附近信号表明存在游离的C-6[12];175 ppm处的峰是典型的糖醛酸信号峰[13],与红外光谱结果一致;15.5 ppm处信号表明存在C-6脱氧糖的甲基[14]。
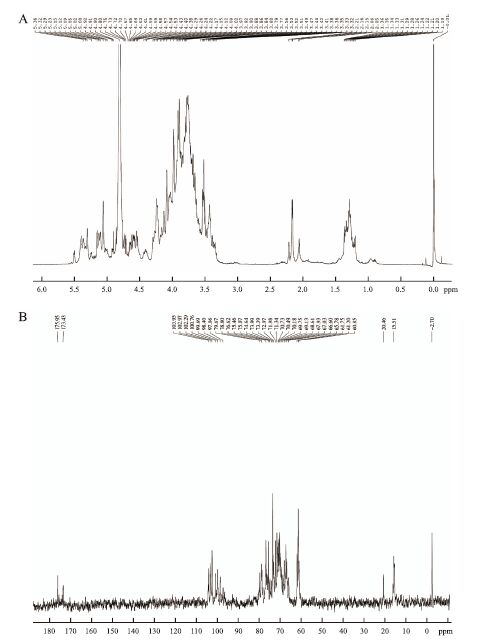
|
| 图 5 胞外多糖核磁共振图谱分析 A:胞外多糖核磁共振氢谱图;B:胞外多糖核磁共振碳谱图 |
在研究胞外多糖流变学特性时,增加多糖浓度及添加Na+、Mg2+等金属盐离子均会使溶液黏度不同程度地增加,可能是因为多糖质量浓度的增加加强了多糖链间的相互作用[15],而加入金属离子后会改变多糖的电荷特性,也导致多糖分子间相互作用加强[16],从而使黏度增大。而长时间高温加热及强碱均可能会破坏多糖结构,导致黏度降低且不能恢复,FeCl3作为一种絮凝剂会沉淀多糖。因此,若应用该多糖则需注意环境条件。
目前,国内外学者对微生物胞外多糖的研究有很多成果。徐春兰等[17]筛选得到产胞外多糖的肠杆菌属菌株Enterobacter Cloacae Z0206,并研究表明该菌株所产富硒多糖有较好的抗氧化活性,对DPPH自由基和羟自由基具有较好的清除作用。Jin等[18]研究表明Enterobacter Cloacae Z0206所产的胞外多糖由葡萄糖、甘露糖和半乳糖组成,摩尔比为6.860∶1.180∶0.455,Lu等[19]进一步研究表明该多糖能增强免疫功能,显示出该多糖具有良好的应用前景。本研究所筛菌株培养条件简单,发酵周期短,胞外多糖产量较高,水溶性良好,并分析了Enterobacter sp. WL113所产胞外多糖的流变学性质和结构,多糖活性方面还未涉及,接下来可对胞外多糖的保湿性能、抗氧化能力及絮凝特性等方面进行探究,分析其应用前景。
4 结论本实验从土壤中筛选出一株产胞外多糖的肠杆菌WL113(Enterobacter sp. WL113)。通过对该菌所产胞外多糖的流变学分析表明,胞外多糖溶液黏度随质量浓度升高而增大,浓度为10 g/L时黏度比1 g/L时提高约33倍;对温度敏感,100℃时黏度比25℃时降低了89.8%,随着温度升高,黏度下降明显;在酸性、中性和弱碱性条件下黏度相对稳定;对Na+、K+、Mg2+和Ca2+等金属盐离子耐受性能良好。分离纯化多糖后,通过气相色谱、红外和核磁共振对多糖结构进行分析,表明该多糖主要由阿拉伯糖、甘露糖和葡萄糖组成,摩尔比阿拉伯糖∶甘露糖∶葡萄糖=1.63∶3.16∶2.38,含有α型和β型吡喃糖,存在糖醛酸。
| [1] | 崔艳红, 黄现青. 微生物胞外多糖研究进展[J]. 生物技术通报, 2006, 2: 25–28. |
| [2] | Takeuchi A, Kamiryou Y, Yamada H, et al. Oral administration of xanthan gum enhances antitumor activity through Toll-like receptor 4[J]. Int Immunopharmacol, 2009, 9(13): 1562–1567. |
| [3] | Zhao L, Fan F, Wang P. Culture medium optimization of a new bacterial extracellular polysaccharide with excellent moisture retention activity[J]. Appl Microbiol Biotechnol, 2013, 97(7): 2841–2850. |
| [4] | Lian B, Chen Y, Zhao J, et al. Microbial Flocculation by Bacillus mucilaginosus:Applications and mechanisms[J]. Bioresource Technology, 2008, 99(11): 4825–4831. |
| [5] | 池源, 王丽波. 苯酚-硫酸法测定南瓜籽多糖含量的条件优化[J]. 食品与机械, 2014, 30(1): 89–92. |
| [6] | Qin G, Zhu L, Chen X. Structural characterization and ecological roles of a novel exopolysaccharide from the deep-sea psychrotolerant bacterium Pseudoalteromonas sp. SM9913[J]. Microbiology, 2007, 153(5): 1566–1572. |
| [7] | Zhao Z, Li J, Wu X. Structures and immunological activities of two pectic polysaccharides from the fruits of Ziziphus jujuba Mill. cv. jinsixiaozao Hort[J]. Food Research Internationa, 2006, 39(8): 917–923. |
| [8] | Xiu A, Kong Y, Zhou M, et al. The chemical and digestive properties of a soluble glucan from Agrobacterium sp. ZX09[J]. Carbohydrate Polymers, 2010, 82(3): 623–628. |
| [9] | 李伟欣, 陈倩, 李平兰, 等. 双歧杆菌22-5胞外多糖结构分析[J]. 食品科学, 2008, 29(4): 267–271. |
| [10] | 梅光明, 郝强, 张小军, 等. 酸提香菇多糖的分离纯化及结构鉴定[J]. 现代食品科技, 2014, 30(9): 79–84. |
| [11] | Shang N, Xu R, Li P. Structure characterization of an exopolysaccharide produced by Bifidobacterium animalis RH[J]. Carbohydrate Polymers, 2013, 91(1): 128–134. |
| [12] | 刘葳, 于源华, 毛亚杰, 等. 黄绿蜜环菌多糖的分离纯化与组成结构分析[J]. 长春理工大学学报, 2007, 30(2): 102–1025. |
| [13] | Kang J, Cui SW, Phillips GO, et al. New studies on gum ghatti(Anogeissus latifolia)part II Structure characterization of an arabinogalactan from the gum by 1D, 2D NMR spectroscopy and methylation analysis[J]. Food Hydrocolloids, 2011, 25(8): 1991–1998. |
| [14] | 王展, 方积年. 高场核磁共振波谱在多糖结构研究中的应用[J]. 分析化学, 2000, 28(2): 140–247. |
| [15] | Alves VD, Freitas F, Torres CAV, et al. Rheological and morphol-ogical characterization of the culture broth during exopolysaccharide production by Enterobacter sp[J]. Carbohydrate Polymers, 2010, 48(3): 758–764. |
| [16] | 毛志勇, 姜淑娟, 钱方, 等. 一株西藏灵菇嗜热链球菌产胞外多糖的流变学特性[J]. 食品与机械, 2012, 28(1): 32–34. |
| [17] | 徐春兰, 钦传光, 尚晓娅, 等. Enterobacter Cloacae Z0206细菌胞外富硒多糖的抗氧化活性[J]. 化学研究, 2010, 02: 64–68. |
| [18] | Jin M, Wang Y, Xu C, et al. Preparation and biological activities of an exopolysaccharide produced by Enterobacter cloacae Z0206[J]. Carbohydrate Polymers, 2010, 81(3): 607–611. |
| [19] | Lu Z, Jin M, Huang M, et al. Bioactivity of selenium-enriched exopolysaccharides produced by Enterobacter cloacae Z0206 in broilers[J]. Carbohydrate Polymers, 2013, 96(1): 131–136. |




