2. 河北省生物工程技术研究中心,保定 071002
2. Research Center of Bioengineering of Hebei Province,Baoding 071002
嗜盐菌是生活在高盐度环境中的一类微生物总称。由于特殊的生存环境,嗜盐菌形成了独特的种群特点和代谢机制,可产生许多具有特殊功能的代谢产物。根据对盐度需求的不同,嗜盐菌可以分为3类 [1] :轻度嗜盐菌,可在1%-3%的盐度下快速生长;中度嗜盐菌,最适生长盐度为3%-15%;极端嗜盐菌(一般属于古菌),可以在15%-30%盐度下快速生长。与轻度嗜盐菌相比,中度嗜盐菌可在较高盐环境中生长,能减少发酵过程中杂菌污染[2, 3]。并且,与极端嗜盐菌相比,中度嗜盐菌的分布广泛、营养要求较低、易于适应环境,工业应用价值高。
晒盐场是一类特殊的生境,由于含盐度较高,沉积物中蕴藏着丰富的嗜盐菌资源,从晒盐场分离筛选嗜盐菌已经引起研究关注[4, 5]。徐闻盐场始建于1956年,位于广东省湛江市徐闻县的一个半岛上,是广东省四大省属盐场之一。徐闻盐场沉积物经过多年的蓄积,形成了特殊的高盐生态环境,十分适合嗜盐菌生存。本研究从徐闻盐场采集环境样品,旨在从中分离培养嗜盐菌,着重寻找具备分泌抗菌活性产物的菌株。通过生理生化实验和16S rRNA序列分析对筛选得到的嗜盐菌进行分类鉴定。考察嗜盐菌株的生长特性和抗菌活性,并对其所产生的抗菌活性物质开展理化特性研究。
1 材料与方法 1.1 材料LB(Luria-Bertani)培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0,使用前121℃灭菌20 min;YEPD(Yeast Extract Peptone Dextrose)培养基:胰蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L,pH 7.0,使用前115℃灭菌15 min。上述培养基若制备固体培养基,加入20 g/L琼脂粉即可。
1.2 方法 1.2.1 菌株分离、筛选及鉴定样品采集于广东省湛江市徐闻盐场沉积物。取1.0 g样品于100 mL含有100 g/L NaCl的液体LB培养基中,37℃恒温培养3 d以富集嗜盐菌。富集培养液经适当稀释后取0.2 mL涂布LB固体培养基平板(含有100 g/L NaCl),37℃培养,挑取生长速度快、菌落直径大的单菌落,多次分离纯化,以得到纯培养物。将筛选得到的菌株参照《常见细菌系统鉴定手册》6]进行生理生化鉴定,并对其16S rRNA序列扩增测序,扩增时使用细菌通用引物:正向引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、反向引物1492R(5'-GGCTACCTTGTTACGACTT-3'),实验方法参照文献[1] ,测序由北京华大基因公司完成,测序结果提交至GenBank数据库,并进行比对分析。
1.2.2 菌株的生理特性考察使用LB液体培养基培养分离得到的菌株,测定其在不同NaCl浓度和pH条件下生长的菌体生物量(OD600),培养条件为:150 r/min、37℃,培养时间为24 h。实验使用的NaCl浓度梯度为:30、80、100、120、150和200 g/L;pH实验梯度分别为:3.0、5.0、6.0、7.0、8.0和10.0。
1.2.3 管碟法测定抗菌活性 1.2.3.1 指示菌革兰氏阳性细菌:大肠杆菌(Esch-erichia coli)、荧光假单胞菌(Pseudomonas fluoresc-ens);革兰氏阳性细菌:德氏乳杆菌(Lactobacillus delbrueckii)、金黄色葡萄球菌(Staphylococcus aur-eus)、枯草芽胞杆菌(Bacillus subtilis);酵母菌:酿酒酵母(Saccharomyces cerevisiae);丝状真菌:黑曲霉(Aspergillus niger)、绿色木霉(Trichodermavir-ide)、黄曲霉(Aspergillus flavus)。
1.2.3.2 待测发酵样品制备将分离得到的嗜盐菌接种到含100 g/L NaCl的LB液体培养基中,于37℃振荡培养24 h获得待测发酵液。培养得到的发酵液于10 000 r/min条件下离心20 min去除菌体,保留上清液待测。
1.2.3.3 指示菌菌悬液及检测平板制备将指示菌分别接种至含有液体培养基的三角瓶中,培养24 h得到菌悬液。其中,细菌指示菌培养基使用LB培养基,培养条件为37℃和150 r/min;酿酒酵母和丝状真菌培养使用YEPD培养基,条件为28℃和200 r/min。
将制备好的指示菌菌悬液与LB培养基或YEPD培养基按照1∶100(V/V)混合,倒平板,待凝固后备用。每个平板中含有培养基约20 mL。
1.2.3.4 抗菌活性的检测参照李晓凤等[7]描述的管碟法检测抗菌活性。在1.2.3.3中制备好的检测平板上放置灭菌后的牛津杯,向每个牛津杯中加入待测菌的发酵上清液100 μL,37℃恒温培养24 h后测定抑菌圈直径来表征抗菌活性高低。用未接种的LB培养基(含有100 g/L NaCl)作阴性对照,以消除培养基组分对抑菌结果的干扰。本研究获得的抑菌圈直径数值均为待测菌所产抗菌活性物质的真实抑菌效果体现,即为发酵上清液抗菌圈直径减去阴性对照抑菌圈直径。每个平板中放置6个牛津杯,其中3个为阴性对照,每种指示菌做3个平行实验,实验结果为3组实验的平均值。
1.2.4 抗菌物质的初步鉴定按方法1.2.3.2制备嗜盐菌发酵上清液。参照剧建格等[8]描述的方法,研究嗜盐菌发酵液中抗菌物质类别。按方法1.2.3.4以金黄色葡萄球菌为指示菌检测抗菌物质的抗菌能力。
首先,通过比较嗜盐菌培养前后发酵液pH值的变化判断发酵过程中是否产生有机酸/碱性。然后,用650 g/L的硫酸铵对发酵上清液进行盐析处理,收集沉淀复溶于磷酸盐缓冲液(25 mmol/L pH7.0)中,进行抑菌活性测定,同时用未经盐析处理的发酵上清液作对照。最后,考察待测菌发酵上清液中抑菌物质的蛋白酶敏感性。将蛋白酶 K 和胃蛋白酶配成 5.0 g/L的溶液,分别取 0.1 mL 于离心管中,再加入嗜盐菌发酵上清液0.4 mL,使酶的终浓度为 1.0 g/L。蛋白酶 K反应体系的pH值为7.0,胃蛋白酶的反应体系 pH值为2.5。将0.1 mL超纯水代替酶溶液作为蛋白酶实验对照组,37℃温育4 h后取样检测抑菌活性的变化。
1.2.5 抗菌物质分子量范围的确定使用MSC300型实验室小型超滤杯(上海摩速科学器材有限公司),更换不同截留分子量超滤膜(3 kD、5 kD、10 kD、20 kD、100 kD)处理方法1.2.3.2制备获得的嗜盐菌发酵上清液,收集超滤膜透过液,以金黄色葡萄球菌为指示菌,按方法1.2.3.4检测其抗菌活性,以未经处理的嗜盐菌发酵上清液作对照。
1.2.6 抗菌物质酸碱和温度稳定性考察按方法1.2.3.2制备嗜盐菌发酵上清液。用0.1 mol/L的HCl及0.1 mol/L的NaOH溶液将发酵上清液调至pH值分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0,室温25℃静置30 min,然后再调至中性(pH7.0)。最后,将实验组和对照组(未经处理的发酵上清液)使用无菌水调整至相同体积,再依照方法1.2.3.4以金黄色葡萄球菌为指示菌检测抗菌活性。
对待测菌发酵上清液进行不同温度(37℃、60℃、90℃)处理。在相应温度静置保持一段时间(30 min、60 min、90 min)后,再依方法1.2.3.4以金黄色葡萄糖球菌为指示菌考察抑菌性能。
2 结果 2.1 菌种的分离鉴定对从徐闻盐场沉积物中采集的样品进行嗜盐菌分离筛选。以含有100 g/L NaCl的LB培养基富集样品,37℃培养3 d后发现培养液明显浑浊,将其适当稀释后涂布于LB固体培养基平板上,经多次分离纯化,获得一菌株纯培养物,命名为N522。
菌株N522在LB 固体培养基上菌落呈圆形,边缘整齐、不透明、显乳白色、表面突起、湿润而有光泽。显微镜镜检发现,该菌呈杆状,有中生或端生芽胞,菌体长2.5-3.7 μm,宽0.6-0.8 μm。菌株N522革兰氏染色呈阳性,其生理生化实验结果如表 1。菌株N522的16S rRNA进行测序,测序结果提交GenBank(登录号为KT364252)。经过序列比对分析,菌株N522与达坂喜盐芽胞杆菌(Halobacillus dabanensis)同源性达99%以上。根据生理生化实验结果和16S rRNA测序分析结果,初步鉴定菌株N522为达坂喜盐芽胞杆菌,命名为Halobacillus dabanensis N522。使用Hitachi SU8010型扫描电子显微镜观察H. dabanensis N522的结果如图 1所示。

|
| 图 1 H.dabanensis N522的扫描电镜图 |
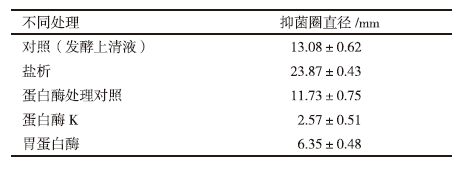
在37℃,pH值7.0培养条件下,首先考察了NaCl浓度对菌株N522生长的影响,结果见图 2。当NaCl浓度为30 g/L时,菌株N522生长很微弱,培养24 h后菌体生物量(以OD600表征)仅有0.20。在NaCl浓度为80-150 g/L范围内,菌株N522呈现明显生长状态。当NaCl浓度为100 g/L时,菌体生长得到生物量最高。当NaCl浓度继续升高,菌株N522生长受到抑制。当LB培养基中NaCl浓度达到200 g/L时,菌体生物量下降明显。结果显示,菌株N522在NaCl浓度为100 g/L时,生长最为旺盛,是典型的嗜盐菌。根据微生物生长对NaCl浓度[1]范围依赖程度,推断菌株N522属于中度嗜盐菌类群。
|
| 图 2 NaCl浓度对N522生长的影响, |
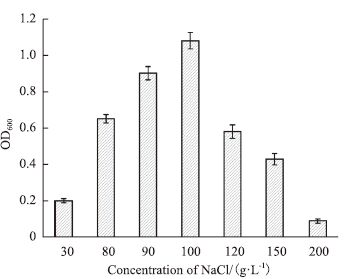
在37℃,NaCl浓度为100 g/L时的培养条件下,考察培养基pH对菌株N522生长的影响,结果见图 3。培养基初始pH为3.0时,菌株N522生长很微弱;随着培养基初始pH的上升(由3.0上升到7.0),菌种N522生长明显,培养得到的菌体生物量逐渐增高;当培养基pH超过7.0时,培养所得菌体生物量又呈现逐渐降低的趋势,这说明菌株N522的最适生长pH为7.0。
|
| 图 3 pH对N522生长的影响 |
菌株N522发酵上清液对供试指示菌的抗菌实验结果如表 2所示。结果表明,菌株N522的发酵上清液抗菌谱广,对所有供试指示菌都具有抑制作用。其中,对革兰氏阳性细菌的抑制能力很强,抑菌圈的直径均达到10 mm以上。尤其对金黄色葡萄球菌的抑制能力最强,抑菌圈达到13.26±0.47 mm。菌株N522对革兰氏阴性菌和酿酒酵母也具有一定的抑制能力,但抑菌效果相对较弱,抑菌圈直径均低于4 mm。并且,菌株N522发酵上清液对供试的丝状真菌均具有较为理想的抑制能力,抑菌圈的直径均在6 mm以上,抑制能力大小顺序为:黑曲霉>黄曲霉>绿色木霉。
菌株N522使用初试pH值为7.0的LB培养基(含有10 g/L NaCl)进行培养。经检验,培养结束后的发酵上清液 pH 值为 7.3左右,相比初始培养基pH值(7.0)没有明显改变。因此,可以判断菌株N522的抗菌活性不是源于培养产生的有机酸/碱物质。菌株N522发酵液进行硫酸铵盐析和蛋白酶处理,对金黄色葡萄球菌指示菌的抑制结果见表 3。结果显示,菌株N522发酵液经盐析后得到的料液抗菌活性明显增高,这表示抗菌物质是可被硫酸铵沉淀的蛋白质或者多肽类物质。蛋白酶敏感性实验结果显示,菌株N522发酵上清液中抑菌活性物质对蛋白酶K非常敏感,经酶解处理后抑菌能力明显下降。并且,胃蛋白酶处理也会降低发酵上清液的抗菌活性,只是破坏性要小于蛋白酶K。
菌株N522发酵上清液经不同截留分子量超滤膜处理后,检测其对金黄色葡萄球菌的抑菌能力。实验结果显示,未经超滤膜处理的发酵上清液抑菌圈直径为12.97±0.57 mm。菌株N522发酵上清液经截留分子量10 kD、20 kD、100 kD的超滤膜过滤后,透过液的抑菌活性与对照组相比没有明显变化。经5 kD超滤膜处理后的透过液抑菌圈直径为10.89±0.61 mm,具有与对照组相似的抑菌能力。然而,发酵上清液经3 kD超滤膜处理后,透过液抑菌能力下降,抑菌圈直径仅为3.04±0.36 mm。结果表明,超滤膜截留分子量高于5 kD时,抑菌活性物质不会被截留,而3 kD超滤膜可明显截留抗菌活性物质。说明菌株N522产生的抑菌物质分子量在3 kD到5 kD之间。结合硫酸铵盐析结果,可以推断菌株N522抗菌活性物质属于多肽类物质。
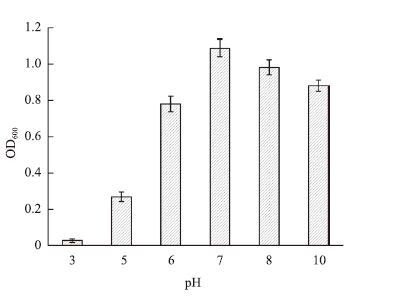
2.6 抗菌活性物质稳定性研究 2.6.1 pH稳定性考察图 4显示了N522所产生的抗菌活性物质对pH的稳定性。实验结果以相对抗菌活性形式呈现,未经处理的N522发酵上清液对金黄色葡萄球菌的抑菌圈直径定义为100%。结果显示,在pH 5.0-8.0的范围内抗菌活性变化不大;pH低于5.0时,抗菌活性随着酸度的增加而明显下降;pH高于9.0时,抗菌活性也呈现随碱性升高而下降的趋势,但是下降趋势较为平缓。
|
| 图 4 抗菌肽的pH稳定性 |
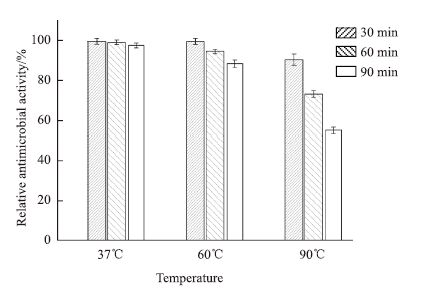
N522发酵上清液经不同温度(37℃、60℃和90℃)处理后,以金黄色葡萄球菌为指示菌,考察发酵上清液抑菌能力变化,实验结果如图 5所示。实验结果以相对抗菌活性形式呈现,未经处理的N522发酵上清液对金黄色葡萄球菌的抑菌圈直径定义为100%。
从图 5可以看出,N522产生的抗菌肽具有良好的热稳定性。在温度37℃时,发酵上清液放置90 min内,抗菌活性没有明显变化。在60℃处理30 min后,抗菌活性变化不明显;继续60℃处理到60 min时,抗菌能力有所下降,但相对抗菌活性仍保持在94%左右;处理90 min后,抗菌活性下降为对照组的87%左右。发酵上清液经90℃处理30 min后抗菌活性也相对稳定;处理60 min后,抗菌活性降低为对照组的73%左右;值得指出的时,当在90℃高温处理90 min后,发酵上清液仍能保持约55%的抗菌活性。
|
| 图 5 抗菌肽的热稳定性 |
嗜盐菌代谢产物结构多样,功能独特,近几年来一直是研究的热点。本研究从广东徐闻盐场沉积物中筛选具有抗菌活性的嗜盐菌,分离得到的嗜盐菌N522在pH值6.0-9.0之间均可以显著生长,NaCl生长范围为80-150 g/L,最适生长盐度为100 g/L,说明该菌属于中度嗜盐菌。根据其生理生化特征和16S rRNA序列分析,初步鉴定该菌株是达坂喜盐芽胞杆菌(Halobacillus dabanensis)。喜盐芽胞杆菌属(Halobacillus)是一个1996年才正式建立的菌属,最早由Spring等[9]发现并定义,模式种为Halobacillus halophila。目前该属细菌已经包含至少11个种,如Halobacillus litoralis、Halobacillus tureperi、Halobacillus yeomjeoni、Halobacillus dabanensis。喜盐芽胞杆菌可分泌多种耐盐酶类(如淀粉酶、脂肪酶),在工业微生物领域应用潜力巨大[10,11]。值得指出的是,有报道喜盐芽胞杆菌还能够合成抗菌抗肿瘤活性物质,这引起了药物工作者的广泛关注。例如,Yang等[12]报道从海洋沉积物中分离得到的Halobacillus litoralis YS3106可以产生拮抗真菌的环肽类物质。陈雷等[1]研究报道了Halobacillus tureperi的抗菌抗肿瘤活性。
受限于菌种资源,国内外针对达坂喜盐芽胞杆菌的报道还不多。达坂喜盐芽胞杆菌最早由Liu等[[13]发现于我国新疆地区达坂盐湖,因分离的地点“达坂”而得名。Kheiralla等[14]报道从埃及分离得到达坂喜盐芽胞杆菌,并对其产生物表面活性剂特性进行了阐述。Feng等[15]研究了不同盐浓度环境下达坂喜盐芽胞杆菌D-8T菌株的蛋白表达谱差异,从而阐述了其耐盐分子机制,并且,赵百锁等[16]对上述菌株中四氢嘧啶合成基因和谷氨酰胺转运蛋白基因进行了克隆和功能分析,详细研究了其耐盐机制和应用前景。
本研究中从我国广东徐闻盐场沉积物中分离得到了达坂喜盐芽胞杆菌,拓宽了该菌株的地理存在范围。并且,首次发现喜盐达坂杆菌具备很好的抗菌活性,尤其是对金黄色葡萄球菌表现出较强抑制作用。近年来,由于金黄色葡萄球菌感染几率的增加以及抗生素滥用所导致的耐药性菌株的出现,使该菌引起感染的治疗变得越来越困难[17]。因此,寻找和开发新型的抗金黄色葡萄球菌的物质,已成为医学和微生物学研究领域的重要课题。本研究分离得到的菌株N522对金黄色葡萄球菌具备较高的抑制能力,预示该菌株的抗菌特性具有较好的应用潜力。李新等[18]报道一株分离自山西运城盐湖的耐盐芽胞杆菌也表现出了很好的拮抗金黄色葡萄球菌效果,说明嗜盐菌在抗菌活性药物筛选方面具有独特的优势。
本研究分离得到的嗜盐菌N522菌株产生的抗菌活性物质对温度有较强的耐受性,发酵上清液经90℃高温处理90 min后仍能保持约55%的抗菌活性。这表明菌株N522的抗菌活性物质在食品防腐领域具有较好的应用前景。分析认为,热稳定性好的原因在于菌株N522分离自广东徐闻盐场,该地处为亚热带气候,环境温度高,长期的进化选择使菌株的代谢产物具备耐受高温能力。硫酸盐盐析实验和蛋白酶酶解实验表明,菌株N522产生的抗菌活性物质为多肽类物质,抗菌物质的分子量研究结果也验证了这一结论。菌株N522产生的抗菌物质在pH中性范围内活性最强,在酸性条件下抗菌活性下降明显,而碱性活性对其影响不大。并且,本研究对菌株N522生长特性考察也显示出了碱性环境耐受性。分析认为,菌株分离地为盐碱地,经过长期适应与驯化,在此生境中菌体生长能力和代谢产物都表现出对碱性相对稳定的特性。
生长在高盐环境(盐湖、晒盐厂、腌制食品)中的嗜盐菌在长期的选择进化和环境选择压力下,形成了特殊的环境适应机制和基因类型,具有产生新颖生物学活性的代谢产物的潜力。因此,嗜盐菌被认为是发现新型天然化合物的重要潜在资源。本研究分离得到的达坂喜盐芽胞杆菌N522具有广谱抗菌活性,是一种发现新颖生物活性物质的潜在资源。以后,还需要对产生抗菌物质进行化学结构分析,对抗菌活性物质进行分离纯化,深入研究其理化性质。
4 结论从广东省湛江市徐闻盐场沉积物中分离得到一株中度嗜盐菌N522,经生理生化和16S rRNA序列分析,鉴定并命名为达坂喜盐芽胞杆菌N522(Halobacillus dabanensis strain N522)。该菌株的最适生长NaCl浓度为100 g/L,最适生长pH为7.0。菌株N522产生的抗菌活性物质对多种细菌和真菌具有抑制作用,对金黄色葡萄球菌抑制能力最强。经硫酸铵盐析和蛋白酶实验分析,初步确定菌株N522产生的抗菌活性物质为多肽类,分子量在3-5 kD之间。并且,菌株N522产生的抗菌活性物质对pH和温度稳定性良好。
| [1] | 陈雷, 王光玉, 卜同, 等. 一株中度嗜盐细菌whb45的鉴定及其抗菌与抗肿瘤活性筛选[J]. 微生物学通报, 2010, 37(1): 85–90. |
| [2] | 任培根, 周培瑾. 中度嗜盐菌的研究进展[J]. 微生物学报, 2003, 43(3): 427–431. |
| [3] | 李维国, 马放, 魏利, 等. 中度嗜盐菌的分离鉴定及对高盐制革废水处理的强化[J]. 华南理工大学学报:自然科学版, 2008, 36(3): 89–94. |
| [4] | 李维国, 马放, 苏俊峰, 等. 一株中度嗜盐菌的分离鉴定研究[J]. 深圳大学学报:理工版, 2008, 25(2): 84–88. |
| [5] | 杨丹丹, 黎乾, 黄晶晶, 等. 岱山盐场可培养嗜盐菌的多样性及其产酶活性筛选[J]. 应用生态学报, 2012, 23(11): 3103–3108. |
| [6] | 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.1330-3361. |
| [7] | 李晓凤, 李淑英, 聂莹, 等. 一株拮抗放线菌T151的鉴定及其抑菌活性物质分析[J]. 生物技术通报, 2013, 3: 171–174. |
| [8] | 剧建格, 于宏伟, 韩军, 等. 广谱高效抑菌物质产生菌的筛选及鉴定[J]. 微生物学通报, 2009, 36(5): 689–693. |
| [9] | Spring S, Ludwig W, Marouez M B, et al. Halobacillus gen. nov., with Descriptions of Halobacillus litoralis sp. nov. and Halobacillus trueperi sp. nov., and Transfer of Sporosarcina halophila to Halobacillus halophilus comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 1996, 46(2): 492–496. |
| [10] | 李新, 孙晓, 李悦佳, 等. 中度嗜盐菌LY9的分离鉴定及其淀粉酶特性研究[J]. 生物技术, 2011, 21(3): 60–63. |
| [11] | Li X, Yu HY, Lin YF. Purification and characterization of an extracellular esterase from a moderately halophilic bacterium, Halobacillus sp. strain LY5[J]. African Journal of Biotechnolog, 2012, 11(23): 6327–6334. |
| [12] | Yang L, Tan R, Wang Q, et al. Antifungal cyclopeptides from Halobacillus litoralis YS3106 of marine origin[J]. Tetrahedron Letters, 2002, 43(37): 6545–6548. |
| [13] | Liu W Y, Zeng J, Wang L, et al. Halobacillus dabanensis sp. nov. and Halobacillus aidingensis sp. nov., isolated from salt lakes in Xinjiang, China[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(5): 1991–1996. |
| [14] | Kheiralla Z H, Ashour SM, Rushdy AA, et al. Characterization of biosurfactants produced by Halobacillus dabanensis and pontibacillus chungwhensi isolated from oil contaminated mangrove ecosystem in Egypt[J]. Applied Biochemistry and Microbiology, 2013, 49(3): 263–269. |
| [15] | Feng DQ, Zhang B, Lu WD, et al. Protein expression analysis of Halobacillus dabanensis D-8T subjected to salt shock[J]. The Journal of Microbiology, 2006, 44(4): 396–374. |
| [16] | 赵百锁. 达坂喜盐芽孢杆菌D-8T四氢嘧啶合成基因的克隆、功能表达和谷氨酰胺转运蛋白基因的克隆[D]. 北京:中国农业大学, 2005. |
| [17] | Miller LG, Perdreau-Remington F, Rieg G, et al. Necrotizing fasciitis caused by community-associated methicillin-resistant Staphylococcus aureus in Los Angeles[J]. New England Journal of Medicine, 2005, 352(14): 1445–1453. |
| [18] | 李新, 于慧瑛, 杜磊, 等. 一株盐湖芽胞杆菌LG 的鉴定及其抗金黄色葡萄球菌活性研究[J]. 微生物学通报, 2015, 42(7): 1294–1300. |