植物内生菌是指一定阶段或全部阶段生活于健康植物的各种组织和器官内部而不使植物患病的真菌或细菌[1]。植物内生菌与其宿主植物互惠共生,协同进化,可以产生具有多种生物学功能的活性代谢产物[2]。1993年,Stierle等[3]从短叶红豆杉Taxus brevifolia的韧皮部分离到一株产抗癌物质紫杉醇的内生真菌。从此掀起了对植物内生菌研究的热潮。植物内生真菌产生的次生代谢产物具有丰富的生物学功能多样性和化学结构多样性,这些次生代谢产物从功能作用上可分为抑菌物质类、杀虫物质类、植物生长调节剂类、抗肿瘤活性物质类及其他类型的活性产物[4]。目前,大多数研究认为,植物内生真菌代谢产物生物学活性作用机制在于其存在着与宿主植物相似的基因结构,诱导宿主基因的表达,调节宿主植物体内的代谢途径,从而实现对宿主植物的促生作用[5]。
碱蓬(Suaeda salsa)是生长于高盐碱土壤中的一种特殊植物,具有抗盐碱、耐贫瘠,抗病虫害同时可以适应高湿度环境等特点。碱蓬可以降低土壤含盐量,增加土壤有机质含量[6],加速潮滩土壤化过程,被誉为盐碱地改造的“先锋植物”[7]。对碱蓬的蛋白质组学分析表明,相关蛋白质点的表达使碱蓬可通过光合作用,能量代谢,离子运输,胁迫防御等多种途径的协同作用耐受一定程度的盐碱胁迫[8];从碱蓬中分离得到的植物内生菌具有丰富的多样性且多为可以生存于盐碱环境的极端微生物。这种极端微生物一般具有与其生长环境相适应的特殊的代谢机制,能产生特殊的代谢产物,并对宿主产生一定的影响[9]。Khan等[10]认为,植物内生菌可以产生与植物激素相类似的生物活性成分,从而实现对植物的促生长作用。但是微生物代谢产物对植物促生机制的研究仍然较少。
本实验室已经从盘锦红海滩盐生碱蓬中共分离得到122株碱蓬内生真菌,证实了碱蓬内生真菌具有丰富的多样性[11]。本研究以从122株碱蓬内生真菌中筛选的JP4-1为实验菌株,对其进行形态学、分子生物学鉴定及生物学特性研究。利用超声破碎、萃取等技术手段,通过水培试验及测量水稻幼苗株高、叶片干重及叶绿素含量等生理指标等评价其代谢产物的促生长作用及具有促生活性的物质成分。旨在探究极端内生真菌与植物互作的作用机理,为植物内生菌(资源)活性产物的研究与开发提供一定的实验依据。
1 材料与方法 1.1 材料 1.1.1 菌株碱蓬内生真菌JP4-1菌株,由沈阳师范大学化学与生命科学学院微生物实验室提供。
1.1.2 水稻种子常规水稻辽星1号,由辽宁省稻作研究所提供。
1.1.3 主要试剂乙酸乙酯、正丁醇、石油醚、真菌基因组快速提取试剂盒购自生工生物(上海)股份有限公司、Hoagland营养液:含0.5 mol/L Ca(NO3)2、0.5 mol/L KNO3、0.25 mol/L MgSO4、0.2 mol/L KH2PO4;50 mmol/L H3BO3、0.6 mmol/L MnSO4、0.3 mmol/L CuSO4·5H2O、0.7 mmol/L ZnSO4·7H2O、0.6 mmol/L H2MoO4、0.6 mmol/L Na2MoO4、20 mmol/L Na-EDTA、20 mmol/L FeSO4·7H2O。
1.1.4 培养基马铃薯蔗糖琼脂培养基(PSA):含20%马铃薯、2%蔗糖、2%琼脂,120℃灭菌20min。马铃薯蔗糖培养基(PSB):含20%马铃薯、2%蔗糖,120℃灭菌20 min。
1.2 方法 1.2.1 JP4-1菌株的鉴定 1.2.1.1 JP4-1菌株的形态学特征观察(1)菌株活化:挑取保存于4℃冰箱中的JP4-1菌株接种于PSA斜面培养基,于25℃培养箱中培养至长满菌落以活化菌种,备用。
(2)菌落形态观察:接种活化后的JP4-1菌丝于PSA平板上,25℃倒置培养数天。期间每24 h观察并记录菌落直径、菌落形态,有无色素生成等菌丝生长状态。
(3)菌丝形态观察:利用小室培养法对JP4-1菌株的菌丝形态进行观察。用无菌玻璃棒沾取少量液体状态下的PSA培养基,滴于无菌盖玻片。待培养基凝固后,用无菌牙签挑取少量活化的JP4-1菌丝接种于培养基表面,将盖玻片倒扣于单凹玻片上,用凡士林封片;25℃培养数天。于显微摄影系统下观察菌丝形态。
1.2.1.2 JP4-1菌株的18SDNA序列分析用真菌基因组快速提取试剂盒提取JP4-1的DNA。以菌株JP4-1基因组DNA为模板,以18S-ITS1:5´-TCCG-TAGGTGAACCTGCGG-3´和18S-ITS4:5´-TCCTCCG-CTTATTGATATGC-3´为引物进行PCR扩增。采用20 μL PCR反应体系,反应条件为:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,共35个循环;72℃延伸10 min;4℃保存。扩增产物由生工生物(上海)股份有限公司进行纯化与测序,将获得的18S rDNA序列在GenBank中通过BLAST进行同源性序列比对,使用MEGA6.0构建系统进化树。
1.2.2 JP4-1菌株促生活性产物的分离 1.2.2.1 JP4-1菌株胞内、胞外产物的分离将对数期生长(培养120 h)的JP4-1菌液用过滤器过滤,分别收集菌丝和发酵液。超声破碎菌丝体细胞,溶于无菌水制成胞内产物溶液,而过滤后的发酵液为胞外产物溶液。
1.2.2.2 JP4-1菌株大分子胞外产物与小分子胞外产物的分离收集培养对数期生长的JP4-1菌株发酵液600 mL,加入3倍体积的95%乙醇,搅拌并离心,分别收集上清和多糖等大分子物质沉淀,沉淀用60℃烘干至恒重。用旋转蒸发器除尽上清中的乙醇,所得粘稠液体为小分子活性产物。
1.2.2.3 小分子活性产物的萃取根据相似相溶的原理,用3种不同极性(乙酸乙酯、正丁醇和石油醚)的有机溶剂对上述JP4-1菌株发酵液中小分子胞外活性产物部分进行萃取:小分子活性产物与乙酸乙酯等体积混合于分液漏斗,剧烈震荡10 min后静置分层,分离有机相,水相反复用乙酸乙酯萃取3次,合并3次萃取所得有机相。上一步中所得水相改用正丁醇重复萃取3次,合并有机相。剩余水相用石油醚以同样的方法萃取3次,合并有机相。旋蒸除尽上述所得各有机相中的有机溶剂。
1.2.3 JP4-1菌株促生活性产物作用的测定 1.2.3.1 水稻幼苗的培育和处理取饱满健康的水稻种子,加水没过水稻种子并于28℃黑暗处24 h,将水稻种子平铺于湿润的滤纸上并用湿润的6层纱布覆盖,置于30℃,催芽48 h,期间保持纱布湿润。取发芽的水稻种子10 g平铺于覆盖纱网并装满Hoagland营养液的塑料烧杯(容积600 mL)中央。于人工气候培养箱培养发芽的水稻种子至两叶期。培养条件:第一阶段:16 h,湿度80%,温度28℃,光照100%;第二阶段:8 h,湿度80%,温度26℃,光照0%。培养过程中,每天补充营养液。水稻幼苗培养5-7 d后,除去其中长势较弱的幼苗,弃尽原有的营养液,尽量使每盆的水稻幼苗的长势、数量相同。用容器总容积5%的菌株活性产物不同部分的溶液作用于水稻幼苗,剩余液体用Hoagland营养液补齐。实验组分组为:A组:胞外产物与胞内产物;B组:胞外小分子产物与大分子产物;C组:乙酸乙酯萃取物、正丁醇萃取物、石油醚萃取物。分别用以上液体处理两叶期水稻幼苗。以容器总容积5%的去离子无菌水处理的水稻幼苗做对照组(CK)。随机摆放于人工培养箱按上述条件继续培养5-7 d,期间每天补充营养液并不断变换每盆幼苗的位置,尽量使其受光均匀。
1.2.3.2 JP4-1菌株促生活性产物作用的测定(1)水稻幼苗生长指标的测定:随机抽取处理后培养7 d的水稻幼苗,测量其株高、根长。分离地上部分与地下部分,80℃烘干至恒重,分别测量水稻幼苗地上部分干重。记录原始数据。(2)水稻幼苗叶绿素含量的测定:取新鲜水稻幼苗叶片0.1 g,剪碎置于10 mL离心管,加入乙醇丙酮(V/V =1∶1)混合液5 mL,黑暗处浸泡24 h后摇匀,为提取液。吸取提取液1 mL加入2 mL乙醇丙酮混合液,混匀。以3 mL乙醇丙酮混合液为空白调零,用分光光度计分别测量470 nm,645 nm,663 nm处的OD值。按如下公式计算水稻幼苗叶绿素的含量:
叶绿素a含量(Ca)(mg/g)=(12.7 × OD663 - 2.69 × OD645)× Vt × 稀释倍数 /FW
叶绿素b含量(Cb)(mg/g)=(22.9 × OD645 - 4.68 × OD663)× Vt ×稀释倍数/FW
叶绿素总量 = Ca + Cb
其中,Vt表示提取液体积(mL),FW表示叶片鲜重(g)。
1.2.4 数据处理与分析将所得数据用SPSS 20.0和Microsoft Excel 2007软件进行整理,统计分析。
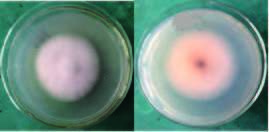
2 结果 2.1 JP4-1菌株的鉴定 2.1.1 JP4-1菌株的形态学特征内生真菌JP4在PSA培养基上平均生长速度为10 mm/d,菌落白色,致密,均匀,潮湿,边缘整齐。菌落背面生长后期会出现红色和黑色色素(图 1)。JP4-1的菌丝在光学显微镜下呈无色,菌丝分枝,有隔,产孢(图 2)。
|
| 图 1 JP4-1 的菌落形态 A:菌落正面;B:菌落背面 |

|
| 图 2 JP4-1 的菌丝形态 A:JP4-1的菌丝形态(100×);B:JP4-1的菌丝形态(400×);C:JP4-1的孢子(400×) |
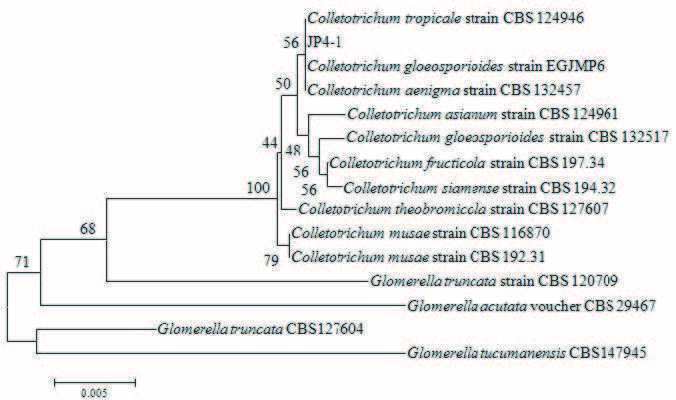
菌株JP4-1的18S rDNA序列经BLAST比对,可鉴定JP4-1菌株为小丛壳属(Glomerella sp.),基因同源相似度达99%。MEGA6.0构建菌株的系统进化树如图 3所示。
|
| 图 3 基于18S rDNA 序列构建的 JP4-1 的系统进化树 |
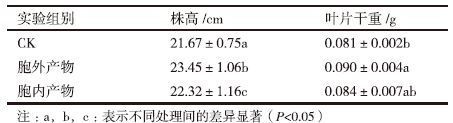
分别用胞外产物溶液和胞内产物溶液处理两叶期水稻幼苗5 d后,分别随机测量10株水稻幼苗的株高和叶片干重。结果(表 1)表明,用胞外产物处理的水稻幼苗株高比对照组提高了8%,干重增加了11.11%。用胞内产物溶液处理的水稻幼苗株高相比对照组仅提高了2%,干重增加了3%,增加不显著。可见,JP4菌株的胞外代谢产物对水稻幼苗的生长指标有一定的促进作用。
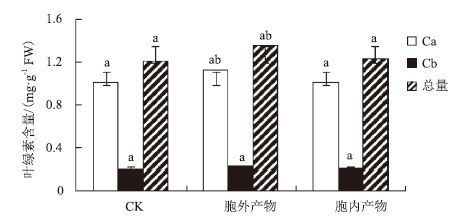
用胞外产物和胞内产物溶液分别处理的水稻幼苗,随机抽取10株幼苗测量470 nm、645 nm、663 nm处的OD值,计算叶绿素a、叶绿素b和叶绿素总量。结果(图 4)表明,胞外产物处理的水稻幼苗叶绿素a和叶绿素总量相对于用无菌去离子水处理的对照组相比提高了10.89%和11.48%,差异显著,胞内产物处理的实验组的叶绿素含量与对照组相比提高不显著。
|
| 图 4 JP4-1 的胞外产物和胞内产物对水稻幼苗叶绿素含量的影响 a,b:表示不同处理间的差异显著(P<0.05) |
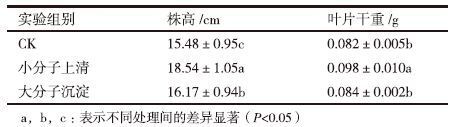
用醇沉法对菌株的胞外代谢产物进一步分离,用分离得到的小分子上清和粗多糖沉淀分别处理水稻幼苗,随机测量10株水稻幼苗的株高和叶片干重,所得结果如表 2所示。其中,小分子产物处理的水稻幼苗与对照(水处理)相比,株高和干重分别提高了19.77%和19.51%;而粗多糖等大分子沉淀物质处理的水稻幼苗株高仅提高了4.46%,叶片干重提高相对于对照组不显著。
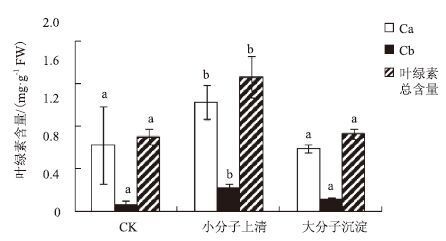
图 5表明,小分子上清液处理的水稻幼苗,其叶绿素a、叶绿素b和叶绿素总量相对于对照组分别提高了64.29%、188.89%和77.5%,差异极显著。而大分子沉淀处理的水稻幼苗各叶绿素含量与对照相比无明显差异。
|
| 图 5 JP4-1 发酵液胞外小分子和胞外大分子对水稻幼苗叶绿素含量的影响 a,b:表示不同处理间的差异显著(P<0.01) |
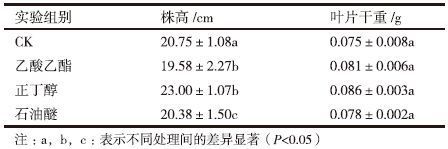
对JP4发酵液的小分子成分用乙酸乙酯、正丁醇和石油醚进一步萃取分离,用所得3种萃取产物处理水稻幼苗后的结果(表 3)表明,乙酸乙酯萃取物和石油醚萃取物处理的水稻幼苗的株高和叶片干重与对照组相比提高不显著,正丁醇萃取物可使水稻幼苗的株高和干重分别提高10.84%和14.67%,促生长作用最为显著。
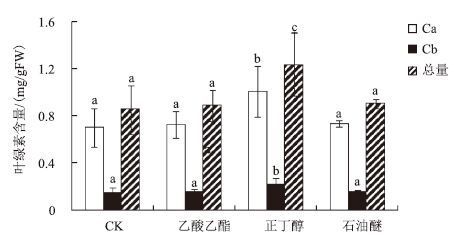
正丁醇萃取物处理后的水稻幼苗,叶绿素a、叶绿素b和叶绿素总含量相比于对照组分别显著提高了43.18%、48.05%和44.22%(图 6),乙酸乙酯萃取物和石油醚萃取物处理后水稻幼苗的叶绿素含量与对照组相比没有显著差异。
|
| 图 6 JP4-1 发酵液小分子上清不同萃取成分对水稻幼苗叶绿素含量的影响 a,b,c:表示不同处理间的差异显著(P<0.05) |
植物内生真菌具有丰富的多样性,广泛分布于宿主植物的各大器官[12]。碱蓬内生真菌JP4-1是从碱蓬叶部分离纯化得到的一种菌群,其分子鉴定为小丛壳属(Glomerella sp.)。团队以往的研究表明,在盘锦红海滩碱蓬组织中,共分离到122株植物内生真菌,共13属;其中,小丛壳菌属占12.9%,共分离到15株,属于碱蓬内生真菌中的主要菌群[13]。这与钮旭光等[14]的调查结果是一致的。
近年来,微生物的活性代谢产物越来越受到广泛的关注,已经成为一种非常重要的微生物资源。利用微生物活性产物制成的微生物生长促进剂,正成为农业环境友好型且能够促进可持续发展的新兴科技手段。目前,黑龙江等农业大省正逐步将微生物菌剂应用于固氮、解磷等农业生产实践,取得了良好的经济效益[15]。但是植物与微生物互作的机制研究仍然较少,多集中于对微生物生长促进剂作用机制的研究。其中,比较多的一种说法是植物内生菌能够分泌植物激素或类似物促进植物生长[16]。王国基等[17]从玉米根际分离到的262株PGPR菌株中,有15株菌株具有分泌IAA的能力,对玉米具有良好的促生长作用。王维[18]分离到的5株半夏内生真菌均可产生一定量的IAA,但是不同菌株间产生的量有一定的差异,并且对宿主植物的促生状况也不相同。本试验以水稻幼苗植株的株高、叶片干重和叶绿素含量作为测量依据讨论了碱蓬内生真菌JP4-1代谢产物的促生活性,测量这些生长参数能够直观反应水稻幼苗的生长状况,叶绿素含量还能反应植物的营养状况和健康状况[19],具有一定的研究意义。研究发现,经过菌株JP4-1胞外发酵产物处理的水稻幼苗生长状况明显优于对照组,叶绿素含量显著提高。说明JP4-1菌株对水稻幼苗具有一定的促生长作用。
通过超声破碎,萃取等手段对JP4的发酵产物进行分离、分析,发现有效的促生长物质为正丁醇的萃取产物,其在株高、干重以及叶绿素总量方面有明显的促进作用。将萃取产物的具体成分利用液相色谱法进行分析,并与植物激素标准样进行比对,目前初步确定含有植物生长素类物质,如细胞分裂素、赤霉素、生长素、脱落酸等植物生长激素成分。这与袁志林[20]的研究结果基本一致。但具体的成分与含量需在后续试验中利用液相色谱、质谱分析和核磁共振技术予以进一步探究。以探讨其具体成分及是否有新型促生物质的存在,从而进行其促生长机制的研究。在本研究水培水稻幼苗过程中发现,利用上清液的各萃取成分分别处理的水稻幼苗长势明显弱于用上清液各种成分混合处理的水稻幼苗,即上清中各成分联合作用的促生效果优于上清萃取后各单一成分的作用效果,其机制如何,有待进一步探究。
4 结论碱蓬内生真菌JP4-1,经rDNA-ITS序列分析鉴定为小丛壳属(Glomerella sp.),其胞外代谢产物作用于水稻幼苗可使幼苗的生长指标和叶绿素含量显著提高,有助于水稻幼苗的生长和有机物的合成。胞外代谢产物中正丁醇的萃取成分为水稻幼苗促生长最有效的活性成分。
| [1] | Stone JK, Bacon CE, White JFJr. An overview of endophytic microbes: endopytism defined[J]. Microbial Endophytes, 2000 : 3–29. |
| [2] | 李玲玉. 植物内生菌Myrothecium roriclum次生代谢产物研究[D]. 扬州: 扬州大学, 2014. |
| [3] | Stierle A, Strobel G, Stierle D, et al. Taxol and taxane productionby Taxus brevifolia. An endophytic fungus of pacific yew[J]. Science, 1993, 260(9): 214–216. |
| [4] | 易晓华. 植物内生真菌次生代谢产物研究进展[J]. 中国农学通报, 2009, 25(21): 255–260. |
| [5] | Soliman SS, Trobacher CP, Tsao R, et al. A fungal endophyte induces transcription of genes encoding a redundant fungicide pathway in its host plant[J]. BMC Plant Biology, 2013, 26: 13–93. |
| [6] | 赵可夫, 范海, 江行玉, 等. 盐生植物在盐渍土壤改良中的作用[J]. 应用与环境生物学报, 2002, 8(1): 31–35. |
| [7] | 任立军. 碱蓬[J]. 特种经济动植物, 2004, (4): 26–27. |
| [8] | 魏磊. 盐碱胁迫角果碱蓬幼苗的蛋白质组学研究[D]. 哈尔滨: 东北林业大学, 2012. |
| [9] | 唐永红, 曹庸, 卢成瑛, 等. 特殊生境微生物及其活性代谢产物研究进展[J]. 微生物学通报, 2006, 33(4): 163–166. |
| [10] | Khan AL, Waqas M, Khan AR, et al. Fungal endophyte Penicillium janthinellum LK5improves growth of ABA-deficient tomato under salinity[J]. World J Microbiol Biotechnol, 2013, 29: 2133–2144. |
| [11] | 赵颖, 于飞, 郭明敏, 等. 碱蓬内生真菌JP3的分离、鉴定及促生作用研究[J]. 沈阳师范大学学报: 自然科学版, 2015, 33(1): 116–120. |
| [12] | 禹乐乐. 玉米内生真菌多样性及其宿主关系研究[D]. 郑州: 郑州大学, 2012. |
| [13] | 赵颖. 碱蓬内生真菌生物多样性及促生活性JP3菌株的研究[D]. 沈阳: 沈阳师范大学, 2015. |
| [14] | 钮旭光, 宋立超, 韩梅, 肖亦农. 盐生植物翅碱蓬的内生真菌多样性分析[J]. 微生物学通报, 2012, 39(10): 1388–1395. |
| [15] | 殷博, 何鑫, 曹亚彬. 黑龙江省微生物肥料现状与问题[J]. 中国环境管理干部学院学报, 2011, 21(1): 49–51. |
| [16] | 袁志林, 戴传超, 杨启银. 微生物源的植物生长促进剂研究的新进展[J]. 土壤肥料, 2004, 6: 41–46. |
| [17] | 王国基. 根际促生专用菌肥研制及其对玉米促生作用的研究[D]. 兰州: 甘肃农业大学, 2014. |
| [18] | 王维. 半夏内生菌的分离及其内生真菌对宿主生长影响的研究[D]. 杨凌: 西北农林科技大学, 2010. |
| [19] | 关丽, 刘湘南, 程承旗. 土壤镉污染环境下水稻叶片叶绿素含量监测的高光谱遥感信息参数[J]. 光谱学与光谱分析, 2009, 10: 2713–2716. |
| [20] | 袁志林. 一株广谱内生真菌B3对水稻生长及生理影响研究[D]. 南京: 南京师范大学, 2005. |