2. 中国科学院北京基因组研究所,北京 100101
2. Beijing Institute of Genomics, Chinese Academy of Sciences, Beijing 100101
磷脂酰肌醇蛋白聚糖是硫酸乙酰肝素糖蛋白中的一个家族,参与调控个体发育、细胞增殖和分化等过程[1-3]。有研究表明,Glypican-3与多种肿瘤的发生发展关系密切,特别是在肝细胞癌中特异性高表达,是一种潜在的肝癌血清学和组织学重要诊断标志物[4-12]。另外,近期的研究表明GPC3不但能够用于肝癌的诊断,而且具有抑制肝癌细胞系生长的功能[13],该发现为肝癌的特异性治疗提供了新的思路。
本研究利用真核表达载体和脂质体转染技术,获得了稳定表达Glypican-3的单克隆细胞系。通过大量培养、细胞破碎和亲和纯化,获得了一定数量的GPC3蛋白,为进一步研究GPC3的分子生物学特性和功能奠定了良好的基础。
1 材料与方法 1.1 材料 1.1.1 细胞、菌株与质粒含GPC3基因的质粒由德国洪堡大学病理学研究所Lage博士惠赠;克隆菌株E.coli DH5α购自北京全式金生物技术有限公司;克隆载体pMD18-T购自宝生物公司;人胚胎肾细胞HEK293购自国家实验细胞共享平台;表达载体p3XFLAG-CMV-14购自Sigma公司。
1.1.2 主要试剂限制性内切酶EcoRΙ和BamHΙ、T4连接酶、Pfu DNA聚合酶均购自New England Bio-labs公司;DNA分子质量标准和凝胶回收试剂盒购自QIAGEN公司;蛋白质分子量标准购自美国热电公司;LipofectamineTM2000转染试剂购自美国Life公司;ANTI-FLAG® M1 Agarose Affinity Gel及ANTI-FLAG抗体购自Sigma公司;兔抗人GPC3蛋白和兔抗人β-actin抗体购自美国ABcom公司;辣根过氧化物酶(HRP)标记羊抗鼠IgG抗体购自北京华美公司;细胞培养板、DMEM培养基,胎牛血清,均购自美国GIBCO公司。
1.2 方法 1.2.1 目的基因的克隆根据GPC3的基因阅读框序列设计扩增引物,上游引物:5'-CGGAATTCCTT-GGTGGTGGCGATGCT-3'(下划线部分为EcoR Ι酶切位点);下游引物:5'-CGGGATCCCCCGAGGTTG-TGAAAGGT-3'(下划线部分为BamH Ι酶切位点)。使用上述引物,以含GPC3基因的质粒为模板进行PCR扩增。PCR扩增条件:95℃预变性5 min;95℃变性60 s,60℃退火60 s,72℃延伸2 min,共35个循环;72℃延伸15 min。将PCR产物进行琼脂糖凝胶电泳检测。
1.2.2 重组质粒pMD18-gpc3的构建及鉴定将PCR产物经琼脂糖凝胶电泳后切胶回收,连入pMD18-T载体,产物用T4连接酶在16℃水浴中连接。将连接产物转化至E.coli DH5α菌株,筛选阳性克隆,获得重组表达质粒pMD18-gpc3。
1.2.3 重组质粒pCMV-gpc3的构建及鉴定将质粒pMD18-gpc3和质粒p3XFLAG-CMV-14分别用EcoR Ι和BamH Ι双酶切,产物经琼脂糖凝胶电泳后切胶回收。取含有酶切位点的目的基因和经双酶切的p3XFLAG-CMV-14用T4连接酶在16℃水浴中连接。将连接产物转化至E.coli DH5α菌株,筛选阳性克隆,获得重组表达质粒pCMV-gpc3。
1.2.4 HEK293细胞的培养HEK293细胞培养于37℃、5% CO2培养箱中,培养基为含10%胎牛血清的DMEM高糖培养基。待细胞密度达到90%时,用0.05%胰蛋白酶进行消化传代,传代比例为1∶3。
1.2.5 重组质粒转染将状态良好的HEK293细胞以5×105个/孔的密度接种于6孔板中,继续培养,待细胞密度达到80%-90%时进行转染。用PBS冲洗3次,加入无血清DMEM高糖培养基。按照LipofectamineTM2000转染试剂说明书进行,转染时设立阴性组(p3XFLAG-CMV-14)和阳性组(pCMV-gpc3质粒)。细胞转染48 h后用含有0.5 mg/L G418、10%胎牛血清的DMEM高糖培养基加压筛选,采用有限稀释法原理将细胞转至96孔板,每孔1-2个细胞。待96孔板内细胞增殖成团后,传至细胞培养瓶继续培养,最终得到稳定表达重组蛋白的单克隆细胞株pCMV-gpc3/293和阴性对照组pCMV-gpc3/NC。
1.2.6 Westernblot检测转染后GPC3蛋白表达水平 待稳定表达重组蛋白的细胞株和HEK293细胞生长至密度约90%时,收集细胞,裂解细胞提取细胞总蛋白,提取方法按照试剂盒说明书进行。BCA法测定蛋白浓度后,取适量蛋白进行SDS-PAGE电泳,参照文献[14]的方法进行。
电泳结束后以恒压90 V,利用半干转移设备将蛋白转移至PVDF膜上;将转好的膜浸入封闭液(含5%(M/V)脱脂奶粉的TBST中,室温轻摇封闭2 h;以购买的兔抗人GPC3蛋白抗体、兔抗人β-actin和ANTI-FLAG抗体为一抗,用封闭液按1∶1 000稀释,室温轻摇孵育2 h;TBST洗膜4次,每次孵育10 min;以HRP标记的羊抗兔IgG为二抗,用封闭液按1∶10 000稀释,室温轻摇孵育1 h;TBST洗膜4次,每次孵育10 min;ECL发光显色系统显色。
1.2.7 重组蛋白的分离纯化及验证大量培养筛选到的单克隆细胞,参照文献[14]的方法对细胞进行破碎,低温离心取上清液按照ANTI-FLAG® M1 Agarose Affinity Gel试剂盒说明书进行纯化。采用超滤的方法浓缩重组蛋白,取适量蛋白进行SDS-PAGE电泳,Western blot检测重组蛋白。
2 结果 2.1 GPC3基因的扩增用PCR方法进行扩增。扩增产物经1.2%琼脂糖凝胶电泳检测,其中以无菌水为模板的阴性对照组没有出现扩增条带,而以含GPC3基因的质粒为模板,扩增到了一条长1 650 bp的片段,结果(图 1)与预期大小相一致。
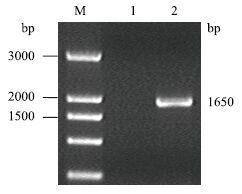
|
| 图 1 GPC3基因PCR扩增结果 M:3 000 bp DNA分子量标准;1:阴性对照;2:GPC3基因PCR产物 |
构建的重组质粒pMD18-gpc3和表达质粒pCMV-gpc3进行EcoR Ι和BamH Ι双酶切,产物经1%琼脂糖凝胶电泳检测,结果(图 2)与预期大小相一致。质粒pCMV-gpc3经测序鉴定,测序结果表明插入片段与GenBank中公布的全序列中该片段完全一致,且以正确的方向插入到表达载体的克隆位点,真核表达载体质粒pCMV-gpc3构建成功。

|
| 图 2 重组质粒酶切鉴定结果 M:10 000 bp DNA 分子量标准;1:重组质粒pMD18-gpc3;2:重组质粒pMD18-gpc3的EcoRΙ和BamHΙ双酶切产物;3;重组质粒pCMV-gpc3;4:重组质粒pCMV-gpc3的EcoRΙ和BamHΙ双酶切产物 |
以购买商业化兔抗GPC3多抗、兔抗人β-actin多抗和ANTI-FLAG抗体为一抗,进行Western blot分析鉴定,结果见图 3。在阳性细胞株pCMV-gpc3/293的总蛋白提取液中,无论是用兔抗GPC3多抗还是兔抗FLAG多抗,结果中都可以看到在65 kD左右的位置上有带,而阴性细胞株pCMV-gpc3/NC总蛋白则没有任何显色带出现,表明阳性细胞株pCMV-gpc3/293成功表达出GPC3蛋白。同时作为参照,阳性细胞株和阴性细胞株的β-actin蛋白表达基本一致。

|
| 图 3 GPC3蛋白表达Western blot分析 1:阴性组 pCMV-gpc3/NC(一抗为兔抗FLAG多抗);2:阴性组 pCMV-gpc3/NC(一抗为兔抗GPC3多抗);3:阳性组 pCMV-gpc3/293(一抗为兔抗FLAG多抗);4:阳性组 pCMV-gpc3/293(一抗为兔抗GPC3多抗) |
将经过纯化及浓缩的重组蛋白及细胞破碎产物进行SDS-PAGE电泳,结果见图 4。由于真核细胞表达外源蛋白的水平较低,为了获得一定量的重组蛋白,本研究大量培养细胞,从1014个细胞中提取纯化到0.1 mg重组蛋白,鉴于得率太低,研究组计划优化培养条件,以获得更高的得率和重组蛋白。从图 4中可以看出,经过纯化及浓缩后,得到了一个分子量约为65 kD的蛋白条带,与Western blot检测一致(图 5)。
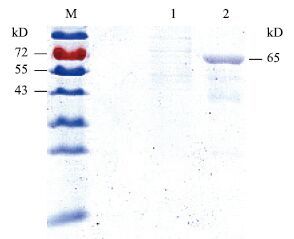
|
| 图 4 纯化后GPC3蛋白SDS-PAGE电泳分析 M:蛋白质分子量标准;1:细胞总蛋白;2:经亲和柱纯化后产物 |

|
| 图 5 纯化后GPC3蛋白Western blot分析 M:蛋白质分子量标准;1:纯化浓缩后重组GPC3蛋白 |
目前,我国恶性肿瘤已经排在居民主要疾病死亡率的首位,成为影响人们健康的头号杀手。统计数据表明2010年全国恶性肿瘤发病率为235.23/10万。其中,肝癌(特别是原发性肝细胞癌)的死亡率仅次于胃癌,已经成为我国的第二大癌症[15]。发现并确定新的肝癌早期诊断、治疗靶点具有重要的科学意义和临床价值[16, 17]。最近,磷脂酰肌醇蛋白聚糖3作为一种新的肝癌肿瘤标志物被国内外研究人员提出。研究人员发现GPC3在多个肿瘤组织中特异表达,特别是在肝癌中的特异性高表达,使我们看到了其成为继AFP后又一个肝癌肿瘤标志物的前景。
Shirakawa等[18]利用免疫组化的方法对3种原发性肝癌(hepatocellular carcinoma HCC,intrahepatic cholangiocarcinoma ICC,combined hepatocellular and cholangiocarcinoma CHC)组织中的GPC3蛋白表达情况进行了分析,发现ICC病例组织中不表达GPC3蛋白,CHC病例中部分表达GPC3蛋白,而在HCC病例组织中大量表达78.3%(36/46),所以作者最终得出GPC3蛋白对于HCC具有特异性的结论。付顺军等[19]利用酶联免疫和化学发光的方法,对健康者、肝硬化患者和肝癌确诊病例血清中的GPC3和AFP含量进行了测定,发现健康者和肝硬化患者血清中的GPC3浓度无统计学差异。而肝癌患者血清中的GPC3浓度与健康者和肝硬化患者血清有显著的差异,表明GPC3对肝癌有较高的敏感性和特异性。当GPC3以3 μg/L,AFP以20 μg/L为诊断界限时,GPC3的敏感性要高于AFP。Akutsu等[20]利用商品化的ELISA试剂盒检测血清中的GPC3含量,发现健康者和乙肝患者的含量均低于阈值,HCC患者中有50%(32/64)的含量高于阈值,HCC的平均含量明显高于非HCC。
为了探究GPC3与肝癌的关系,获得具有自主知识产品的抗GPC3抗体,进而开发肝癌早期诊断方法,本研究成功构建了真核表达载体pCMV-gpc3。经过脂质体转染,得到能够稳定表达GPC3的细胞株。最终通过高效表达、提取和纯化等过程获得了一定量纯度较好的重组GPC3蛋白。选用真核表达载体p3XFLAG-CMV-14及HEK293细胞宿主是因为GPC3是一个糖蛋白,只有在真核细胞中进行表达,才能够最接近于其天然的状态。目前,已经有多个研究小组利用HEK293细胞无基础性表达GPC3的特性进行GPC3的相关研究[21, 22],同时p3XFLAG-CMV系统是一种高效的真核表达系统,该系统具有高效的强启动子CMV启动子,有利于目的蛋白的高效表达。并且表达的蛋白中含FLAG标签,利用FLAG亲和纯化层析柱,能够对表达产物进行纯化,且纯度非常高,有利于后续实验的进行。
4 结论本研究成功构建了真核表达载体pCMV-gpc3。经过脂质体转染,得到能够稳定表达GPC3的细胞株。最终通过高效表达、提取和纯化等过程获得了一定量纯度较好的重组GPC3蛋白。
| [1] | Filmus J. Glypicans:proteoglycans with a surprise[J]. Glycobiology, 2001, 11(3): 19–23. |
| [2] | 蒋虹. GLYPICAN-3基因在非小细胞肺癌中的表达与意义[D]. 上海:第二军医大学, 2004. |
| [3] | Pilia G, Hughes-Benzie RM, MacKenzie A, et al. Mutations in GPC3, a glypican gene, cause the Simpson-Golabi-Behmel overgrowth syndrome[J]. Nat Genet, 1996, 12(3): 241–247. |
| [4] | Huber R, Crisponi L, Mazzarella R, et al. Analysis of exon/intron structure and 400 kb of genomic sequence surrounding the 5'-promoter and 3'-terminal ends of the human glypican 3(GPC3)gene[J]. Genomics, 1997, 45(1): 48–58. |
| [5] | Huber R, Mazzarella R, Chen CN, et al. Glypican 3 and glypican 4 are juxtaposed in Xq26.1[J]. Gene, 1998, 225(1-2): 9–16. |
| [6] | Veugelers M, De Cat B, Ceulemans H, et al. Glypican-6, a new member of the glypican family of cell surface heparan sulfate proteoglycans[J]. J Biol Chem, 1999, 274(38): 26968–26977. |
| [7] | Nakatsura T, Yoshitake Y, Senju S, et al. Glypican-3, overexpressed specifically in human hepatocellular carcinoma, is a novel tumor marker[J]. Biochem Biophys Res Commun, 2003, 306: 16–25. |
| [8] | Capurro M, Wanless IR, Sherman M, et al. A novel serum and histochemical marker for hepatocellular carcinoma[J]. Gastroenterology, 2003, 125(1): 89–97. |
| [9] | Shirakawa H, Suzuki H, Shimomura M, et al. Glypican-3 expression is correlated with poor prognosis in hepatocellular carcinoma[J]. Cancer Sci, 2009, 100(8): 1403–1407. |
| [10] | Tangkijvanich P, Chanmee T, Komtong S, et al. Diagnostic role of serum glypican-3 in differentiating hepatocellular carcinoma from non-malignant chronic liver disease and other liver cancers[J]. J Gastroenterol Hepatol, 2010, 25(1): 129–137. |
| [11] | Filmus J, Capurro M. Glypican-3:a marker and a therapeutic target in hepatocellular carcinoma[J]. FEBS J, 2013, 280(10): 2471–2476. |
| [12] | 程华, 方向东, 吴萌, 等. 磷脂酰肌醇蛋白聚糖3的原核表达及单克隆抗体制备[J]. 生物技术通报, 2014, (3): 177–181. |
| [13] | Feng M Q, Kim H, Phung Y, et al. Recombinant soluble glypican 3 protein inhibits the growth of hepatocellular carcinoma in vitro[J]. Int J Cancer, 2011, 128(9): 2246–2247. |
| [14] | 奥斯伯F, 布伦特R, 颜子颖, 等. 精编分子生物学实验指南[M]. 北京: 科学出版社, 2001. |
| [15] | 陈万青. 2014中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2014. |
| [16] | Torre L, Siegel R, Jemal A. Global Cancer Facts & Figures[M]. America: American Cancer Society, Inc, 2015.4-20. |
| [17] | Torre L, Bray F, Siegel R, et al. Global Cancer Statistics, 2012[J]. Ca Cancer J Clin, 2015, 65: 87–108. |
| [18] | Shirakawa H, Kuronuma T, Nishimura Y, et al. Glypican-3 is a useful diagnostic marker for a component of hepatocellular carcinoma in human liver cancer[J]. Int J Oncol, 2009, 34(3): 649–656. |
| [19] | 付顺军, 李绍强, 林杰, 等. 血清磷脂酰肌醇蛋白聚糖3蛋白在干细胞癌诊断中的价值[J]. 中华普通外科学文献, 2010, 4(6): 553–556. |
| [20] | Akutsu N, Yamamoto H, Sasaki S, et al. Association of glypican-3 expression with growth signaling molecules in hepatocellular carcinoma[J]. World J Gastroenterol, 2010, 16(28): 3521–3528. |
| [21] | Capurro M, Xiang YY, Lobe C, et al. Glypican-3 promotes the growth of hepatocellular carcinoma by stimulating canonical wnt signaling[J]. Cancer Res, 2005, 65(14): 6245–6254. |
| [22] | Lee YL, Ahn BC, Lee YJ, et al. Targeting of hepatocellular carcinoma with glypican-3-targeting peptide ligand[J]. Journal of Peptide Science, 2011, 17(11): 763–769. |



