腺苷酸转移酶(Adenine nucleotide translocase,ANT)属于真核细胞线粒体内膜上的转运蛋白家族成员[1-3],作为代谢物载体参与线粒体的各种活 动[2, 4, 5]。ANT在线粒体内膜上分布最为丰富,约占细胞线粒体总蛋白的1%-10%[6],其主要功能是催化细胞质中ADP和线粒体内ATP间进行跨膜交换,是保持细胞内能量平衡的关键成分[7]。近年来的研究表明,ANT 在线粒体内膜的穿膜孔洞的形成和细胞凋亡诱导过程中起重要作用[8-10],是各种细胞凋亡因子或凋亡抑制因子的作用靶位[11-14]。生物体大约1/3-1/2的基础电子传递由ANT催化,它是保持细胞内能量代谢的关键蛋白[15, 16],另也有研究表明,ANT 参与了肿瘤坏死因子诱导的细胞凋亡[17]。
ANT 蛋白通过两个分别含有ATP/ADP 结合位点的亚基的构象变化来实现细胞质中ADP和线粒体内ATP 间的跨膜交换[18],是生物体内能量产生和消耗的重要连接[19]。大多数真核生物至少有2个不同的ANT基因[16],目前已从凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)、拟穴青蟹(Scylla paramamosain)等甲壳动物中克隆到其同源基因,它们在进化上高度保守。但至今尚未见三疣梭子蟹ANT基因的相关报道。
三疣梭子蟹(Portunus trituberculatus)是我国沿海的重要经济蟹类,蜕皮是甲壳动物蜕去旧的外骨骼,个体增大后新甲壳迅速硬化为外骨骼的过程。但是,到目前为止,对其蜕皮发生的机制仍然不是很清楚,特别是其蜕皮周期的分子调控机理。因此,本研究克隆了三疣梭子蟹ANT的cDNA序列,并对其组织差异表达和蜕皮周期中的表达变化进行了分析,旨在对阐明三疣梭子蟹蜕皮的分子调控机理提供一定的基础数据。
1 材料与方法 1.1 材料实验取材的三疣梭子蟹暂养于宁波市宁海县得水育苗场。采用形态观察法将三疣梭子蟹的蜕皮周期分为蜕皮后期(A期和B期)、蜕皮间期(C期)、蜕皮前期(D0、D1、D2、D3和D4亚期)和蜕皮期(E期)4个阶段[20]。解剖取C期三疣梭子蟹大颚器、Y器、肌肉、脑、心脏、眼柄、胸神经节、肠、表皮和肝胰腺用于组织表达差异性分析,采集各期(除E期外)三疣梭子蟹肌肉组织进行蜕皮周期中ANT基因的表达差异变化分析。蜕皮周期各期均选取4只螃蟹做平行实验,由于E期的时间较短不利于采集到适合做统计分析的样本,故只采集了其他各期的样本。解剖获得的新鲜组织暂时浸泡于RNA保护液(生工生物工程(上海)有限公司)中,置于-20℃暂存。
1.2 方法 1.2.1 总RNA的提取将保存在RNA保护液中的样品转移至Trizol(生工生物工程(上海)有限公司)溶液中,按说明书所述步骤提取各个样品中的总RNA。
1.2.2 cDNA的合成取Ms组织提取的总RNA,按照PrimeScriptRT reagent Kit(Perfect Real Time,TaKaRa)试剂盒说明书步骤,反转录得到第一链cDNA。3'-RACE扩增所需的3'-RACE-cDNA以AP (表 1)为接头引物,参照上述方法反转录获得;5'-RACE扩增所需的5'-RACE-cDNA按照SMARTerTMRACE cDNA Amplification Kit试剂盒说明书合成。cDNA均置于-20℃下保存备用。
根据NCBI已公布的甲壳动物ANT核苷酸序列,利用primer5.0软件设计并筛选出一对引物ANT-F,ANT-R(表 1)。以第一链cDNA为模板,进行PCR扩增(体系为25 μL,扩增条件:95℃预变性5 min;95℃ 50 s,57℃ 50 s,72℃ 50 s,34个循环;72℃充分延伸5 min,反应结束)。扩增产物经过电泳、琼脂糖凝胶回收并纯化,与pMD18-T载体连接再转入E.coli DH5α感受态细胞。经过菌落PCR检测后挑选阳性克隆菌落,扩大培养后将菌液送至生工生物工程(上海)有限公司测序。
1.2.4 三疣梭子蟹ANT基因3'RACE和5' RACE的扩增根据已测得的核心序列和AP接头分别设计特异性引物ANT-3F1、ANT-3F2、ANT-3F3和3'outer、3'inner(表 1),进行巢氏PCR扩增。第一轮PCR以3'RACE-cDNA为模板,ANT-3F1、ANT-3F2和3'outer为上下游引物进行PCR扩增(体系为25 μL,扩增条件:95℃预变性5 min;95℃ 50 s,56℃ 50 s,72℃ 50 s,34个循环;72℃充分延伸5 min,反应结束)。第二轮以第一轮扩增产物为cDNA模板,ANT-3F2、ANT-3F3和3'inner为上下游引物进行PCR扩增(体系为25 μL,扩增条件:95℃预变性5 min;95℃ 50 s,57℃ 50 s,72℃ 50 s,34个循环;72℃充分延伸5 min,反应结束)。
3'RACE产物的测序结果,按照SMARTerTM RA-CE cDNA Amplification Kit 说明合成5' RACE-cDNA并设计下游特异性引物ANT-5R1、ANT-5R2、ANT-5R3,以5'outer、5'inner(表 1)为上游引物,同理进行两轮PCR扩增。后续操作参照1.2.3。
1.2.5 序列分析利用Vector NTI 10.0测序软件将核心序列和3'RACE和5'RACE的测序结果进行拼接,获得三疣梭子蟹ANT基因的cDNA全长。利用NCBI 在线ORF Finder工具确定ANT基因的开放阅读框(ORF)序列,并翻译成氨基酸序列;利用ClustalX软件将该氨基酸序列与已公布的ANT氨基酸序列进行同源性比对分析,并用MEGA 4.0软件构建系统进化树;利用ExPASy Proteomics Server(http://ca.expasy.org/)所提供的ProtParam tool蛋白质分析软件分析氨基酸序列;使用Signal 3.0 Server(http:// www.cbs.dtu.dk/services/SignalP)预测信号肽,TMHMM在线工具(http://www.cbs.dtu.dk/services/TMHMM/)预测氨基酸跨膜区域。
1.2.6 实时荧光定量(qRT-PCR)取需要的组织利用与1.2.1相同的 Trizol 法抽取总RNA后,取1.0 μg RNA用 PrimeScript Rtreagent Kit(Perfect Real Time)试剂盒反转录得到cDNA。根据 ANT cDNA 全长设计一对特异性引物ANTYG-F1和ANTYG-F2(表 1)检测ANT基因在不同组织中的表达量,以β-actin作为内参。qRT-PCR的反应条件:95℃ 2 min;95℃ 5 s,55.3℃ 20 s,68℃ 20 s,共40个循环;95℃ 15s,55℃ 15 s,升温25 min,95℃ 15 s。用SPSS17.0统计分析软件对获得的数据进行分析。
2 结果 2.1 三疣梭子蟹ANT基因cDNA全长与序列分析基于ANT基因的同源核苷酸序列,利用primer5.0设计两对引物ANT-F和ANT-R进行PCR克隆得到1 091 bp的核心序列。3'RACE 以ANT-3F1、ANT-3F2、ANT-3F3和3'outer、3'inner为引物,扩增获得903 bp的3'端片段;5'RACE以ANT-5R1、ANT-5R2、ANT-5R3和5'outer、5'inner为引物,扩增得535 bp的5'端片段。通过拼接后获得总长为1 414 bp的ANT序列cDNA全长,GenBank登录号:KM921660。5'端非编码区为132 bp,3'端非编码区为352 bp,开放阅读框(ORF)长度为930 bp,编码309个氨基酸。利用ExPASy网站在线ProtParam tool预测其分子式为C4185H6958N1414O1752S351,分子量大小约为116 368.7 Da,预测等电点为4.98,富含Gly(27.9%)、Cys(24.8%)、Thr(23.8%)、和Ala(23.5%)等。不稳定系数为42.42,说明三疣梭子蟹ANT蛋白并不稳定。该氨基酸亲水性总和GRAVY(Grand average of hydropathicity)为0.765,属于亲水性蛋白。
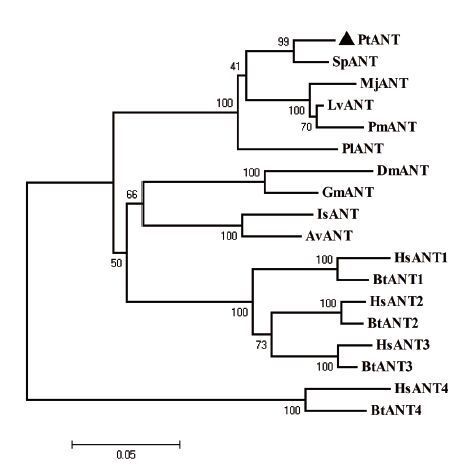
在线Signal软件(http:// www.cbs.dtu.dk/services/SignalP)对其编码区氨基酸序列进行分析,未发现有信号肽,说明三疣梭子蟹ANT不属于分泌蛋白。在线TMHMM工具分析发现该氨基酸序列没有跨膜结构。NCBI在线Conserved Domain Search工具对氨基酸序列进行结构域分析,发现ANT蛋白具有3个重复的同源的线粒体跨膜结构域,分别在第148-441位、466-756位、754-1044位(图 1)。在NCBI上将该序列编码区氨基酸序列进行BLAST搜索比对,BLAST结果发现,与已公布的其他物种ANT氨基酸序列相比,PtANT与拟穴青蟹(S. paramamosain)的ANT一致性最高,达到96%,与凡纳滨对虾(L. vannamei)、斑节对虾(P. monodon)和日本囊对虾(M. japonicus)的ANT也均达到90%左右,与昆虫和脊椎动物的ANT也有较高的一致性,达到68%以上(图 2)。从NCBI蛋白序列数据库中选取具有代表性的甲壳动物、昆虫和脊椎动物ANT氨基酸序列,用MEGA 4.0软件的邻位法(Neighbor-Joining)构建系统进化树,设置重复次数(Replications)为1 000。从进化树结果(图 3)来看,三疣梭子蟹与拟穴青蟹亲缘关系最近,而后与凡纳滨对虾、斑节对虾、日本囊对虾等甲壳动物聚为一支;肩突硬蜱(Ixodes scapularis)、黑腹果蝇(Drosophila melanogaster)等昆虫聚为一大支后与脊椎动物的ANT1、ANT2、ANT3三种亚型聚为一大支,最后脊椎动物的ANT4亚型单独聚为一支,符合生物进化上的地位关系。

|
| 图 1 三疣梭子蟹ANT全长cDNA核苷酸序列和编码区氨基酸序列 起始密码子和终止密码子用粗体和下划线标出,方框内为蛋白序列的线粒体穿膜结构域 |

|
| 图 2 三疣梭子蟹与其它物种ANT氨基酸序列多重比对结果 黑色阴影:相同序列;灰色阴影:相似序列。Portunus trituberculatus(PtANT,KM013803);Scylla paramamosain(SpANT,AHC54390.1);Penaeus monodon(PmANT,AFK93891.1);Drosophila melanogaster(DmANT,Q26365.4);Homo sapiens(HsANT4,P12235.4);Homo sapiens(HsANT4,P05141.7);Homo sapiens(HsANT4,P12236.4);Homo sapiens(HsANT4,Q9H0C2.1 |
|
| 图 3 三疣梭子蟹ANT氨基酸序列系统进化树 PtANT(Portunus trituberculatus,KM013803);SpANT(Scylla paramamosain,AHC54390.1);MjANT(Marsupenaeus japonicus,ABN04118.1);LvANT(Litopenaeus vannamei,AEK78307.1);PmANT(Penaeus monodon,AFK93891.1);PlANT(Pacifastacus leniusculus,ABI34072.1);DmANT(Drosophila melanogaster,Q26365.4);GmANT(Glossina morsitans morsitans,ADD19336.1);IsANT(Ixodes scapularis,AAY66852.1);AvANT(Amblyomma variegatum,DAA34568.1);BtANT1(Bos Taurus,P02722.3);BtANT2(Bos Taurus,Q8SQH5.3);BtANT3(Bos Taurus,P32007.3);BtANT4(Bos Taurus,Q2YDD9.1);HsANT4(Homo sapiens,P12235.4);HsANT4(Homo sapiens,P05141.7);HsANT4(Homo sapiens,P12236.4);HsANT4(Homo sapiens,Q9H0C2.1) |
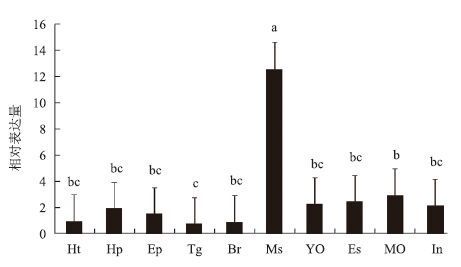
采用荧光定量PCR检测了三疣梭子蟹ANT基因在心脏、肝胰腺、表皮、胸腺神经节、脑、肌肉、Y器、眼柄、大颚器和肠共10个组织中的表达相对量。结果(图 4)显示,该基因在肌肉(Ms)中的表达量最高(P<0.05),大颚器等9种组织中的表达量均较低。
|
| 图 4 ANT基因在三疣梭子蟹各组织中的相对表达水平 Ht:心脏;Hp:肝胰腺;Ep:表皮;Tg:胸腺神经节;Br:脑;Ms:肌肉;YO:Y器;Es:眼柄;MO:大颚器;In:肠。不同小写字母表示各组织表达水平有显著差异(P<0.05) |
组织表达结果显示,ANT基因在三疣梭子蟹Ms中表达量最高,所以选择Ms为实验材料进行ANT基因在蜕皮周期中的表达水平变化分析。qRT-PCR的结果(图 5)表明三疣梭子蟹Ms中的ANT基因在整个蜕皮周期中均有表达,在蜕皮A期最高,降低至C期最低,再逐渐升高在D1期达到第二个小高峰,随后又逐渐下降,最终在D4期降至最低。

|
| 图 5 Ms中ANT基因在三疣梭子蟹蜕皮周期中的相对表达差异 A、B:蜕皮后期;C:蜕皮间期;D0、D1、D2、D3和D4:蜕皮前期各亚期;不同小写字母表示各蜕皮周期各期表达水平有显著差异(P<0.05) |
线粒体是细胞内主要的ATP生产中心,ANT在催化细胞质中ADP和线粒体内ATP进行跨膜交换时起着重要的作用,是保持细胞内能量平衡的关键成分。本实验克隆得到了三疣梭子蟹ANT的全长cDNA序列(PtANT),该序列全长1 414 bp,包含一个930 bp的开放阅读框(ORF),编码309个氨基酸。PtANT主要由3个同源的线粒体跨膜结构域组成,分别在其第6-104位、113-209位和208-305位,每个结构域含2个跨膜区。这与目前已知许多物种的腺苷酸转移酶具有相似的结构功能域。BLAST结果发现,与已公布的其他物种ANT氨基酸序列相比,PtANT与拟穴青蟹的ANT一致性最高,达到96%,与凡纳滨对虾、斑节对虾和日本囊对虾的ANT也均达到90%左右,与昆虫和脊椎动物的ANT也有较高的一致性,达到68%以上。该结果表明各物种间的ANT具有良好的一致性,各物种ANT可能具有相似的功能。值得注意的是,进化树结果显示哺乳动物的ANT4单独聚为一大支,而其他ANT亚型则与甲壳及昆虫的ANT聚在一起,这说明本研究克隆得到的PtANT以及现有甲壳动物及昆虫的ANT应该不属于ANT4,但PtANT究竟属于其他一种ANT还有待进一步研究。
组织表达结果显示PtANT在三疣梭子蟹各个组织中均有表达,其在肌肉中表达量最高,显著高于其他各个组织。这可能与肌肉对线粒体提供的能量需求较大有关,再一次表明了ANT在保持细胞内能量平衡时的重要作用。该结果与孙文文等[20]在研究斑节对虾ANT(PmANT)的结果相似。但斑节对虾中PmANT在心脏中也有很高的表达,拟穴青蟹的ANT也在心脏中表达量最高,而本研究中PtANT在心脏中表达水平较低,这表明本研究克隆获得的PtANT与斑节对虾及拟穴青蟹的ANT在功能上可能并不一致。
肌肉中的ANT基因在三疣梭子蟹蜕皮周期中的表达也有所差异。三疣梭子蟹ANT在蜕皮A期转录水平最高,这可能与三疣梭子蟹刚完成蜕皮过程有关。三疣梭子蟹蜕皮时肌肉消耗了大量能量;另一方面在蜕皮后仍需要继续吸水增大体积[21],还要消耗较多的能量,腺苷酸转移酶的表达量也就相对较高。而在蜕皮间期(C期),三疣梭子蟹体内的含水量下降,营养物质开始积累,为下一次的蜕皮做物质准备,此时因为新表皮还没有形成,能量消耗较少,所以ANT的表达量最低。D0期时,新壳开始分泌但还未成形,ANT的表达量开始逐渐升高,并保持在一个较高水平,从D1到D3,都处于新壳在不断分泌的过程,所以腺苷酸转移酶的相对表达量都较C期有所升高,为新表皮的生成提供所需的能量。
4 结论本研究克隆了三疣梭子蟹ANT基因的cDNA全长,其氨基酸序列与拟穴青蟹的同源性最高。该基因在三疣梭子蟹心脏、肝胰腺、表皮、胸腺神经节、大脑、肌肉、Y器、眼柄、大颚器、肠组织中均有表达,在肌肉组织中的表达量最高。ANT基因在蜕皮后期A期中表达量最高,在蜕皮间期C期中表达量最低。说明ANT基因可能在蜕皮周期的能量转运中起着重要的作用。
| [1] | Monica S, Cecilia L, Cecilia S. The evolution of the adenine nucleotide translocase family[J]. Gene, 2004, 333: 51–59. |
| [2] | Bof M, Brandolin G, Satre M, et al. The mitochondrial adenine nucleotide translocator from Dictyostelium discoideum, functional characterization and DNA sequencing[J]. Eur J Biochem, 1999, 259(3): 795–800. |
| [3] | Martin DB, Julian LP, Augustine O, et al. The basal proton conductance of mitochondria depends on adenine nucleotide translocase content[J]. Biochem J, 2005, 392: 352–362. |
| [4] | Santamaria M, Lanave C, Saccone C. The evolution of the adenine nucleotide translocase family[J]. Gene, 2004, 333: 51–59. |
| [5] | Brand MD, Pakay JL, Ocloo A, et al. The basal proton conductance of mitochondria depends on adenine nucleotide translocase content[J]. Biochemical Journal, 2005, 392: 353–362. |
| [6] | Niu BL, Weng HB, He LH, et al. Cloning and analysis of adenine nucleotide translocase gene in Helicoverpa armigera[J]. Hereditas, 2008, 30(1): 81–86. |
| [7] | Atlante A, Bobba A, De Bari L, et al. Caspase-dependent alteration of the ADP/ATP translocator triggers the mitochondrial permeability transition which is not required for the low-potassium-dependent apoptosis of cerebellar granule cells[J]. J Neurochem, 2006, 97(4): 1166–1181. |
| [8] | Walther T, Tschöpe C, Sterner-Kock A, et al. Accelerated mitochon-drial adenosine diphosphate/adenosine triphosphate transport impr-oves hypertension-induced heart disease[J]. Circulation, 2007, 115(3): 333–344. |
| [9] | Halestrap A. Biochemistry:a pore way to die[J]. Nature, 2005, 434: 578–579. |
| [10] | Kantrow SP, Tatro LG, Piantadosi CA. Oxidative stress and adenine nucleotide control of mitochondrial permeability transition[J]. Free Radical Biology and Medicine, 2000, 28(2): 251–260. |
| [11] | Garcia N, Mart Nez-abundis E, Pav NN, et al. Copper induces permeability transition through its interaction with the adenine nucleotide translocase[J]. Cell Biological International, 2007, 31(9): 893–899. |
| [12] | Monkkonen H, Auriola A, Lehenkari P, et al. Anew endogenous ATP analog(ApppI)inhibits he mitochondrial adenine nucleotide translocase(ANT)and is responsible for the apoptosis induced by nitrogen-containing bisphosphonates[J]. British Journal of Pharmacology, 2006, 147: 437–445. |
| [13] | Atlante A, Bobba A, De Bari L, et al. Caspasedependent alteration of the ADP/ATP translocator triggers the mitochondrial permeability transition which is not required for the low-potassium-dependent apoptosis of cerebellar granulecells[J]. Journal of Neurochemi-stry, 2006, 97(4): 1166–1181. |
| [14] | Klingebberg M. Transport viewed as a catalytic process[J]. Biochimie, 2007, 89(9): 1042–1048. |
| [15] | Zhang YQ, Roote J, Brogna S, et al. Stress sensitive Bencodes an adenine nucleotide translocase in Drosophila melanogaster[J]. Genetics, 1999, 153(2): 891–903. |
| [16] | Brustovetsky N, Klingenberg M. Mitochondrial ADP/ATP carrier can be reversibly converted into a large channel by Ca2+[J]. Biochemistry, 1996, 35: 8483–8488. |
| [17] | Yang Z, Cheng W, Hong L, et al. Adenine nucleotide(ADP/ATP)translocase 3 participates in the tumor necrosisfactor induced apoptosis of MCF-7 cells[J]. Molecular Biology of the Cell, 2007, 18(11): 4681–4689. |
| [18] | Thuswaldner S, Lagerstedt J O, Rojas-Stutz M, et al. Identification, expression, and functional analyses of a thylakoid ATP/ADP carrier from Arabidopsis[J]. Journal of Biochemistry, 2007, 282: 8848–8859. |
| [19] | Doerner A, Pauschinger M, Badorff A, et al. Tissue-specific transcription pattern of the adenine nucleotide translocases isoforms in humans[J]. FEBS Letters, 1997, 414: 258–262. |
| [20] | 孙文文, 周发林, 黄建华, 等. 斑节对虾腺苷酸转移酶(PmANT)基因的cDNA克隆与表达分析[J]. 上海海洋大学学报, 2013, 22(1): 7–16. |
| [21] | 沈洁, 朱冬发, 胡则辉, 等. 三疣梭子蟹蜕皮周期的分期[J]. 水产学报, 2001, 35(10): 1481–1487. |





