2. 吉林省农业科学院农业生物技术研究所,长春 130033
2. Agro-biotechnology Research Institute, Jilin Academy of Agricultural Sciences, Changchun 130033
赤霉素(gibberellins,GAs)是一类以四环二萜结构为主体的植物激素,20世纪初由日本学者发现[1]。GAs在植物生长发育中具有十分重要的作用,不仅能够促进植物组织的生长发育[2],而且还能影响某些生长发育关键阶段的启动。例如,种子休眠状态向萌发状态的改变[3],幼苗阶段向成熟阶段的转变[4],以及营养发育向生殖发育的过渡[5]等。具有生物活性的GAs在生物体中的主要存在形式是GA1/GA3/GA4/GA7,它们通常存在于发育旺盛的组织中,如茎尖、根尖分生区和种子中,而在成熟的组织中含量较少[6]。
最近对GAs的研究发现,GAs合成与信号途径中的相关基因及调控蛋白与植物的抗逆性有着密切的关联。植物可通过对赤霉素相关代谢基因的表达调控来适应外界不利的环境,如合成代谢相关基因GA20oxs、GA3oxs和GA2oxs及DELLAs等GAs信号传导相关蛋白等[4, 7, 8]。本文将近年来GAs调控参与植物耐受非生物胁迫的相关研究结果进行汇总,对已发现和阐明的相关机理进行整理和讨论,期望进一步明确GAs参与植物耐受非生物胁迫的未来研究方向。
1 赤霉素的生物合成与信号传导GAs的生物合成起始于叶绿体前体中,由合成前体GGPP(trans-geranylgeranyl diphosphate)经过CPS(ent-copalyl diphosphate synthase)和KS(ent-kaurene synthase)催化的两步酶促反应生成ent-kaurene,而后ent-kaurene进入内质网中并由细胞色素P450单加氧酶KO(ent-kaurene oxidase)和KAO(ent-kaurenoic acid oxidase)氧化形成GA12,并由GA12通过双加氧酶GA 13-oxidase(GA13ox)催化形成GA53,之后GA53在GA 20-oxidase(GA20ox)作用下产生活性赤霉素的前体GA20,GA20通过GA 3-oxidase(GA3ox)分别生成GA1和GA3;另一条途径是GA12经过GA20ox生成GA4的前体GA9之后在GA3ox作用下生成GA4。GAs合成过程中,GA20ox和GA3ox是关键合成酶,并且GA3ox是使GAs具有活性的作用酶[6]。除了合成途径之外,GAs还需要通过失活途径来调节植物体内GAs的水平,从而保证植物正常生长。已确定的赤霉素失活机制中最普遍的就是2-β羟基化。与此相关的酶是2ODDs(2-oxoglutarate-dependent dioxygenases)家族中的GA 2-oxidases(GA2oxs)。GA2oxs通过对GAs及其前体的2β羟基化最终影响GAs的合成。另有研究发现,GA20ox和GA3ox受到活性GA水平的负反馈调节,而GA2ox受到GA水平的正反馈调节[6, 9-11]。
GAs的生物学作用是通过GA-GID1-DELLAs信号传递过程最终实现的,其中DELLAs蛋白作为生长抑制蛋白会抑制植物生长,而赤霉素信号途径则可通过复合物之间的相互作用最终影响DELLAs,从而影响植物生长。具体过程如下,活性GAs通过与GID1(GIBBERELLIN INSENSITIVE DWARF 1)受体结合,导致受体蛋白构象的改变,GAs-GID1复合物再与DELLA的N端保守区域相结合,进而GID1-DELLA复合物与SCF泛素化连接酶反应,使DELLA泛素化,并被26S蛋白酶降解,DELLA对植物生长的抑制得以解除。
2 GAs与逆境胁迫 2.1 盐胁迫Na+形成的盐类物质所造成的盐胁迫会严重影响植物的生长发育,致使植物生长速率减慢,含水量降低,叶面积减少,光合作用受到影响[12, 13]。有研究发现赤霉素合成及信号传导途径参与了植物感知与抵御盐胁迫的过程。在水稻中的研究发现,GA2ox5过表达会增强水稻的耐盐性。而当外施GA3后,其耐盐性消失。这一结果证明了植物可通过减少活性GAs的方法来提高耐盐性[14]。在拟南芥的研究中也发现,在过表达ddf1基因的拟南芥中,GA2ox7基因的表达水平增加,从而导致植物矮小,盐耐性提高[15]。在对拟南芥线粒体磷酸转移体(M-PT)的研究中发现,过表达MPT的拟南芥对盐的敏感程度升高。进一步研究发现转基因组控制GAs合成的GA20ox1/2/3和GA3ox1/4的表达量上升,而控制GAs分解的GA2oxs的表达量下降[16]。这些结果证明了GAs合成代谢的关键酶GA20ox、GA3ox和GA2ox参与到了植物的耐盐响应中,编码这些酶的基因的表达情况会影响植物对盐胁迫的耐受程度。另有研究发现拟南芥中DELLA蛋白的积累,会减少盐胁迫诱导的ROS所产生的生理伤害。分析原因是由于DELLAs蛋白会诱导一系列解毒酶的表达,其中包括Cu2+/Zn2+超氧化物歧化酶、过氧化氢酶、氧化物酶和谷胱甘肽S基转移酶。该研究还发现GAI 蛋白(DELLA蛋白亚家族的一种)的过量表达对ROS具有抵御作用[17]。在盐胁迫条件下,拟南芥 della突变体材料则更容易受到盐环境的影响[18]。这一研究表明,GAs的信号传导途径也参与了植物的耐盐响应过程,并且在植物耐盐应答中起到了关键的作用。
2.2 干旱胁迫植物对干旱胁迫的应答是一个复杂的机制,多种调控因子、功能基因及植物激素均参与其中。ABA一直是植物耐旱响应研究中的重点[19, 20]。而最近一系列对GAs及其相关基因在耐旱响应中作用的研究,有助于人们更加清楚的了解植物耐受干旱胁迫的激素调控和应答网络。
番茄中过表达转录调控因子SlDREB,发现转基因材料对干旱胁迫的抗性增强。进一步研究发现转基因材料中赤霉素的合成酶基因SlCPS、SlKS、SlGA20ox1、SlGA20ox2和SlGA20ox4的表达量均下降,活性GAs含量也明显降低,同时伴有植株矮小、叶片伸展及茎长减少等表型变化[21]。另有研究发现,拟南芥中CBF/DREB2转录因子对AtGA2ox7基因的表达有正向调节作用,过表达转录因子可同时促进AtGA2ox7基因的表达,进而导致活性GAs的含量降低,达到提高抗旱性的作用[22]。最新的研究发现赤霉素合成途径中的P450单加氧酶家族的CYP96B4/SD37与水稻的耐旱性有关,该基因突变体dss1的耐旱性要明显强于野生型,其原因是由于体内GA1含量减少造成的[23]。目前,我们对玉米的研究中也发现了干旱胁迫下的一些GAs相关合成代谢基因转录水平上的变化,其中ZmGA2ox3、ZmGA2ox6、ZmGA2ox7和ZmGA2ox10基因,在叶片中转录水平上调,而在根中则出现转录下调(未发表数据)。根据相关研究结果推测,在玉米叶片中干旱胁迫引起GA2ox类基因表达上调,促进GAs分解,使叶片长度以及叶面积减少,从而减少水分散失;而在根中干旱胁迫引起GA2ox类基因的转录下调,减少GAs分解,促进了根的伸长,从而有机会获取更多水分。这与水稻和小麦中的研究结果非常相似[24, 25]。不仅GAs合成代谢调控基因参与了植物耐旱响应,GAs的信号传导途径也参与了该过程,并且与ABA信号途径形成了联系。对拟南芥中耐旱相关基因XERICO的研究发现,XERICO基因不但参与ABA代谢,而且还是DELLA蛋白的下游目的基因之一[26]。除此之外,MYB和WRKY27等ABA信号中应对干旱等非生物胁迫的关键元件,也受DELLA蛋白调控[6, 9]。这就说明DELLA蛋白可能作为植物干旱胁迫的调控节点,在GAs信号与ABA信号间起联系作用。
2.3 低温胁迫植物应答低温胁迫是个复杂的过程。近期的研究发现赤霉素相关基因也参与了植物耐低温的调控过程。CBF/DREB1是植物对低温胁迫适应过程中的最重要元件[27]。研究发现,在过表达CBF1基因的拟南芥中,CBF1诱导的COR15b发生过量表达提高了植物耐寒性,但也减缓了植物的生长,造成植株矮小。这种植株矮小表型,可通过外施GAs得到消除[28]。基于这些结果进一步分析发现CBF1的表达使DELLA蛋白家族中的GAI和RGA产生积累。而DELLA蛋白作为赤霉素信号通路中的重要元件,其量的积累会造成植株矮化。由于外施GAs可以消除矮化表型,因此DELLA的积累应该源于GAs合成量的降低。对GAs合成相关基因的分析发现CBF1转基因材料中,GA2ox3和GA2ox6基因表达出现了上调,抑制了活性GAs的合成[29]。这一研究说明,在植物耐低温的响应中,赤霉素合成代谢和信号传导过程紧密参与其中,并直接影响了植物表型。
2.4 水淹胁迫水稻面临水接受时的生存策略证明了GA信号在水淹胁迫中的作用[25]。水稻水淹条件下的应答模式分为两种,即逃离模式和耐受模式[30]。通常在浅滩或短期水淹的环境下,会诱发水稻的逃离机制,节间会快速伸长生长。这种应答使得地上部分露出水面。节间的伸长是由SNORKAL1和SNORKAL2应答乙烯积累引起的[31]。这两个基因的表达直接或间接的提高了活性GAs的水平。与此相对,Sub1A介导的耐受策略则适用于长时间的水淹环境[32]。在此模式中,水淹胁迫限制了乙烯的水平,低浓度的乙烯诱导Sub1A基因的表达。它的表达抑制了转基因水稻地上部分生长,这样糖类大量积累以便于水淹退去时的恢复生长。进一步研究发现,Sub1A的表达正调控了水稻DELLA蛋白SLR1的表达,使该蛋白表达水平上升。SLR1属于GAs抑制蛋白,它们的积累使水稻活性GAs减少,从而抑制水稻节间伸长[33, 34]。这些研究说明,植物耐受水淹胁迫过程,是通过赤霉素合成和信号传导途径与乙烯信号传导途径共同参与完成的。
3 总结植物生长过程中经常要经历盐、干旱、低温等环境胁迫。植物需要通过自身调节来适应周围环境,这其中就包括植物体内激素的调节。赤霉素作为一类重要的植物激素,已有越来越多的研究发现其合成代谢和信号传导途径参与到了植物耐受环境胁迫的过程中,并且处于耐受环境胁迫响应的调控网络节点位置(图 1)。文中列举了一系列转录因子和功能基因,通过直接或间接的方式与赤霉素代谢相关基因GA2ox、GA3ox和GA20ox,以及赤霉素信号传导途径中的DELLA蛋白发生作用,最终影响植物对环境胁迫的耐受性。通过汇总相关研究结果,我们还发现GAs与ABA、乙烯在耐受非生物胁迫过程中有着紧密的联系。但植物激素还包括生长素、细胞分裂素和茉莉酸等。植物耐受非生物胁迫过程中,赤霉素与这些激素间是否也存在着联系尚有待深入研究。另外,赤霉素相关基因在不同植物中其基因数量差别较大。以GA2ox基因为例,拟南芥中有8个,水稻中有6个,而在玉米中发现了13个。基因数量的差别造成了基因功能的分化和特化,最终影响不同基因在植物耐受非生物胁迫过程中对赤霉素的调控作用。这方面的研究也有待进一步的加强。
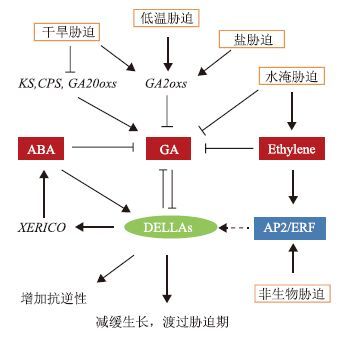
|
| 图 1 赤霉素应答非生物胁迫示意图 |
通过本文的汇总和整理,我们初步了解赤霉素在植物耐受非生物胁迫过程中的作用。但由于目前研究有限,仍无法对调控网络进行精确的诠释。希望随着相关研究的深入开展,最终获知赤霉素参与植物耐受非生物胁迫的应答机制。除此之外,随着对赤霉素与非生物胁迫相关基因与蛋白的研究还有望应用于作物育种,在明确与植物抗逆相关的候选基因/位点后,可利用分子育种和转基因手段培育抗逆植物新材料。
| [1] | 李保珠, 赵翔, 安国勇. 赤霉素的研究进展[J]. 中国农学通报, 2011, 27(1): 1–5. |
| [2] | Achard P, Gusti A, Cheminant S, et al. Gibberellin signaling controls cell proliferation rate in Arabidopsis[J]. Current Biology:CB, 2009, 19(14): 1188–1193. |
| [3] | Seo M, Nambara E, Choi G, et al. Interaction of light and hormone signals in germinating seeds[J]. Plant Molecular Biology, 2009, 69(4): 463–472. |
| [4] | Sun TP. Gibberellin-GID1-DELLA:a pivotal regulatory module for plant growth and development[J]. Plant Physiology, 2010, 154(2): 567–570. |
| [5] | Eriksson S, Bohlenius H, Moritz T, et al. GA4 is the active gibberellin in the regulation of LEAFY transcription and Arabidopsis floral initiation[J]. The Plant Cell, 2006, 18(9): 2172–2181. |
| [6] | Hedden P, Thomas SG. Gibberellin biosynthesis and its regulation[J]. The Biochemical Journal, 2012, 444(1): 11–25. |
| [7] | Sakamoto T, Miura K, Itoh H, et al. An overview of gibberellin metabolism enzyme genes and their related mutants in rice[J]. Plant Physiology, 2004, 134(4): 1642–1653. |
| [8] | Javid MG, Sorooshzaeh A, Moradi F, et al. The role of phytohormones in alleviating salt stress in crop plants[J]. AJCS, 2011, 5(6): 726. |
| [9] | Zentella R, Zhang ZL, Park M, et al. Global analysis of della direct targets in early gibberellin signaling in Arabidopsis[J]. The Plant Cell, 2007, 19(10): 3037–3057. |
| [10] | Middleton AM, Ubeda-Tomas S, Griffiths J, et al. Mathematical modeling elucidates the role of transcriptional feedback in gibberellin signaling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(19): 7571–7576. |
| [11] | Rieu I, Eriksson S, Powers SJ, et al. Genetic analysis reveals that C19-GA 2-oxidation is a major gibberellin inactivation pathway in Arabidopsis[J]. The Plant Cell, 2008, 20(9): 2420–2436. |
| [12] | 杨少辉, 季静, 王罡. 盐胁迫对植物的影响及植物的抗盐机理[J]. 世界科技研究与发展, 2006, 28(4): 70–76. |
| [13] | 王东明, 贾媛, 崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报, 2009, 25(4): 124–128. |
| [14] | Shan C, Mei Z, Duan J, et al. OsGA2ox5, a gibberellin metabolism enzyme, is involved in plant growth, the root gravity response and salt stress[J]. PLoS One, 2014, 9(1): e87110. |
| [15] | Magome H, Yamaguchi S, Hanada A, et al. The DDF1 transcriptional activator upregulates expression of a gibberellin-deactivating gene, GA2ox7, under high-salinity stress in Arabidopsis[J]. The Plant Journal:For Cell and Molecular Biology, 2008, 56(4): 613–626. |
| [16] | Zhu W, Miao Q, Sun D, et al. The mitochondrial phosphate transporters modulate plant responses to salt stress via affecting ATP and gibberellin metabolism in Arabidopsis thaliana[J]. PloS One, 2012, 7(8): e43530. |
| [17] | Achard P, Renou JP, Berthome R, et al. Plant DELLAs restrain growth and promote survival of adversity by reducing the levels of reactive oxygen species[J]. Current Biology:CB, 2008, 18(9): 656–660. |
| [18] | Colebrook EH, Thomas SG, Phillips AL, et al. The role of gibberellin signalling in plant responses to abiotic stress[J]. The Journal of Experimental Biology, 2014, 217(Pt 1): 67–75. |
| [19] | Huang XY, Chao DY, Gao JP, et al. A previously unknown zinc finger protein, DST, regulates drought and salt tolerance in rice via stomatal aperture control[J]. Genes & Development, 2009, 23(15): 1805–1817. |
| [20] | Bari R, Jones JD. Role of plant hormones in plant defence responses[J]. Plant Molecular Biology, 2009, 69(4): 473–488. |
| [21] | Li J, Sima W, Ouyang B, et al. Tomato SlDREB gene restricts leaf expansion and internode elongation by downregulating key genes for gibberellin biosynthesis[J]. Journal of Experimental Botany, 2012, 63(18): 6407–6420. |
| [22] | Kang HG, Kim J, Kim B, et al. Overexpression of FTL1/DDF1, an AP2 transcription factor, enhances tolerance to cold, drought, and heat stresses in Arabidopsis thaliana[J]. Plant Science:An int-ernational Journal of Experimental Plant Biology, 2011, 180(4): 634–641. |
| [23] | Tamiru M, Undan Jr Fau-Takagi H, Takagi H Fau-Abe A, et al. A cytochrome P450, OsDSS1, is involved in growth and drought stress responses in rice(Oryza sativa L. )[J]. Plant Molecular Biology, 2015, 88(1): 85–99. |
| [24] | Krugman T, Peleg Z, Quansah L, et al. Alteration in expression of hormone-related genes in wild emmer wheat roots associated with drought adaptation mechanisms[J]. Funct Integr Genomics, 2011, 11(4): 565–583. |
| [25] | Wang D, Pan Y, Zhao X, et al. Genome-wide temporal-spatial gene expression profiling of drought responsiveness in rice[J]. BMC Genomics, 2011, 12: 149. |
| [26] | Ko JH, Yang SH, Han KH. Upregulation of an Arabidopsis RING-H2 gene, XERICO, confers drought tolerance through increased abscisic acid biosynthesis[J]. The Plant Journal:For Cell And Molecular Biology, 2006, 47(3): 343–355. |
| [27] | Maibam P, Nawkar GM, Park JH, et al. The Influence of light quality, circadian rhythm, and photoperiod on the cbf-mediated freezing tolerance[J]. International Journal of Molecular Sciences, 2013, 14(6): 11527–11543. |
| [28] | Kurepin LV, Dahal KP, Savitch LV, et al. Role of CBFs as integrators of chloroplast redox, phytochrome and plant hormone signaling during cold acclimation[J]. International Journal of Molecular Sciences, 2013, 14(6): 12729–12763. |
| [29] | Achard P, Gong F, Cheminant S, et al. The cold-inducible CBF1 factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gibberellin metabolism[J]. The Plant Cell, 2008, 20(8): 2117–2129. |
| [30] | Bailey-Serres J, Voesenek LA. Life in the balance:a signaling network controlling survival of flooding[J]. Current Opinion in Plant Biology, 2010, 13(5): 489–494. |
| [31] | Hattori Y, Nagai K, Furukawa S, et al. The ethylene response factors SNORKEL1 and SNORKEL2 allow rice to adapt to deep water[J]. Nature, 2009, 460(7258): 1026–1030. |
| [32] | Xu K, Xu X, Fukao T, et al. Sub1A is an ethylene-response-factor-like gene that confers submergence tolerance to rice[J]. Nature, 2006, 442(7103): 705–708. |
| [33] | Fukao T, Xu K, Ronald PC, et al. A variable cluster of ethylene response factor-like genes regulates metabolic and developmental acclimation responses to submergence in rice[J]. The Plant Cell, 2006, 18(8): 2021–2034. |
| [34] | Hirano K, Asano K, Tsuji H, et al. Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice[J]. The Plant Cell, 2010, 22(8): 2680–2696. |




