Nm23 基因编码的核苷二磷酸激酶(nucleosidediphosphate kinase,NDPK,EC 2.7.4.6)可以催化核苷三磷酸发生磷基转移从而生成相应的核苷二磷酸(NDP)[1]。研究表明,NDPK 不仅可以作为看家基因维持生物体内核苷酸平衡,还参与调节细胞增殖、细胞分化、细胞凋亡和细胞信息传递等多种生物学功能[2, 3, 4]。Nm23 基因最早于1988 年由美国国立癌症研究所的Steeg 等[5]应用差示杂交(differentialhybridization)等技术从小鼠黑色毒瘤K-1735 细胞株中分离获得,并证实其与肿瘤转移抑制有关。与此同时,果蝇(Drosophila melanogaste)中也发现其同源基因awd(abnormal wing discs)参与调控昆虫的正常发育[6, 7]。之后,nm23 被发现广泛存在于从单细胞生物到哺乳动物的多个物种中[1, 8, 9, 10, 11, 12, 13],是一个具有高度同源性的保守基因家族。
大多数多细胞生物中都发现了nm23 亚型的存在,其亚型的数量和多样性似乎与生物体结构的复杂性正相关[14]。例如,单细胞生物大肠杆菌(Escherichia coli)[15] 和啤酒酵母(Saccharomycescerevisiae)[16]分别只有一个nm23 亚型,而最原始的多细胞生物盘基网柄菌(Dictyostelium discoideum)中则存在两种nm23 亚型[17]。人类的nm23 有10种亚型,根据蛋白序列结构组成和磷酸转移酶活性又将其分为两大类[18, 19]。第一类包括nm23-H1 至H4,它们的序列组成较为相似,均包含一个高度保守的NDPK 活性位点结构域,具有传统的NDPK 活性。第一类基因广泛表达于人体的各个组织,其中nm23-H1 和nm23-H2 一致性最高(88%),且能形成同源或异源六聚体[1]。第二类nm23 包括H5 至H10,与第一类基因相比,它们序列的差异较大,且拥有延伸的N 末端和C 末端。NDPK 活性位点结构域在第二类基因中并不保守,仅在nm23-H6 中发现了NDPK 活性[20]。第二类基因一般具有组织表达的特异性,nm23-H5、H6 和H8 均主要在人类精巢中表达[20, 21, 22]。
甲壳动物中有关nm23 的报道较少,在已知nm23 物种中均只发现一个亚型。该亚型属于第一类nm23,拥有NDPK 结构域,被认为参与甲壳动物的应激和免疫反应[23, 24]、配子发生[25]和性腺发育[26]。开展甲壳动物nm23 及其功能的研究,将有助于加深人们对NDPK 及其进化过程的理解。因此,本研究利用三疣梭子蟹(Portunus trituberculatus)转录组文库,首次克隆获得了三疣梭子蟹的nm23 基因,并运用实时荧光定量PCR(qPCR)分析其组织分布特性以及在卵巢发育过程的表达水平变化,以探究nm23 在三疣梭子蟹卵巢发育过程中的作用。
1 材料与方法 1.1 材料 1.1.1 实验材料2013 年10 月-2014 年4 月,分多次从宁波市镇海区水产品市场购买处于第一次卵巢发育的三疣梭子蟹(体重90-335 g),根据卵巢外观特征及性腺指数将三疣梭子蟹第一次卵巢发育划分为Ⅰ-Ⅵ等6 个时期[27],采集Ⅰ-Ⅴ期蟹(每期4只)的卵巢用于检测nm23 的相对表达水平。另采集蜕皮间期蟹(雌、雄各4 只)的表皮、精巢、卵巢、肝胰腺、大颚器、肌肉、眼柄、Y 器、心脏、脑和胸神经节用于组织表达差异性分析;组织解剖于冰上进行,并将组织存放在RNA 保存液中,-20℃保存待用。
1.1.2 主要试剂RNA 保存液、Trizol 试剂盒及DNA 回收试剂盒购自上海生工生物工程有限公司;DNase Ⅰ、PrimeScript RT reagent Kit 及SYBR®Premix Ex TaqTM Ⅱ kit 等试剂盒购自TaKaRa 公司;SMARTerTM RACE cDNA Amplification Kit 购自Clontech 公司。
1.2 方法 1.2.1 总RNA 提取及反转录将上述组织样品按照Trizol 试剂盒说明书进行总RNA 提取。总RNA 经DNase Ⅰ去除基因组DNA 后,用1% 琼脂糖凝胶电泳检测其完整性,并用超微量分光光度计Nanodrop2000(Thermo scientific,USA) 进行纯度分析。用PrimeScript RT reagent Kit 试剂盒将总RNA 进行反转录得到cDNA。
1.2.2 三疣梭子蟹nm23 基因的克隆从三疣梭子蟹转录组数据库中检索获得一段nm23 基因的同源序列,设计引物NM23-F 和NM23-R(表 1),以卵巢组织的cDNA 为模板,进行PCR 验证。根据该核心序列设计基因特异性引物(表 1),利用RACE 技术分别对三疣梭子蟹nm23 基因的3' 和5' 端进行巢式PCR 扩增。3' RACE-cDNA 将接头引物AP 替换上述试剂盒中的Oligo dT primer 和Random 6 mers 后用相同的方法进行制备,5' RACE-cDNA 按照 SMARTerTMRACE cDNA Amplification Kit 试剂盒(clontech) 进行合成(表 1)。以上PCR 均在25 μL 体系下进行,反应条件如下:94℃预变性3 min ;94℃ 30 s,56℃30 s,72℃ 30 s,33 个循环;72℃延伸10 min。所有PCR 产物经琼脂糖电泳后,用DNA 回收试剂盒(上海生工,上海)进行回收和连接,并转化至E.coli DH5α 感受态细胞进行培养,之后选取阳性克隆菌落交由上海生工生物工程有限公司进行测序。
利用Vector NTI 10.0 测序软件将核心序列和3' RACE、5' RACE 的测序结果进行拼接,获得三疣梭子蟹nm23 基因的cDNA 全长。利用NCBI ORF Finder 在线工具确定nm23 的ORF 序列,并翻译成氨基酸序列;利用ClustalX 软件将该氨基酸序列与已公布的nm23 氨基酸序列进行同源性比对;用MEGA 4.0 软件的邻位法(Neighbor-Joining)构建系统进化树;用ExPASy Proteomics Server 所提供的ProtParam tool 蛋白质分析软件分析氨基酸序列;使用Signal 3.0 Server 预测信号肽,TMHMM 在线工具预测氨基酸跨膜区域。
1.2.4 实时荧光定量PCR(qPCR)分析利用qPCR 分析nm23 在三疣梭子蟹不同组织及卵巢发育过程中的表达水平变化。根据克隆得到nm23的cDNA 全长设计一对荧光定量引物NM23YG-F、NM23YG-R 检测nm23 基因表达水平,设计actin-F和antin-R(表 1)用以扩增三疣梭子蟹β-actin 基因(FJ641977)作为内参。制作标准曲线用于验证nm23 基因和β-actin 基因引物的扩增效率。按照SYBR® Premix Ex TaqTM Ⅱ kit 使用说明进行qPCR 反应。反应条件为:95℃ 2 min ;95℃ 5 s,53.2℃ 20 s,68℃ 30 s,共40 个循环。设定熔解曲线用于保证产物的特异性,条件如下:55-95℃,每秒上升0.2℃。每个cDNA 重复3 个平行。数据用x±s 方法表示。采用 2-△△Ct 方法[28]计算目的基因相对表达量。选取实验组中的一个重复为1,其他组的数值以该重复的倍数来表示。用SPSS Statistics 软件进行单因素方差(ANOVA,Duncan’ s test) 分析,利用Excel对统计结果进行作图,P<0.05 表示显著性差异。
2 结果 2.1 三疣梭子蟹nm23基因的cDNA全长及序列分析将测序结果进行拼接得到777 bp 的三疣梭子蟹nm23 cDNA 全长序列(GenBank 登录号:KP027331)。该序列包括145 bp 的5' 端非编码区、176 bp 的3' 端非编码区和456 bp 的开放阅读框(ORF),编码151 个氨基酸(图 1)。推导的氨基酸经ExPASy(http://ca.expasy.org/)网站在线ProtParam 预测其分子式为C761H1184N204O220S10,分子量大小约为17 031.6 Da,预测等电点为7.70,亲水性总和(Grand average of hydropathicity,GRAVY) 为-0.353,属于亲水性蛋白;利用Signal 3.0 Server 和TMHMM 在线分析发现该氨基酸序列不含信号肽,且无跨膜结构域。

|
| 图 1 三疣梭子蟹nm23 全长cDNA 核苷酸序列和编码区氨基酸序列 |
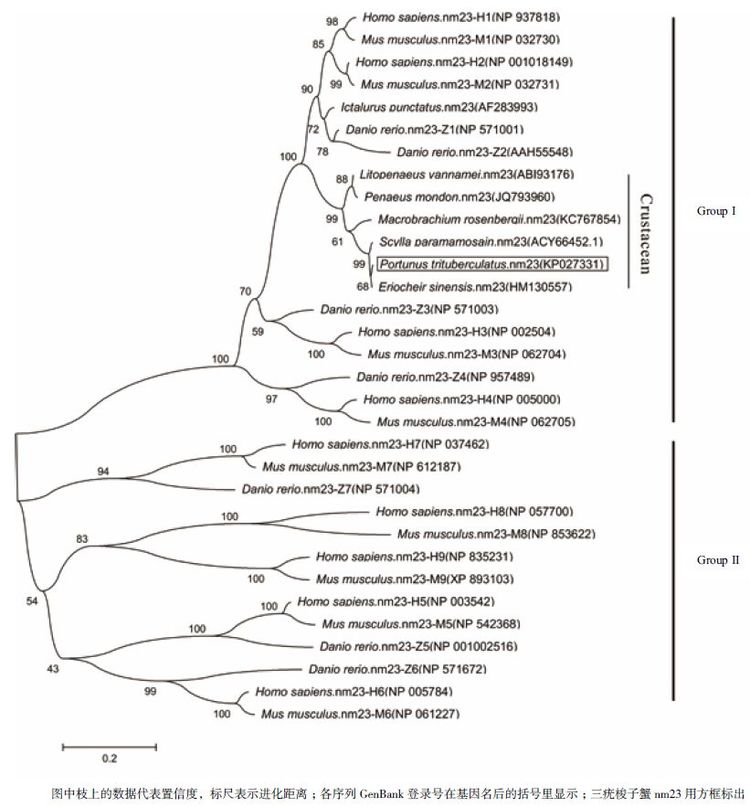
Blast 结果显示,推导的氨基酸序列与拟穴青蟹(Scylla paramamosain)的nm23 一致性最高(99%);其次为中华绒螯蟹(Eriocheir sinensis),达到98% ;与凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon) 和罗氏沼虾(Macrobrachiumrosenbergii)nm23 的一致性均为90%。该氨基酸序列由一个NDPK 结构域组成,包含11 个NDPK 活性位点(Lys-11、Tyr-51、Phe-59、Arg-87、Thr-93、Arg-104、Asn-114、His-117、Ser-119、Asp-120 和Glu-128) 和9 个多肽结合位点(Val-15、Ile-20、Gly-21、Glu-22、Lys-25、Glu-28、Met-37、Lys-38和Tyr-39),其活性位点结构域为NXXH[G]SD(图 2)。根据三疣梭子蟹nm23 及其他物种的nm23氨基酸序列,利用MEGA 4.0 软件的邻接距离(Neighbor-joining)法构建进化树,结果(图 3)显示,所有物种的第一类nm23 和第二类nm23 分别聚为一支;三疣梭子蟹nm23 与其他甲壳动物nm23 聚在一起,均属于第一类nm23,且与脊椎动物的nm23 的1 和2 亚型亲缘关系较近。

|
| 图 2 三疣梭子蟹nm23 与其他物种nm23-1/2 同源序列的氨基酸序列比对 |
|
| 图 3 邻接法构建的基于nm23 氨基酸序列的系统进化树 |
实时荧光定量PCR(qPCR) 结果( 图 4) 显示,nm23 在三疣梭子蟹各组织中均有表达,其表达水平在眼柄(Es)、肌肉(Ms)和Y 器(Yo)中最高,卵巢(Ov)和肝胰腺(Hp)次之,其他组织中nm23 表达水平均较低。

|
| 图 4 三疣梭子蟹nm23 在不同组织里的表达水平 |
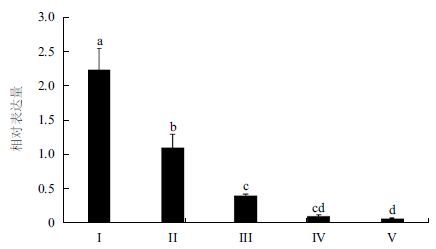
为了研究nm23 在三疣梭子蟹卵巢发育过程中的作用,采集各发育期卵巢检测其中nm23 的相对表达水平。结果(图 5)显示,在三疣梭子蟹卵巢发育过程中,nm23 在Ⅰ期表达水平最高,显著高于其他各期(P<0.05);随后其表达量开始逐渐下降,至V 期降至最低。
|
| 图 5 三疣梭子蟹第一次卵巢发育过程中nm23 在卵巢中的表达水平变化 |
本研究根据三疣梭子蟹转录组文库中的nm23同源序列,利用RACE 技术,首次克隆获得了三疣梭子蟹nm23 的全长cDNA 序列。推导的nm23 氨基酸序列由一个典型的NDPK 区域组成,该区域包含11 个NDPK 活性位点、9 个多肽结合位点和1 个保守的NDPK 活性位点结构域。三疣梭子蟹nm23 与其他甲壳动物的nm23 一致性较高,均在90% 以上,与脊椎动物第一类nm23 的一致性也达到70% 以上。进一步构建系统进化树发现甲壳动物nm23 与第一类nm23 聚为一支,这表明目前甲壳动物克隆获得的nm23 均为第一类nm23,甲壳动物中是否存在第二类nm23 还需进一步证实。值得注意的是,在已知甲壳动物的nm23 中,罗氏沼虾nm23 拥有延伸的C 末端和N 末端,其可能是甲壳动物nm23 的另一种亚型[25],该亚型是否存在于三疣梭子蟹中还有待进一步研究。
与脊椎动物第一类nm23 一样,甲壳动物nm23也广泛存在于各个组织中,但在不同物种中,其主要表达的组织并不一致。例如,在罗氏沼虾中,nm23 在肌肉中、肝胰腺、精巢和卵巢中均有较高的表达[25];在中华绒螯蟹中,除肌肉和肝胰腺外,nm23 在鳃和心脏中也有较高的表达[24]。本研究中,三疣梭子蟹nm23 在肌肉、卵巢和肝胰腺中均有较高的表达,与之前报道相符;但不同的是,nm23 在三疣梭子蟹的Y 器和眼柄中也存在较高的表达,这可能与罗氏沼虾和中华绒螯蟹中并未检测nm23 在Y器和眼柄中的表达情况有关。在斑节对虾中,nm23虽然在雌蟹眼柄中表达水平最高,但在雄蟹眼柄中却极低[26];且其在卵巢和肝胰腺中表达水平较低,与本研究结果也不一致。因此,nm23 在甲壳动物中的组织分布特性并不明确,可能因种而异。
三疣梭子蟹的卵巢发育过程主要经历了卵原细胞的增殖(Ⅰ期)、内源性卵黄合成期(Ⅱ)、外源性卵黄合成期(Ⅲ)、近成熟期(Ⅳ 期)和成熟期(Ⅴ期)等阶段[27]。三疣梭子蟹nm23 在卵巢发育的Ⅰ期表达水平最高,之后随着卵巢发育的进行,其表达水平逐渐下降,并在成熟期降至最低。该结果与罗氏沼虾nm23 的研究结果相一致[25],这表明nm23可能抑制甲壳动物的卵巢发育过程。此外,Hsieh 和Wu[29]认为nm23 可以通过抑制B 型细胞周期蛋白(Cyclin B)从而阻止细胞从G2 期向M 期转化。三疣梭子蟹nm23 是否也是通过Cyclin B 实现对卵母细胞减数分裂的负向调控还需进一步研究。
4 结论本研究首次克隆获得了三疣梭子蟹nm23 基因的全长cDNA 序列,其氨基酸序列与已知甲壳动物的nm23 一致性达到90% 以上,且与哺乳动物第一类nm23 亲缘关系较近。组织差异表达分析显示,三疣梭子蟹nm23 在三疣梭子蟹各组织内均有表达,其表达水平在眼柄、肌肉和Y 器中最高,卵巢和肝胰腺次之。在三疣梭子蟹卵巢发育过程中,卵巢中nm23 的表达水平在Ⅰ期最高,之后逐渐下降,在成熟期降至最低,这表明nm23 可能参与调控三疣梭子蟹的卵巢发育。
| [1] | Gilles AM, Presecan E, Vonica A, et al. Nucleoside diphosphate kinase from human erythrocytes :Structural characterization of the two polypeptide chains responsible for heterogeneity of the hexameric enzyme[J]. Journal of Biological Chemistry, 1991, 266 (14):8784-8789. |
| [2] | Liotta LA, Steeg PS. Clues to the function of Nm23 and Awd proteins in development, signal transduction, and tumor metastasis provided by studies of Dictyostelium discoideum[J]. Journal of the National Cancer Institute, 1990, 82(14):1170-1172. |
| [3] | Lombardi D, Lacombe ML, Paggi MG. nm23 :Unraveling its biological function in cell differentiation[J]. Journal of Cellular Physiology, 2000, 182(2):144-149. |
| [4] | Amrein L, Barraud P, Daniel JY, et al. Expression patterns of nm23 genes during mouse organogenesis[J]. Cell and Tissue Research, 2005, 322(3):365-378. |
| [5] | Steeg PS, Bevilacqua G, Kopper L, et al. Evidence for a novel gene associated with low tumor metastatic potential[J]. Journal of the National Cancer Institute, 1988, 80(3):200-204. |
| [6] | Biggs J, Tripoulas N, Hersperger E, et al. Analysis of the lethal interaction between the prune and Killer of prune mutations of Drosophila[J]. Genes & Development, 1988, 2(10):1333- 1343. |
| [7] | Dearolf CR, Tripoulas N, Biggs J, et al. Molecular consequences of awdb3, a cell-autonomous lethal mutation of Drosophila induced by hybrid dysgenesis[J]. Developmental Biology, 1988, 129(1): 169-178. |
| [8] | Biggs J, Hersperger E, Steeg PS, et al. A Drosophila gene that is homologous to a mammalian gene associated with tumor metastasis codes for a nucleoside diphosphate kinase[J]. Cell, 1990, 63(5): 933-940. |
| [9] | Kimura N, Shimada N, Nomura K, et al. Isolation and characterization of a cDNA clone encoding rat nucleoside diphosphate kinase[J]. Journal of Biological Chemistry, 1990, 265(26):15744-15749. |
| [10] | Lacombe ML, Wallet V, Troll H, et al. Functional cloning of a nucleoside diphosphate kinase from Dictyostelium discoideum[J]. Journal of Biological Chemistry, 1990, 265(17):10012-10018. |
| [11] | Munez-Dorado J, Inouye M, Inouye S. Nucleoside diphosphate kinase from Myxococcus xanthus. Ⅱ. Biochemical characterization[J]. Journal of Biological Chemistry, 1990, 265(5):2707-2712. |
| [12] | Ouatas T, Abdallah B, Gasmi L, et al. Three different genes encode NM23/nucleoside diphosphate kinases in Xenopus laevis[J]. Gene, 1997, 194(2):215-225. |
| [13] | Shimada N, Ishikawa N, Munakata Y, et al. A second form(β isoform)of nucleoside diphosphate kinase from rat :Isolation and characterization of complementary and genomic DNA and expression[J]. Journal of Biological Chemistry, 1993, 268(4): 2583-2589. |
| [14] | Ishikawa N, Shimada N, Takagi Y, et al. Molecular evolution of nucleoside diphosphate kinase genes :Conserved core structures and multiple-layered regulatory regions[J]. Journal of Bioenergetics and Biomembranes, 2003, 35(1):7-18. |
| [15] | Hama H, Almaula N, Lerner CG, et al. Nucleoside diphosphate kinase from Escherichia coli ;its overproduction and sequence comparison with eukaryotic enzymes[J]. Gene, 1991, 105(1): 31-36. |
| [16] | Tsunehiro F, Junichi N, Narimichi K, et al. Isolation, overexpression and disruption of a Saccharomyces cerevisiae YNK gene encoding nucleoside diphosphate kinase[J]. Gene, 1993, 129(1):141- 146. |
| [17] | Troll H, Winckler T, Lascu I, et al. Separate nuclear genes encode cytosolic and mitochondrial nucleoside diphosphate kinase in Dictyostelium discoideum[J]. Journal of Biological Chemistry, 1993, 268(34):25469-25475. |
| [18] | Boissan M, Dabernat S, Peuchant E, et al. The mammalian Nm23/ NDPK family :From metastasis control to cilia movement[J]. Molecular and Cellular Biochemistry, 2009, 329(1-2):51-62. |
| [19] | Desvignes T, Pontarotti P, Bobe J. Nme gene family evolutionary history reveals pre-metazoan origins and high conservation between humans and the sea anemone, Nematostella vectensis[J]. PLOS One, 2010, 5(11):e15506. |
| [20] | Tsuiki H, Nitta M, Furuya A, et al. A novel human nucleoside diphosphate(NDP)kinase, Nm23-H6, localizes in mitochondria and affects cytokinesis[J]. Journal of Cellular Biochemistry, 2000, 76(2):254-269. |
| [21] | Munier A, Feral C, Milon L, et al. A new human nm23 homologue (nm23-H5)specifically expressed in testis germinal cells[J]. FEBS Letters, 1998, 434(3):289-294. |
| [22] | Sadek CM, Jiménez A, Damdimopoulos AE, et al. Characterization of human thioredoxin-like 2 A novel microtubule-binding thioredoxin expressed predominantly in the cilia of lung airway epithelium and spermatid manchette and axoneme[J]. Journal of Biological Chemistry, 2003, 278(15):13133-13142. |
| [23] | Clavero-Salas A, Sotelo-Mundo RR, Gollas-Galvan T, et al. Transcriptome analysis of gills from the white shrimp Litopenaeus vannamei infected with White Spot Syndrome Virus[J]. Fish & Shellfish Immunology, 2007, 23(2):459-472. |
| [24] | Jin XK, Li WW, He L, et al. Molecular cloning, characterization and expression analysis of two apoptosis genes, caspase and nm23, involved in the antibacterial response in Chinese mitten crab, Eriocheir sinensis[J]. Fish & shellfish immunology, 2011, 30(1): 263-272. |
| [25] | Song YN, Lu CY, Chen J, et al. Characterization of a novel nm23 gene and its potential roles in gametogenesis in the prawn Macrobrachium rosenbergii(de Man, 1879)(Crustacea : Decapoda)[J]. Gene, 2013, 531(1):1-7. |
| [26] | 孙文文. 斑节对虾ANT 基因与nm23基因的cDNA 克隆及表达分析[D]. 上海:上海海洋大学, 2012. |
| [27] | 吴旭干, 姚桂桂, 杨筱珍, 等. 东海三疣梭子蟹第一次卵巢发育规律的研究[J]. 海洋学报, 2007, 29(4):120-127. |
| [28] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4):402-408. |
| [29] | Hsieh TC, Wu JM. Changes in cell growth, cyclin/kinase, endogenous phosphoproteins and nm23 gene expression in human prostatic JCA-1 cells treated with modified citrus pectin[J]. Biochemistry and Molecular Biology International, 1995, 37(5): 833-841. |





