2. 武汉大学生命科学学院遗传学系,武汉 430072
2. Department of Genetics,College of Life Sciences,Wuhan University,Wuhan 430072
莲藕(Nelumbo nucifera)为莲科莲属植物,主要分布在亚洲和大洋洲,也是我国最重要的一种水生经济作物,有食用、药用和观赏价值,也具园林造景和水体净化等环境生态价值。经过长期栽培驯化,已经拥有上百个品种。随着莲藕基因组测序的完成[1, 2],莲藕基因功能鉴定以及表观遗传学研究将成为莲藕基因组研究的重点。免疫荧光染色技术是一种能快速、直观、准确检测目的抗原在细胞内分布的生物技术,其原理是抗原与荧光素标记的抗体直接或间接特异性结合而在荧光显微镜下得以检测[3]。该技术在医学、动物学领域已应用多年[4, 5, 6, 7, 8, 9],但在植物中的应用报道较少。目前,有关莲藕核型分析[10, 11]和荧光原位杂交[12]的研究中提供了一些莲藕的染色体制片方法,但莲藕根尖染色体制片比较困难,运用常规方法制片难以得到效果满意的染色体装片,而且关于莲藕根尖染色体制片新进展的报道也较少,不利于进行基因的染色体定位等细胞遗传学研究。因此,本研究旨在探索出适用于莲藕的染色体制片与免疫荧光染色的新技术,为莲藕基因进行染色体定位等细胞遗传学及表观遗传学研究提供参考。
1 材料与方法 1.1 材料供试莲藕(Nelumbo nucifera)由武汉大学生命科学学院遗传学系丁毅教授课题组提供。
1.2 方法 1.2.1 材料培养选择饱满的莲藕种子,在种皮上轻轻敲击出小裂口(以利于种子萌发),清洗干净后加入清水,置于28℃ 的恒温光照培养箱中培养。
1.2.2 取材及确定适宜的根长约3 周后种子萌发长出初生根,当根尖分别生长至0.5、1.0、1.5 和2.0cm 长度时,用清水清洗。选取长势旺盛的根尖,进行下一步处理。
1.2.3 预处理分别选择8-羟基喹啉溶液、饱和对二氯苯溶液、饱和α-溴萘溶液、冰水作为预处理试剂,并进行制片效果比较。即分别用0.002 mol/L 的8-羟基喹啉、饱和对二氯苯在16℃下浸没材料进行预处理;饱和α-溴萘溶液在28℃培养箱中避光浸没处理材料,并在2 小时后换一次溶液。前3 种预处理均设置4 个预处理时间梯度:1、2、3 和4 h ;冰水冷冻处理时将材料置于冰水中,在4℃的冰箱中预处理18-24 h。
1.2.4 固定将各种预处理后的材料取出,放置入1.5 mL EP 管内用无菌水冲洗数次,加入4% 多聚甲醛冲洗3 次,最后在管内加入0.5 mL 的4% 多聚甲醛,4℃下固定,固定时间设置为4 个梯度:30 min、1 h、1.5 h 和2 h。
1.2.5 解离固定后切取约长1 mm 根尖用无菌水冲洗数次,用水解酶[2.5% 纤维素酶+2.5% 果胶酶磷酸缓冲盐溶液,(phosphate buffered saline,PBS)]于37℃下进行解离,时间设置为4 个梯度:15、20、30 和40 min。
1.2.6 低渗先用 1×PBS 洗数次,洗去酶液,再用1×PBS 进行低渗,时间设置为4 个梯度:15、20、30 和40 min。压片法制片,-80℃储存。
1.2.7 DAPI 染色从-80℃中取出装片,迅速用刀片启掉盖玻片,在60℃烘箱内烤片10 min。避光下,向载玻片上加15 μL DAPI(10 μg/mL)溶液,盖上盖玻片。在荧光显微镜下用紫外(UV)激发滤光片观察镜检,进行分裂相及有丝分裂指数统计。
1.2.8 免疫荧光染色从-80℃拿出装片,于60℃烘箱中烤片1 h,加50 μL 3% BSA(Bovine SerumAlbumin)溶液,加盖玻片,37℃封阻1 h。揭去盖玻片,将载玻片置于1×PBS 溶液中清洗3 次,每次5 min。 向载玻片上加入50 μL 一抗稀释液(用3%BSA 以1∶500 的比例稀释一抗)。加盖玻片,置于湿盒内于4℃孵育过夜。揭去盖玻片,将载玻片置于1×PBS 溶液中清洗3 次,每次5 min。避光条件下,向载玻片上加50 μL 二抗稀释液(用3%BSA以1∶100 的比例稀释二抗),加盖玻片,于37℃孵育1 h。揭去盖玻片,将载玻片置于1×PBS 溶液中清洗3 次,每次5 min。用去离子水清洗2 次,每次3 min,仍然在避光条件下,室温自然晾干。加15μL DAPI(10 μg/mL)溶液,盖上盖玻片。
1.2.9 镜检染色体装片在Olympus BX60 荧光显微镜下观察,分别用紫外(UV)和绿色(WG)激发滤光片观察DAPI 染色和Cy3 标记的信号,将好的图片用Olympus DP80 CCD 拍照保存。
2 结果 2.1 不同根尖长度对制片的影响根尖长度对细胞分裂指数有比较明显的影响。由表 1 可见,当根尖长约1.5 cm 时切取,效果最好,细胞分裂指数为11.63%。当根尖太短时,分裂相较少,染色体分散程度不好;根尖太长时,分裂相也较少。
在使用不同预处理试剂分别对根尖材料预处理后的结果是:4℃冰水浴预处理24 h 细胞分裂相较多,染色体浓缩程度适宜,分散均匀,形态清晰,缢痕区明显;0.002 mol/L 的8-羟基喹啉溶液预处理2 h 效果次之;而饱和对二氯苯溶液、饱和α-溴萘溶液在各个时间长度的预处理效果均不甚理想(表 2,图 1,图 2)。

|
| 图 1 不同预处理的制片效果 |

|
| 图 2 冰水预处理24 h 的低倍镜下制片效果 |
固定时间对制片有一定影响。我们的实验表明固定根尖1 h 时间恰当,染色体形态较为清晰,如图 3-A ;固定时间过短如30 min 或过长超过1 h 后,染色体形态均较为模糊(图 3-B)。3-B 是固定2 h 制片中的染色体,可见染色体形态较模糊。

|
| 图 3 不同固定时间的制片效果 |
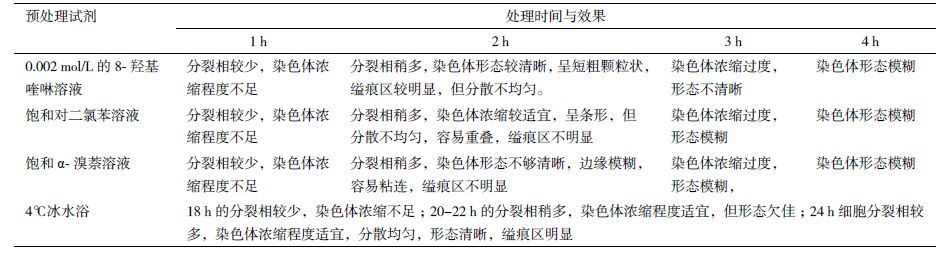
在酶解去壁过程中,不同酶解与低渗时间的制片效果是不同的(图 4,表 3)。用2.5% 的混合酶液在 37℃酶解30 min 酶解较彻底,能去除细胞壁和细胞膜,染色体分散较好(图 4-A);低渗30 min 染色体形态清晰较好(图 4-B);解离或低渗40 min 或更长时,许多细胞胀破,多个细胞较多的染色体也会混在一起(图 4-C),细胞染色体也有丢失现象(图 4-D)。
|
| 图 4 不同酶解时间的制片效果 |
本实验进行的免疫荧光染色中,使用的一抗是H3K27me2 多克隆抗体,二抗是荧光(Cy3)标记羊抗兔IgG。
首先,用DAPI 染色,观察到染色体和细胞核都为蓝色(图 5A、D),这是DAPI 特有的颜色;再经免疫荧光染色,在所观察的图像中,无论是细胞核还是染色体上均有较强的红色阳性荧光信号(图 5-B、E),是Cy3 荧光素特有的荧光信号。最后,将DAPI 染色图像与免疫荧光染色图像进行重叠得到荧光染色信号图像(图 5-C、F)。这表明本实验进行的莲藕染色体制片及其免疫荧光染色是有效可行的。
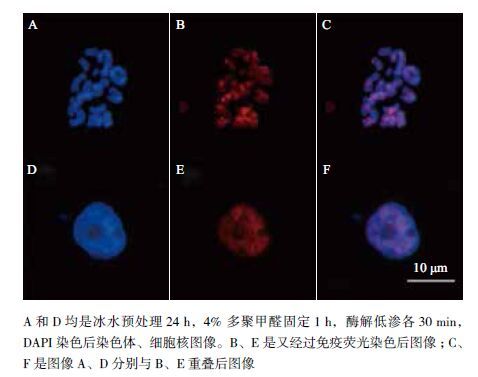
|
| 图 5 免疫荧光染色的制片效果 |
有丝分裂指数= 有丝分裂细胞数/ 观察细胞总数×100%[13]。不同根尖长度对制片及有丝分裂指数是有影响的。当莲藕根尖长约1.5 cm 时切取,制片效果最好,有丝分裂指数最高。李玉玺[13]、郑金双等[14]研究中也有类似报道。
预处理可破坏和抑制纺锤体中微管的形成,使中期分裂相的数量增加,促使染色体浓缩变短,利于染色体分散[15]。可用作预处理的药物很多,如秋水仙素、对二氯苯、8-羟基喹啉、α-溴萘、冰水等[15, 16]。不同植物进行预处理的最佳方式不同。杨玲等[15]利用对二氯苯-α-溴萘混合液预处理沙田柚根尖制片效果最好,中期分裂指数高;李艳辉等[17]用8-羟基喹啉处理皱叶酸模,染色体制片效果最好;任文娟等[18]、赵庆等[19]分别以冰水预处理菜用大黄、万寿菊根尖,获得的染色体中期细胞数比例最高,中期分裂相也较多;牛力涛等[20]、张健等[21]分别用8-羟基喹啉与秋水仙素混合液预处理裕民无刺红花、木薯叶片,染色体制片的效果显著。
固定剂可以中止细胞中的酶解反应或其他代谢活动,防止抗原丢失或被破坏,并保持细胞原有的结构和状态。常用的固定剂有交联剂和有机溶剂[3]。常规制片中常用的卡诺氏固定液是有机溶剂,其固定作用特点是穿透性强、可使细胞内蛋白变性,但在染色过程中,处理时间过长时可导致抗原流失;多聚甲醛为交联固定剂,能够使细胞内蛋白之间相互交联,保存抗原于原位,能较好地保存抗原及组织细胞的形态结构,又能使蛋白质得以固定[22, 23, 24]。解离可以除去细胞间的果胶层并软化、破坏细胞壁[25]。Gill 等[26]用纤维素酶和果胶酶溶解细胞壁。陈瑞阳等[27]提出了酶解去壁低渗的制片方法,制片的染色体分散较好、形态较平整。
4',6-二脒基-2-苯基吲哚,4',6-diamidino-2-phenylindole,DAPI 是一种灵敏度高、特异性强的DNA 荧光染料,它对细胞核内染色体、细胞质DNA都有很好的荧光染色效果,DAPI 复合物发出的荧光为浅蓝色,荧光显微镜观察细胞标记的效率高,荧光稳定,便于显微照相,已得到广泛应用[28, 29, 30]。
3.2 制片过程各个步骤摸索、控制及优化我们在摸索最佳预处理方式时,保证了在整个制片过程中只有预处理是不同的变量,其余各个步骤中的同一个步骤都设置成相同方式。这样材料经过不同的预处理后,在相同的固定方式、解离方式、低渗方式、DAPI 染色等方式处理后,镜检就可选出最适宜的预处理方式。本研究选出最适宜的预处理方式是冰水低温处理方式。
本实验采用间接免疫荧光测定法,即抗原与荧光素标记的抗体间接特异性结合,来检测抗原蛋白在细胞核和染色体上的定位分布情况。与以往常规制片方法相比,DAPI 染色后装片背景更为澄净,在荧光显微镜下染色体更清晰,可清楚地观察到中期或前中期染色体。免疫荧光染色后,在染色体和细胞核上可观察到较强的阳性荧光信号。信号显示了组蛋白H3K27me2 二甲基化修饰后的位置,信号在着丝粒等异染色质(heterochromatin)部位有明显分布,这为组蛋白甲基化修饰的分布及功能研究奠定了基础,也可以为如莲藕一类染色体较小的植物的核型分析及染色体定位等细胞学研究奠定基础。
以往免疫荧光研究多在人及动物体的组织细胞中进行,莲藕根尖细胞的细胞壁等因素增加了免疫荧光技术在植物细胞中摸索运用的难度。本实验为了克服卡诺氏固定液使细胞内蛋白变性、可导致抗原流失等缺点,选择多聚甲醛作为固定剂,因此能较好地保持抗原及组织细胞的形态结构,使蛋白质得以固定;而解离则选择2.5% 纤维素酶和2.5% 果胶酶混合酶液来溶解细胞壁,用1×PBS 进行低渗,而不是使用在动物细胞免疫荧光染色中常用的通透剂TritonX-100)[8, 22, 23, 24]。实验结果表明,这样处理后的莲藕根尖染色体制片及免疫荧光染色效果较好。值得注意的是多聚甲醛本身的透膜作用较弱,不进行渗透,抗体很难进入细胞[24],它在发挥交联固定作用同时可能会阻碍抗体的渗透[23],因此本实验中也观察到有些细胞核及核内染色体上的荧光信号并不强。这需要我们对1×PBS 的低渗作用等方面做进一步研究。而且,该技术对操作者技术要求较高,整个实验流程较长,免疫染色中的抗体价格比较昂贵,需要操作者技术熟练。在莲藕上筛选出来的最佳处理,还有待于运用于其他植物。
4 结论本实验对莲藕根尖染色体进行了适于免疫荧光染色的染色体制片技术的研究和优化,结果表明,根尖最适宜取材长度为1.5 cm 左右,冰水预处理24h 分裂相较多,染色体形态清晰;用4% 多聚甲醛固定1 h 染色体形态较好;采用2.5% 纤维素酶和2.5%果胶酶混合液37℃消化30 min,酶解较彻底;1×PBS低渗30 min,染色体形态较好;免疫荧光染色后呈现较强信号。
| [1] | Ray Ming, Robert VanBuren, Liu YL, et al. Genome of the longliving sacred lotus(Nelumbo nucifera Gaertn. )[J]. Genome Biology, 2013, 14(5):1-11. |
| [2] | Wang Y, Fan GY, Liu YM, et al. The sacred lotus genome provides insights into the evolution of flowering plants[J]. The Plant Journal, 2013, 76(4):557-567. |
| [3] | 李冉, 杨文理, 覃扬, 等. 不同固定方法对细胞免疫荧光染色结果的影响[J]. 西部医学, 2013, 25(11):1608-1610. |
| [4] | 曹祖兵, 猪克隆胚胎生产技术及组蛋白乙酰化免疫荧光染色技术优化[D]. 安徽农业大学, 2010(, 6):41-42. |
| [5] | 窦方方, 刘廷, 董晓光. 小鼠视网膜铺片免疫荧光染色技术的探讨[J]. 眼科新进展, 2010, 30(8):714-717. |
| [6] | 郑燕漩, 王晓鸿, 曹婉维, 等. 肾穿组织免疫荧光及染色方法的改良[J]. 中国医学创新, 2010, 8(30):81-82. |
| [7] | 蔡欣, 标记减数分裂遗传重组的免疫荧光染色方法[J]. 中国生物化学与分子生物学报, 2010, 26(11):1068-1071. |
| [8] | 宋世平, 王淼, 董磊, 等. 尿红细胞THP 免疫荧光染色在血尿红细胞来源鉴定中的应用价值[J]. 海南医学, 2013, 24(1):53-55. |
| [9] | 杨江华, 朱晓玥, 王文节. 免疫荧光染色法检测结核分支杆菌的建立与临床应用[J]. 中国实验诊断学, 2015, 19(5):775-777. |
| [10] | 杨瑞芳, 郭清泉, 郑思乡, 等. 寸三莲染色体核型和Giemsa C—带型[J]. 湖南农业大学学报, 1998, 24(3):191-193. |
| [11] | 王宁珠, 马芳莲, 李细兰, 等. 莲属(Nelumbo)20 个品种染色体数目录及其核型分析[J]. 武汉植物学研究, 1985, 3(3):209-217. |
| [12] | 刁英. 莲藕染色体上荧光原位杂交方法的初探[J]. 氨基酸和生物资源, 2004, 26(2):23-25. |
| [13] | 李玉玺, 轩淑欣, 王彦华, 等. 大白菜适于FISH 的染色体制片技术研究[J]. 中国农学通报, 2011, 27(10):284-288. |
| [14] | 郑金双, 张蜀宁, 孙成振, 等. 不结球白菜根尖体细胞染色体制片及其二倍体和四倍体有丝分裂过程观察[J]. 植物资源与环境学报, 2011, 20(4):58-63. |
| [15] | 杨玲, 罗梦婷. 不同预处理对长寿沙田柚根尖染色体制片的影响[J]. 南方农业, 2012, 6(6):73-76. |
| [16] | 李懋学, 张学方. 植物染色体研究技术[M]. 哈尔滨:东北林业大学出版社, 1991 :15-22. |
| [17] | 李艳辉, 吴杰, 冯辉, 等. 皱叶酸模染色体数目及 核型分析[J].河南农业科学, 2011, 40(5):142-144. |
| [18] | 任文娟, 郭小菲, 姜立娜, 等. 菜用大黄染色体制片优化及核型分析[J]. 华北农学报, 2013, 28(5):128-132. |
| [19] | 赵庆, 唐道城. 万寿菊根尖染色体观测方法的优化[J]. 北方园艺, 2013(20):98-100. |
| [20] | 牛力涛, 王晓军, 郝秀英, 等. 裕民无刺红花染色体制 片优化及核型分析[J]. 北方园艺, 2010(9):157-160. |
| [21] | 张健, 郭军辉, 陈雄庭, 等. 木薯叶片染色体制片技术研究[J].热带作物学报, 2012, 33(1):20-23. |
| [22] | 林哲绚, 罗红军, 李慧, 等. 免疫荧光技术中不同固定剂对细胞p65 核移位观察效果的影响[J]. 山西医药杂志(上半月),2012, 41(3):211-212. |
| [23] | 秦犹, 陈永昌. 免疫荧光技术中不同固定剂对RhoA 蛋白定位的影响[J]. 江苏大学学报:医学版, 2006, 5 :385-388. |
| [24] | 冯婧文, 杨少斌, 王兆松, 等. 不同固定剂及渗透方法对免疫荧光技术中EGFR 内吞转运观察效果的影响[J]. 天津医科大学学报, 2015, 21(3):264-267. |
| [25] | 张贵友, 吴琼, 林琳, 等. 普通遗传学实验指导[M]. 北京:清华大学出版社, 2003 :1-8. |
| [26] | Gill BS, Kimber G. The giemsa C-banded karyotype of rye[J].Proc Natl Acad Sci USA, 1974, 71(4):1247-1249. |
| [27] | 陈瑞阳, 宋文芹, 李秀兰. 植物染色体标本制备的去壁、低渗法及其在细胞遗传学中的意义[J]. 遗传学报, 1982, 9(2):151-159. |
| [28] | Zhang P, Friebe B. FISH on plant chromosomes[M]// Liehr T Fluorescence in situ Hybridization(FISH)-Application Guide, Berlin :Springer-Verlag, 2009 :365-394. |
| [29] | 刘宇, 毕燕会, 周志刚. 海带染色体的 DAPI 染色及核型初步分析[J]. 水产学报, 2012, 36(1):50-54. |
| [30] | 徐延浩, 高伟, 张文英. 不同作物染色体DAPI 荧光显带的研究[J]. 吉林农业科学2013, 38(2):27-28. |