原生质体是指去除细胞壁的植物细胞,可以同整株植物一样进行正常的生理反应和细胞活动[1],是多功能的植物遗传改良的重要实验体系之一,在研究细胞生理过程和活动中发挥着重要的作用,如细胞壁的合成,细胞分裂、分化[1],光合作用[2],钙离子信号调控[3],蛋白质亚细胞定位[4]和完整细胞器的分离[5]。应用原生质体为受体进行的遗传操作必须建立在其有效分离的技术基础之上。原生质体分离的方法主要有机械法和酶解法两种,机械法分离原生质体的过程非常复杂且产量低,而酶解法可以在短时间内非常容易地分离出大量的原生质体,因此目前常用酶解法分离原生质体。从Cocking 等[6]首次采用酶解法成功地分离原生质体至今,已经成功应用此法分离到了多种植物的原生质体,如拟南芥[1]、烟草[7]、水稻[8]、一品红[9]及番茄[10]等。
普通小麦(T.aestivum. L)是世界上种植面积最大的粮食作物,由于其具有遗传上的高度杂合性、染色体的多种倍性和来源广泛等特点,使其原生质体培养一直受到重视,成为小麦育种的重要手段之一,通常小麦的悬浮培养细胞和愈伤组织常用来作为分离原生质体的材料[11],但应用这两种材料分离原生质体耗时长,操作繁琐,且经酶解后仍有很多未酶解的组织,细胞和已破碎的物质对原生质培养和进一步的遗传转化等极为不利[12]。目前,仅有少数的报道对小麦叶肉细胞原生质体的分离方法进行了研究。本研究以7 日龄小麦的叶肉细胞为材料,对分离原生质体过程中使用的酶浓度、酶解时间及酶解液中甘露醇浓度等因素进行研究,建立了最佳的小麦叶肉细胞的原生质体制备体系,旨为进一步的细胞培养和融合及以原生质体为受体材料而进行的各种遗传操作提供参考。
1 材料与方法 1.1 材料实验材料为普通小麦(T. aestivum L) 品系CAU981,用5%的次氯酸钠对种子进行表面消毒处理10 min,蒸馏水冲洗3 遍,置于4℃冰箱中黑暗培养3 d 后,将种子分散放置在盛有水的托盘里,水分以没过种子为准,置于培养室(温度25℃,相对湿度60%,16 h 光照/8 h 黑暗,光强250 μmol·m-2·s-1)中培养。取播种后生长至第7 天的麦苗的叶片及叶鞘部分作为实验材料(图 1-A)。

|
| 图 1 用于制备原生质体的麦苗及酶解液中的麦苗切段 |
实验所用载体是在pBI221 基础上改造而成,由烟草花叶病毒35S 启动子、萤火虫荧光素酶基因和NOS 终止子构成。
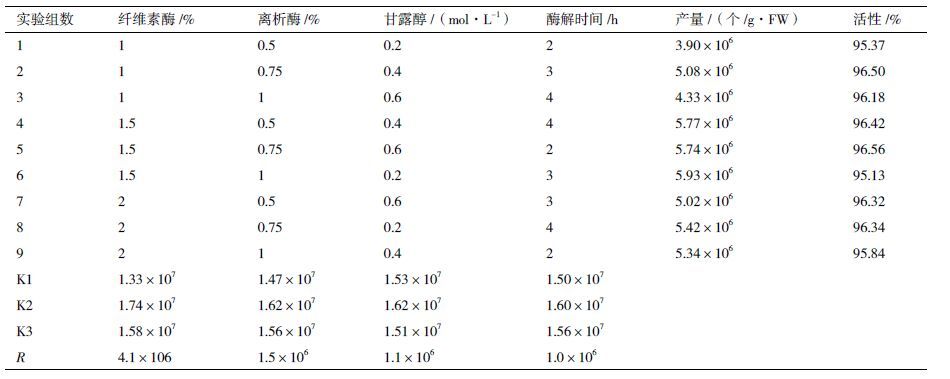
1.2 方法 1.2.1 小麦叶肉原生质体分离取2 g(约50-60 株)麦苗,用新的手术刀片切成0.5-1 mm 细条;立即将切好的材料浸没在0.4 mol/L 甘露醇中,黑暗处理10min ;弃掉甘露醇后,将细条培养在装有20 mL 酶解液的三角瓶中;用锡纸将三角瓶包好,黑暗条件下用真空干燥器抽真空30 min,使细条完全浸没在酶解液中(图 1-B);将三角瓶置于摇床中,在室温黑暗条件下以60-80 r/min 转速振荡酶解;当酶解液变绿后2 h 在显微镜下观察原生质体分离情况,每隔0.5 h 检测一次,约3 h 原生质体可充分释放(图 2)。

|
| 图 2 显微镜下观察分离到原生质体及原生质体活力检测 |
酶解结束后,用等体积的W5 洗液[2 mmol/L MES(pH5.7);154mmol/L NaCl ;125 mmol/L CaCl2 ;5 mmol/L KCl],稀释酶解液;将原生质体悬浮液经200 目(0.75 μm)的尼龙过滤网(提前用W5 洗液润洗)过滤到50 mL的离心管中去除未酶解的组织,每次用5 mL W5 洗液冲洗3-5 次;取滤液室温下100 g 离心5 min,去除上清液;用15 mL 的W5 洗液将原生质体重新悬浮起来,100 g 离心5 min,重复操作3 次洗涤纯化原生质体;最后用15 mL W5 溶液悬浮原生质体,60g 离心5 min 收集原生质体。
1.2.3 小麦原生质体分离条件的优化依据单因素试验结果及已报道的文献资料,选取纤维素酶浓度、离析酶浓度、甘露醇浓度及酶解时间4 个因素中较优的3 个水平进行正交试验设计,通过正交试验确定小麦原生质体分离的最优条件,实验设计因素水平,见表 1。
用5-10 倍的W5 溶液稀释收集到的原生质体,取少量原生质体悬浮液滴加在0.1 mm 血球计数板上,盖上盖玻片,在光学显微镜下(10×100)观测,计算4 个角上大格及中央大格(共5 个大格)内的原生质体数目,然后按公式计算原生质体总数,每个样品重复3 次,最后计算出每克材料分离得到的原生质体产量(个/g·FW)。
原生质体数(个/mL)=5 个大格内原生质体总数×5×1 000× 稀释倍数
原生质体产量(个/g)=[原生质体数(个/mL)×稀释后体积(mL)]/ 叶片质量(g)
1.2.5 原生质体活力测定采用FDA(Sigma)染色法检测原生质体活力。取100 μL 原生质体悬浮液,加入 2 μL 5 mg/mL FDA(丙酮溶解),2-5 min 后在荧光显微镜下观察[13],统计发绿色荧光的原生质体数和原生质体总数。原生质体活力以一个视野中有活力的原生质体占该视野中原生质体总数的百分数来表示,随机选取3 个视野进行统计。
原生质体活力=(发绿色荧光的原生质体数/ 原生质体总数)×100%
1.2.6 小麦原生质体转化将原生质体悬浮液200 g离心5 min,弃上清收集原生质体;用MMG 溶液(4mmol/L MES ;0.4 mol/L 甘露醇;15 mmol/L MgCl2)稀释原生质体至1×106 个/mL ;取100 μL 原生质体加入到2 mL tube 管中,每管加入10 μL 质粒(15-20μg)混匀;加入110 μL 不同浓度的PEG-Ca2+ 转化液(0.2 mol/L 甘露醇;100 mmol/L CaCl2 ;10%、20%、25%、30% 和40% PEG-4000);23℃暗培养20 min ;加入440 μL 的W5 溶液终止反应,200×g 离心5min ;弃上清,加入260 μL 的WI 溶液(4 mmol/LMES ;0.5 mol/L 甘露醇;5 mmol/L KCl),混匀后加入到24 孔板(BSA 洗液润洗),23℃暗培养24 h。
1.2.7 荧光素酶基因瞬时表达检测荧光素酶基因瞬时表达检测采用荧光素酶检测试剂盒(Promega,USA)在发光仪(Berthold,Germany)上检测所发荧光的强度,检测过程参照说明书,略加修改。
将用液氮快速冷冻转化后过夜培养的原生质体,充分研磨;加入100 μL CCLR(试剂盒中试剂)重新悬浮并匀浆;平衡至室温后1 000×g 离心2 min ;取上清,弃碎片,加入200 μL 裂解液和100 μL 检测试剂;混匀后,于发光仪上检测荧光素酶活性。
2 结果 2.1 小麦原生质体最佳分离条件的确定在设定的水平范围内,根据正交实验结果,对小麦原生质体的产量和活性进行极差分析,确定纤维素酶、离析酶、甘露醇浓度及酶解时间4 个因素对小麦原生质体产量及活性的影响(表 2)。
从表 2 中的极差分析可知,纤维素酶浓度的R值最大,说明这几个因素中纤维素酶浓度对小麦叶片原生质体分离影响最大;其次是离析酶浓度。在本研究中,选用播种后生长至第7 天小麦幼苗的叶片和叶鞘制备原生质体时,酶液组合为1.5% 纤维素酶及0.75% 离析酶,解离3 h 后分离到的原生质体的产量可以达到7.2×106 个/g·FW。
原生质体活力高低是代表原生质体分离质量好坏的重要指标之一,本研究中采用FDA 染色法对小麦原生质体进行染色,染色后发绿色荧光的原生质体为有活力的原生质体。荧光显微镜下观察大部分小麦原生质体发出绿光,染色清晰(图 2-D、E、F),最佳酶解条件下原生质体活力可高达98%。
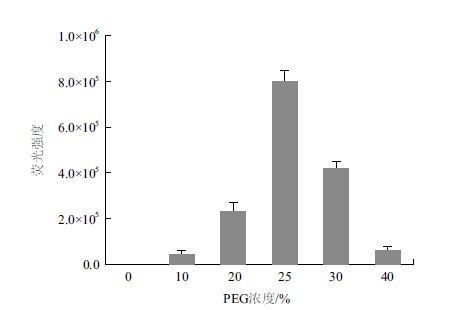
2.3 瞬时表达转化原生质体本研究将含有改造过的萤火虫荧光素酶的载体pBI221 通过PEG-Ca2+ 法转化进入小麦的原生质体,探讨了不同PEG 浓度对小麦原生质体的转化效率的影响。结果(图 3)发现,25% PEG 浓度下小麦原生质体的转化效率显著的高于其他浓度(P<0.01)最高,其次是30% 和20% 的PEG 浓度,10% 及40% 的PEG 浓度的相对较低,其中在10% 的PEG浓度下,小麦原生质体的转化效率最低。
|
| 图 3 不同浓度PEG 介导的转化小麦原生质体的瞬时表达荧光强度 |
原生质体可以从植物叶片、叶鞘、叶柄、茎等组织器官中分离出来,由于叶片来源广泛,叶肉细胞排列松散等特点,是植物原生质体分离的常用材料[14]。本研究在分别取用播种后水培养7 d 的小麦幼苗的叶片和叶鞘分离原生质体时,发现叶片与叶鞘分离出的原生质体的产量几乎相差无几,但取用幼茎作材料时,产量显著低于叶片和叶鞘。最适宜的培养时间为5-7 d,最佳为7 d,若低于5 d 由于材料过于幼嫩不容易控制酶解时间,同时分离到的碎片太多不利于后期遗传转化,即使调节酶解液浓度效果也不明显;超过7 d 后,相应要增加酶解时间,可能是叶片幼嫩程度不一致,随着酶解时间的延长,先分离出的原生质体就会破碎,产生的碎片也不利于后期遗传转化。因此,在本研究中,我们选用播种后生长7 d 左右的小麦幼苗的叶片和叶鞘作为分离材料时,得到的原生质体的产量最高,质量最佳。
酶解法是目前植物原生质体分离的主要方法,酶解材料时,酶液的组成、浓度、渗透压及酶解时间等因素对原生质体的产量和活力会产生显著的影响。酶液的组合和浓度要随酶解材料的不同略有差异[15, 16],孙鹤等[17]以10 日龄小麦叶片为材料分离原生质体,最佳酶液组合为1.5% 纤维素酶及0.5%离析酶,酶解5 h 后产量达6×106 个/g·FW。在本研究中,选用7 日龄小麦幼苗叶片和叶鞘制备原生质体,发现酶液组合为1.5% 纤维素酶及0.75% 离析酶,解离3 h 后产量就可达7.2×106 个/g·FW,采用此酶液的组合在缩短了酶解时间的同时,增加了原生质体的产量;酶解液中渗透压的调节是依赖于不同浓度的甘露醇来实现的,不适宜的渗透压会造成原生质体的胀裂或皱缩。在酶液和洗涤液中,广泛使用的渗透压调节剂浓度约在0.2-0.8 mol/L[18]。本实验结果表明,用0.4 mol/L 甘露醇作为渗透剂有利于小麦叶肉原生质体渗透压的稳定,分离的原生质体呈饱满球形,活力较高(图 2-A、C);酶解时间是影响原生质体分离的另一重要因素,酶解时间过短,原生质体释放不充分产量太低,时间过长则导致较早游离出来的原生质体破裂。本实验中酶解2 h 后仅有少量原生质体游离出来,超过3 h 的酶解时间虽然会使原生质体的产量增加,但细胞碎片增多,影响原生质体活力,不利于后续融合、转化等实验。经过综合分析,确定小麦原生质体分离最佳的酶解时间为3 h,此时分离的原生质体产量高、碎片少且均具有较高活性。
除此之外,原生质体分离的过程中还需要考虑其他的因素,如酶解液的pH 值、离心力、酶解温度等。酶解液的pH 值过低或过高时,产量都不高,原因是受到酶的活力的影响,纤维素酶的最适pH是5.5-6.0[19];离析酶有效作用的pH 是3.0-7.0[20],因此,酶解液的pH 要同时使两种酶的活性达到最佳。此外,pH 值还对细胞膜及细胞保护系统有较大的影响[18]。本研究从上述两方面考虑,确定酶液的最适pH 值为5.6。离心收集原生质体时所用离心力为100×g(brake 为3),离心时间为5 min 较合适,实验中发现离心力低于100 g 无法将原生质体完全沉淀下来,过大时会使沉淀下来的原生质体压实,后续无法充分洗涤干净,且会造成原生质体破碎降低原生质体产量。
活性染色法是测定原生质体活力的方法之一,其中最常用的是FDA 和台盼蓝染色。FDA 染色,即荧光素双醋酸酯染色法,因为FDA 本身不产生荧光,且能自由出入完整的细胞膜,当FDA 进入活细胞后,被细胞内的酯酶分解生成荧光素,因此有活力的原生质体能够产生荧光;台盼蓝染液可以通过死亡原生质体的细胞膜而使死亡细胞染成蓝色,但由于染料无法透过活细胞,因此活细胞不被着色,另外由于叶绿体的存在,在显微镜下看到的是深蓝色,不容易同活细胞区分[21]。因此,FDA 比台盼蓝染色更清晰,且不会受到叶绿体等内含物的干扰,并且适用于不同来源的原生质体。
影响原生质体转化效率的因素有许多,如原生质体纯度和活力、质粒DNA 大小和纯度、DNA 与原生质体的比例、孵育时间及PEG 浓度等[17, 22]。PEG 浓度是影响转化率的最重要因素,不同植物,甚至同种植物不同的供试组织分离到的原生质体,其转化所需的PEG 浓度都是存在差异的[23]。据报道,终浓度为10%-20% 的PEG 浓度可使拟南芥原生质体转化效率达到最佳[3]。有报道表明,25% 的PEG浓度对于10 日龄麦苗分离到的原生质转化率是最高的[17],在本研究中,也发现25% 的PEG 浓度对于7 日龄麦苗分离到的原生质体的转化率最高。
4 结论综合原生质体产量、活力及转化效率等多方面考虑,确定7 日龄小麦麦叶肉细胞原生质体分离的最佳条件为:酶解液组合为纤维素酶1.5%及离析酶0.75%,酶液中甘露醇浓度为0.4 mol/L,酶解时间为3 h,原生质体的产量可达7.2×106 个/g·FW,且分离到的原生质体呈饱满球形,淡绿色叶绿体多,清晰均匀分布在原生质体中,并含有颗粒状内含物,活力较强,均超过95%。在PEG 浓度为25% 时,小麦原生质体的转化率是最高的。
| [1] | Sheen J. Signal transduction in maize and Arabidopsis mesophyll protoplasts[J]. Plant Physiol, 2001, 127(4):1466-1475. |
| [2] | Robert S, Zouhar J, Carter C, Raikhel N. Isolation of intact vacuoles 2016,32(4) from Arabidopsis rosette leaf-derived protoplasts[J]. Nat Protoc, 2007, 2(2):259-262. |
| [3] | Yoo SD, Cho YH, and Sheen J. Arabidopsis mesophyll protoplasts :a versatile cell system for transient gene expression analysis[J]. Nat Protoc, 2007, 2(7):1565-1572. |
| [4] | Vasil IK, Vasil V. Totipotency and embryogenesis in plant cell and tissue cultures[J]. In Vitro, 1972, 8(3):117-125. |
| [5] | Zaitlin M, Beachy RN. The use of protoplasts and separated cells in plant virus research[J]. Advances in Virus Research, 1974, 19:1. |
| [6] | Cocking EC. A method for the isolation of plant protoplasts and vacuoles[J]. Nature, 1960, 187 :927-929. |
| [7] | Fischer R, Hain R. Tobacco protoplast transformation and use for functional analysis of newly isolated genes and gene constructs[J]. Methods Cell Biol, 1995, 50 :401-410. |
| [8] | Zhang Y, Su J, Duan S, et al. A highly efficient rice green tissue protoplast system for transient gene expression and studying light/ chloroplast-related processes[J]. Plant Methods, 2011, 7(1): 30. |
| [9] | Pitzschke A, Persak H. Poinsettia protoplasts - a simple, robust and efficient system for transient gene expression studies[J]. Plant Methods, 2012, 8(1):14. |
| [10] | Shahin E. Totipotency of tomato protoplasts[J]. Theoretical and applied genetics, 1985, 69(3):235-240. |
| [11] | 葛台明, 章荣德, 秦发兰, 等. 冬小麦原生质体培养的胚状体 直接发生[J]. 生物工程学报, 2000, 16(5):609-613. |
| [12] | 张小红, 闵东红, 邵景侠. 小麦愈伤组织诱导及原生质体的分 离与纯化[J]. 中国农学通报, 2010, 26(21):49-53. |
| [13] | Larkin PJ. Purification and viability determinations of plant protoplasts[J]. Planta, 1976, 128(3):213-216. |
| [14] | 彭小群, 唐然, 解新明. 禾本科植物原生质体分离研究进 展[J]. 中国农学通报, 2015(1):252-257. |
| [15] | Cao J, Yao D, Lin F et al. PEG-mediated transient gene expression and silencing system in maize mesophyll protoplasts :a valuable tool for signal transduction study in maize[J]. Acta Physiologiae Plantarum, 2014, 36(5):1271-1281. |
| [16] | Yang JW, Fu JX, Li J et al. Novel Co-immunoprecipitation protocol based on protoplast transient gene expression for studying protein and protein interactions in rice[J]. Plant Molecular Biology Reporter, 2014, 32(1):153-161. |
| [17] | 孙鹤, 郎志宏, 朱莉, 等. 玉米, 小麦, 水稻原生质体制备条件 优化[J]. 生物工程学报, 2013, 29(2):224-234. |
| [18] | 赵红娟, 张博, 陈爱萍, 等. 酶解对苜蓿子叶原生质体分离效 果的影响[J]. 草地学报, 2008, 16(1):50-53. |
| [19] | 路梅, 李多川. 嗜热毛壳菌(Chaetomium thermophile)液体发 酵产生纤维素酶及酶学性质的研究[J]. 工业微生物, 2003, 33(3):21-24. |
| [20] | 林开江, 袁康培, 王坤元, 等. 植物细胞离析酶的制备和应 用[J]. 生物工程学报, 1994, 10(1):71-75. |
| [21] | 黄静, 赵琦, 李楠, 等. 烟草原生质体活力检测和细胞核染色 方法的研究[J]. 首都师范大学学报, 2007, 28(4):42-45. |
| [22] | 霍鹏, 言普, 沈文涛, 等. PEG 介导番木瓜叶肉原生质体瞬时 表达体系的建立[J]. 分子植物育种, 2015(4):808-815. |
| [23] | 何业华, 胡芳名. 枣树原生质体分离条件的研究[J]. 中南林 学院学报, 1999, 19(1):20-23. |